名校
解题方法
1 . 下列离子方程式正确的是
A.二元弱碱 与足量稀硫酸溶液反应: 与足量稀硫酸溶液反应: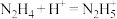 |
B. 溶于浓氨水: 溶于浓氨水: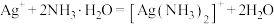 |
C.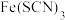 溶液中加 溶液中加 溶液: 溶液: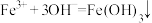 |
D. 溶液吸收 溶液吸收 : : |
您最近一年使用:0次
名校
2 . 碘酸钾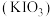 是常用的食盐加碘剂,用
是常用的食盐加碘剂,用 氧化
氧化 得到
得到 溶液,再经一系列步骤得到
溶液,再经一系列步骤得到 产品。
产品。 是一种白色晶体,在水中溶解度随温度升高而增大。
是一种白色晶体,在水中溶解度随温度升高而增大。
下列说法错误的是
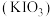 是常用的食盐加碘剂,用
是常用的食盐加碘剂,用 氧化
氧化 得到
得到 溶液,再经一系列步骤得到
溶液,再经一系列步骤得到 产品。
产品。
 是一种白色晶体,在水中溶解度随温度升高而增大。
是一种白色晶体,在水中溶解度随温度升高而增大。下列说法错误的是
A.水浴加热时发生反应的离子方程式为 |
| B.滴入适量乙醇的作用是除去多余的高锰酸钾 |
| C.为提高洗涤效果,可用热水进行洗涤 |
| D.在冷却结晶时,温度过低可能导致产品的纯度降低 |
您最近一年使用:0次
名校
解题方法
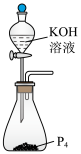
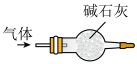
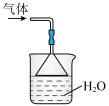
3 .  气体微溶于水,有强还原性,可由反应
气体微溶于水,有强还原性,可由反应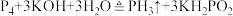 制得。实验室制取少量
制得。实验室制取少量 的原理及装置均正确的是
的原理及装置均正确的是
 气体微溶于水,有强还原性,可由反应
气体微溶于水,有强还原性,可由反应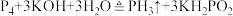 制得。实验室制取少量
制得。实验室制取少量 的原理及装置均正确的是
的原理及装置均正确的是
|
|
A.制取 | B.干燥 |
|
|
C.收集 | D.吸收尾气中的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 有机氟化学在材料科学、催化化学以及生物化学等领域引起了越来越多的重视。一种以Ni的配合物Ni(IMes)L催化氟苯的碳—氟键芳基化反应制备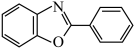 的机理如图所示。下列说法正确的是
的机理如图所示。下列说法正确的是
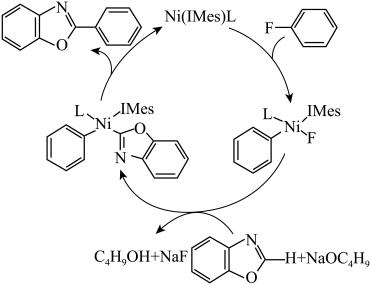
| A.该总反应原子利用率为100% |
| B.该历程涉及C-H键的断裂和形成 |
| C.该反应过程中涉及四种中间产物 |
D.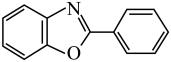 中苯环上的一氯代物7种 中苯环上的一氯代物7种 |
您最近一年使用:0次
7日内更新
|
138次组卷
|
2卷引用:广西桂林市第十八中学2023-2024学年高三下学期5月月考化学试卷
名校
解题方法
5 . 钴广泛应用于机械制造、电子电器、航空航天、电池制造等行业,是国家重要的战略资源。用含钴废料(主要成分为 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题:
① 具有强氧化性。
具有强氧化性。
② ,
, 。
。
(1)为提高含钴废料的浸出效率,可采取的措施是___________ (任写一条)。
(2) 在水溶液中的电离方程式为
在水溶液中的电离方程式为___________ ;浸出渣的主要成分为___________ (填化学式)。
(3)向“浸出液”中加入适量的 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)①“除钙镁”后,滤液中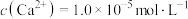 时,
时,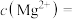
___________  。
。
②若“调pH”时溶液的pH偏低,将会导致 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是___________ 。
(5)将 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: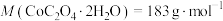 ,曲线中330℃及以上所得固体均为钴氧化物]
,曲线中330℃及以上所得固体均为钴氧化物] ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为___________ 。
 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题: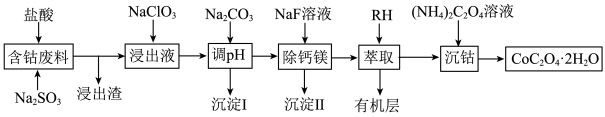
①
 具有强氧化性。
具有强氧化性。②
 ,
, 。
。(1)为提高含钴废料的浸出效率,可采取的措施是
(2)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(3)向“浸出液”中加入适量的
 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为(4)①“除钙镁”后,滤液中
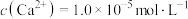 时,
时,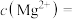
 。
。②若“调pH”时溶液的pH偏低,将会导致
 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是(5)将
 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: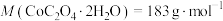 ,曲线中330℃及以上所得固体均为钴氧化物]
,曲线中330℃及以上所得固体均为钴氧化物]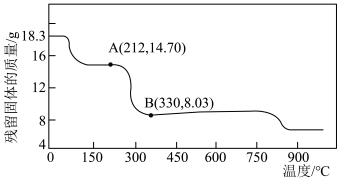
 ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为
您最近一年使用:0次
7日内更新
|
198次组卷
|
5卷引用:河南省许昌高级中学2023-2024学年高三下学期5月月考化学试题
名校
解题方法
6 . 某高分子化合物M常用于制作眼镜镜片,可由N和P两种物质合成,M、N、P的结构如图所示,下列说法正确的是
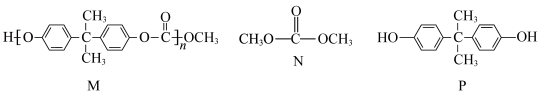
| A.N与P合成M的反应为加聚反应 | B.M的链节中在同一平面的碳原子最多有14个 |
| C.P在空气中很稳定,可以保存在广口瓶中 | D.常温下,M、N、P均易溶于水 |
您最近一年使用:0次
7日内更新
|
349次组卷
|
4卷引用:河南省许昌高级中学2023-2024学年高三下学期5月月考化学试题
名校
7 . 下列离子方程式书写正确的是
A.铅酸蓄电池放电时的负极反应: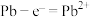 |
B.药物碘化钾片和加碘盐不可同时服用: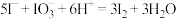 |
C.向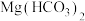 溶液中加入足量NaOH溶液: 溶液中加入足量NaOH溶液: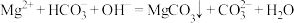 |
D.向食盐的氨水溶液中通入足量 气体后生成沉淀: 气体后生成沉淀: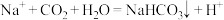 |
您最近一年使用:0次
7日内更新
|
230次组卷
|
3卷引用:广东省名校教研联盟2023-2024学年高三下学期5月测试化学试题
广东省名校教研联盟2023-2024学年高三下学期5月测试化学试题2024届甘肃省民乐县第一中学高三下学期5月模拟考试化学试卷(已下线)第02讲 离子反应、离子方程式(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
8 . 减少 的排放、捕集并利用
的排放、捕集并利用 是我国能源领域的一个重要战略方向。
是我国能源领域的一个重要战略方向。
在 加氢合成甲醇的体系中,同时存在以下反应:
加氢合成甲醇的体系中,同时存在以下反应:
反应i: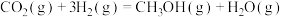
 kJ/mol
kJ/mol
反应ii:
 kJ/mol
kJ/mol
(1)反应iii: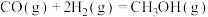 的
的
___________ 。
(2)在 加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。
加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。
(3)某温度下,向容积恒为1 L的密闭容器中通入1 mol 和5 mol
和5 mol  ,10 min后体系达到平衡,此时
,10 min后体系达到平衡,此时 的转化率为20%。
的转化率为20%。 的选择性为50%。[已知:
的选择性为50%。[已知: 的选择性:
的选择性: ]
]
①反应i的平衡常数
___________ (写出计算式即可)。
②反应ii的净速率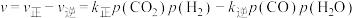 ,其中
,其中 、
、 分别为正、逆反应的速率常数,p为气体的分压。降低温度时,
分别为正、逆反应的速率常数,p为气体的分压。降低温度时,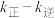
___________ (填“增大”“减小”或“不变”)。
③其他条件相同时,反应温度对 的平衡转化率和
的平衡转化率和 的选择性的影响如图甲所示,温度高于260°C时,
的选择性的影响如图甲所示,温度高于260°C时, 的平衡转化率变化的原因是
的平衡转化率变化的原因是___________ 。 的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:
的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:___________ 。
(4)利用如图所示原理去除NO:___________ ,每产生224 mL  (体积已换算成标准状况,不考虑
(体积已换算成标准状况,不考虑 的溶解),可处理NO的物质的量为
的溶解),可处理NO的物质的量为___________ mol。
 的排放、捕集并利用
的排放、捕集并利用 是我国能源领域的一个重要战略方向。
是我国能源领域的一个重要战略方向。在
 加氢合成甲醇的体系中,同时存在以下反应:
加氢合成甲醇的体系中,同时存在以下反应:反应i:
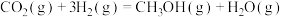
 kJ/mol
kJ/mol反应ii:

 kJ/mol
kJ/mol(1)反应iii:
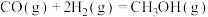 的
的
(2)在
 加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。
加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。| A.若在绝热恒容容器,反应i的平衡常数K保持不变,说明反应i、ii都已达平衡 |
| B.若气体的平均相对分子质量不变,说明反应i、ii都已达平衡 |
| C.体系达平衡后,若压缩体积,反应i平衡正向移动,反应i平衡不移动 |
| D.选用合适的催化剂可以提高甲醇在单位时间内的产量 |
(3)某温度下,向容积恒为1 L的密闭容器中通入1 mol
 和5 mol
和5 mol  ,10 min后体系达到平衡,此时
,10 min后体系达到平衡,此时 的转化率为20%。
的转化率为20%。 的选择性为50%。[已知:
的选择性为50%。[已知: 的选择性:
的选择性: ]
]①反应i的平衡常数

②反应ii的净速率
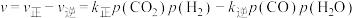 ,其中
,其中 、
、 分别为正、逆反应的速率常数,p为气体的分压。降低温度时,
分别为正、逆反应的速率常数,p为气体的分压。降低温度时,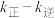
③其他条件相同时,反应温度对
 的平衡转化率和
的平衡转化率和 的选择性的影响如图甲所示,温度高于260°C时,
的选择性的影响如图甲所示,温度高于260°C时, 的平衡转化率变化的原因是
的平衡转化率变化的原因是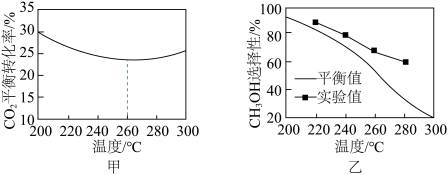
 的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:
的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:(4)利用如图所示原理去除NO:
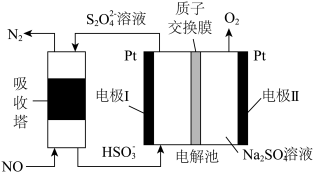
 (体积已换算成标准状况,不考虑
(体积已换算成标准状况,不考虑 的溶解),可处理NO的物质的量为
的溶解),可处理NO的物质的量为
您最近一年使用:0次
名校
解题方法
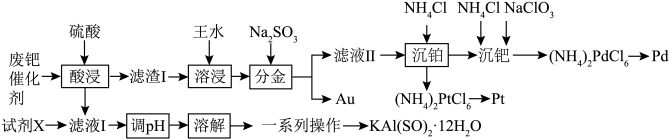
9 . 用(B)的性质与铂(Pt)相似,一种从废钯催化剂(主要成分约Pd、Pt、Au和As4O3,还含少量Fe2O3、Al2O3等)中回收海绵钯、海绵铂和制备KAl(SO4)2·12H2O的工艺流程如图所示:
②(NH4)2PdCl6和(NH4)2PtCl6难溶于水,但(NH4)2PdCl4溶于水易溶于盐酸。
③当溶液中某离子浓度c(Mn+)≤1×10-5mol⋅L-1时,可认为该离子沉淀完全;常温下,几种沉淀的Ksp如下表所示:
回答下列问题:
(1)“酸浸”时,需要将废钯催化剂粉碎后再加入硫酸,同时在溶液底部鼓入N2,则鼓入N2的目的是___________ 。
(2)“溶浸”操作完成后需要加入一种酸加热赶硝后再进行过滤等操作,这种酸是___________ ,“分金”时,被还原的元素有___________ ,得到Au单质的离子方程式为___________ 。
(3)“沉钯”操作中,加入NaClO3不能过量太多的原因是___________ ,问(NH4)2PtCl6和(NH4)2PdCl6中分别通入N2H4,在焙烧条件下可制得海绵铂和海绵钯,N2H4被氧化成N2,再将海绵铂和海绵钯混合合成Pt4Pd3的合金,若最终得到1mol Pt4Pd3的合金,理论上消耗的N2H4最小质量为___________ g。
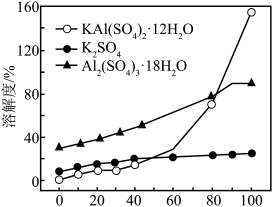
(4)“滤液I”中加入的“试剂X”是___________ ,“溶解”时,向所得沉淀中分批加入硫酸,同时不断搅拌,当沉淀完全溶解后,结合溶解度图像,则获得KAl(SO4)2·12H2O的最佳实验操作为___________ 。
②(NH4)2PdCl6和(NH4)2PtCl6难溶于水,但(NH4)2PdCl4溶于水易溶于盐酸。
③当溶液中某离子浓度c(Mn+)≤1×10-5mol⋅L-1时,可认为该离子沉淀完全;常温下,几种沉淀的Ksp如下表所示:
| Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Fe(OH)2 | |
| Ksp | 1×10-38 | 1×10-33 | 2×10-20 | 5×10-17 |
(1)“酸浸”时,需要将废钯催化剂粉碎后再加入硫酸,同时在溶液底部鼓入N2,则鼓入N2的目的是
(2)“溶浸”操作完成后需要加入一种酸加热赶硝后再进行过滤等操作,这种酸是
(3)“沉钯”操作中,加入NaClO3不能过量太多的原因是
(4)“滤液I”中加入的“试剂X”是
您最近一年使用:0次
名校
解题方法
10 . 亚硝酸钙[Ca(NO2)2]可作为混凝土防冻剂和钢筋阻锈剂的主要原料。某兴趣小组根据反应 ,利用如下装置(部分装置可重复选用)制备无水亚硝酸钙。(夹持装置略)。
,利用如下装置(部分装置可重复选用)制备无水亚硝酸钙。(夹持装置略)。
②NO能被酸性KMnO4溶液氧化
③ ;
;
回答下列问题:
(1)仪器X的名称是___________ ,装置连接顺序为:___________ (填标号);
A→___________→C→___________→___________→E
(2)下列说法正确的是___________。
(3)写出装置E中的离子方程式___________ 。
(4)①某Ca(NO2)2样品中混有杂质Ca(NO3)2,通过以下方法可测定产品纯度:称量4.110g样品溶于水,加Na2SO4固体,充分振荡,过滤后滤液定容至250mL,取25.00mL进行以下操作: ;“还原
;“还原 ”时加入25.00mL 0.1000 mol∙L-1的(NH4)2Fe(SO4)2标准液,“滴定剩余Fe2+”时消耗0.0100 mol∙L-1的K2Cr2O7标准溶液16.60mL。则样品中Ca(NO2)2的质量分数为
”时加入25.00mL 0.1000 mol∙L-1的(NH4)2Fe(SO4)2标准液,“滴定剩余Fe2+”时消耗0.0100 mol∙L-1的K2Cr2O7标准溶液16.60mL。则样品中Ca(NO2)2的质量分数为___________ 。
②下列情况会导致Ca(NO2)2的质量分数测量值偏小的是___________ 。
A.滴定完毕后立即读数
B.煮沸过程中不充分,未使 除尽
除尽
C.滴定管用蒸馏水洗净后未用K2Cr2O7标准液润洗
 ,利用如下装置(部分装置可重复选用)制备无水亚硝酸钙。(夹持装置略)。
,利用如下装置(部分装置可重复选用)制备无水亚硝酸钙。(夹持装置略)。
②NO能被酸性KMnO4溶液氧化
③
 ;
;回答下列问题:
(1)仪器X的名称是
A→___________→C→___________→___________→E
(2)下列说法正确的是___________。
| A.恒压滴液漏斗的作用是使稀硝酸顺利滴下并减少稀硝酸挥发 |
| B.反应前后通氮气的作用相同 |
| C.装置D的作用是除去挥发的硝酸 |
| D.可用淀粉KI(酸性)溶液检验产品中混有的Ca(NO3)2 |
(3)写出装置E中的离子方程式
(4)①某Ca(NO2)2样品中混有杂质Ca(NO3)2,通过以下方法可测定产品纯度:称量4.110g样品溶于水,加Na2SO4固体,充分振荡,过滤后滤液定容至250mL,取25.00mL进行以下操作:
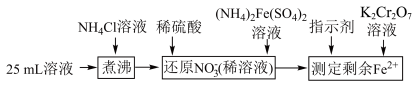
 ;“还原
;“还原 ”时加入25.00mL 0.1000 mol∙L-1的(NH4)2Fe(SO4)2标准液,“滴定剩余Fe2+”时消耗0.0100 mol∙L-1的K2Cr2O7标准溶液16.60mL。则样品中Ca(NO2)2的质量分数为
”时加入25.00mL 0.1000 mol∙L-1的(NH4)2Fe(SO4)2标准液,“滴定剩余Fe2+”时消耗0.0100 mol∙L-1的K2Cr2O7标准溶液16.60mL。则样品中Ca(NO2)2的质量分数为②下列情况会导致Ca(NO2)2的质量分数测量值偏小的是
A.滴定完毕后立即读数
B.煮沸过程中不充分,未使
 除尽
除尽C.滴定管用蒸馏水洗净后未用K2Cr2O7标准液润洗
您最近一年使用:0次