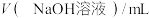名校
1 . 过氧化镁( )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得 ,同时放出大量热。一种制备
,同时放出大量热。一种制备 的流程如图所示:
的流程如图所示:
(1)操作a为______ ;沉淀过程中需要加入稳定剂并控制温度,原因为____________ 。
(2)煅烧 的化学反应方程式
的化学反应方程式______________ 。
(3) 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中 的含量。某研究小组拟用下图装置测定样品(含MgO杂质)中
的含量。某研究小组拟用下图装置测定样品(含MgO杂质)中 的含量。
的含量。
①_______________________ ;
② ,稀盐酸中加入
,稀盐酸中加入 溶液的作用是
溶液的作用是______ 。
(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、_____________ 。
(5)该小组记录的实验数据如下,样品的质量为m g;反应开始前量气管的读数为a mL;反应结束后量气管的读数为b mL,则样品中过氧化镁的质量分数为____________ 。(列出表达式)(该实验条件下 密度为
密度为 )
)
 )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得 ,同时放出大量热。一种制备
,同时放出大量热。一种制备 的流程如图所示:
的流程如图所示: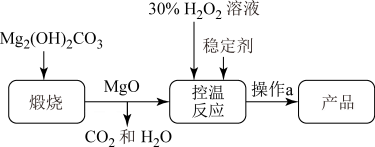
(1)操作a为
(2)煅烧
 的化学反应方程式
的化学反应方程式(3)
 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中 的含量。某研究小组拟用下图装置测定样品(含MgO杂质)中
的含量。某研究小组拟用下图装置测定样品(含MgO杂质)中 的含量。
的含量。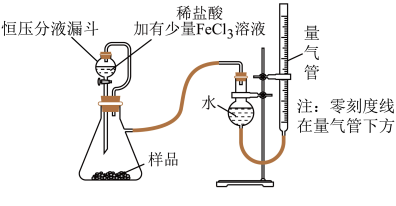
①
②
 ,稀盐酸中加入
,稀盐酸中加入 溶液的作用是
溶液的作用是(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、
(5)该小组记录的实验数据如下,样品的质量为m g;反应开始前量气管的读数为a mL;反应结束后量气管的读数为b mL,则样品中过氧化镁的质量分数为
 密度为
密度为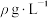 )
)
您最近一年使用:0次
名校
解题方法
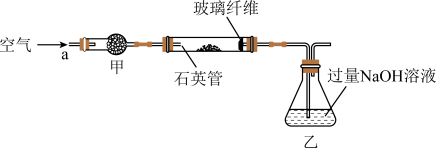
2 . 黄铁矿(FeS2)因其浅黄铜色和明亮的金属光泽,常被误认为是黄金,故又称为“愚人金”。某兴趣小组设计如下实验方案,测定某高纯黄铁矿石中硫元素的含量。称取m₁g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全,得到红棕色固体和一种刺激性气味的气体。___________ 。
(2)上图中,干燥管甲内所盛试剂是___________ 。
(3)有同学提出该实验装置存在安全隐患,请用简洁的文字说明:___________ 。
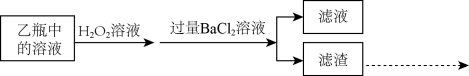
(4)反应结束后,将乙瓶中的溶液进行如下处理:
(5)反应后乙瓶溶液所含的阴离子分别为: 、
、__________ 和__________ (填离子符号),请简要和写出检验 的实验步骤:
的实验步骤:__________ 。
(2)上图中,干燥管甲内所盛试剂是
(3)有同学提出该实验装置存在安全隐患,请用简洁的文字说明:
(4)反应结束后,将乙瓶中的溶液进行如下处理:
(5)反应后乙瓶溶液所含的阴离子分别为:
 、
、 的实验步骤:
的实验步骤:
您最近一年使用:0次
名校
解题方法
3 . 综合题
 .铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:
.铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:
(1)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),酸性环境中Fe2+脱除水体中硝态氮(NO )且无污染,写出该反应的离子方程式:
)且无污染,写出该反应的离子方程式:___________ 。
(2)土壤中的铁元素含量的测定:
乙二胺四乙酸又叫 ,是化学中一种良好的配合剂,形成的配合物又叫螯合物。
,是化学中一种良好的配合剂,形成的配合物又叫螯合物。 在配位滴定中用到,一般是测定金属离子的含量。已知:
在配位滴定中用到,一般是测定金属离子的含量。已知: 配离子结构如图,M为Fe3+。
配离子结构如图,M为Fe3+。 中氮原子杂化方式
中氮原子杂化方式___________ ,该配合物中Fe3+配位数是___________ 。
②土壤中的铁元素含量测定步骤:
第一步:取ag土壤试样溶解,加入足量H2O2,将溶液充分加热。
第二步:将上述液体配成100mL溶液,取25.00mL,,滴入两滴二甲酚橙作指示剂,用bmol·L-1EDTA(简写成H2Y2-)标准溶液滴定,反应的离子方程式为Fe3++H2Y2-=FeY-+2H+。达到滴定终点时,消耗EDTA标准溶液的平均体积为12.50mL。该土壤中的铁元素质量分数为___________ (用含a、b的代数式表示)。
③第一步加入足量H2O2的目的是:___________ 。
④若在滴定操作中一些不当操作可能会引起误差,下列操作会使土壤中的铁元素质量分数测定结果偏高的是:___________ 。
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点,读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛放EDTA(简写成H2Y2-)标准溶液的滴定管用蒸馏水洗净后未用标准液润洗
 .铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
.铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。___________ 。
(4)若该晶胞的边长为d nm,则该合金的密度为___________  。(列出计算式即可,设阿伏加德罗常数的值为NA)
。(列出计算式即可,设阿伏加德罗常数的值为NA)
(5)若该晶体储氢时,H2分子在晶胞的体心和棱心位置,则含镁 48g的该储氢合金可储存标准状况下H2的体积约为___________ L。
 .铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:
.铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:(1)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),酸性环境中Fe2+脱除水体中硝态氮(NO
 )且无污染,写出该反应的离子方程式:
)且无污染,写出该反应的离子方程式:(2)土壤中的铁元素含量的测定:
乙二胺四乙酸又叫
 ,是化学中一种良好的配合剂,形成的配合物又叫螯合物。
,是化学中一种良好的配合剂,形成的配合物又叫螯合物。 在配位滴定中用到,一般是测定金属离子的含量。已知:
在配位滴定中用到,一般是测定金属离子的含量。已知: 配离子结构如图,M为Fe3+。
配离子结构如图,M为Fe3+。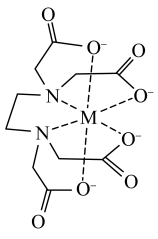
 中氮原子杂化方式
中氮原子杂化方式②土壤中的铁元素含量测定步骤:
第一步:取ag土壤试样溶解,加入足量H2O2,将溶液充分加热。
第二步:将上述液体配成100mL溶液,取25.00mL,,滴入两滴二甲酚橙作指示剂,用bmol·L-1EDTA(简写成H2Y2-)标准溶液滴定,反应的离子方程式为Fe3++H2Y2-=FeY-+2H+。达到滴定终点时,消耗EDTA标准溶液的平均体积为12.50mL。该土壤中的铁元素质量分数为
③第一步加入足量H2O2的目的是:
④若在滴定操作中一些不当操作可能会引起误差,下列操作会使土壤中的铁元素质量分数测定结果偏高的是:
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点,读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛放EDTA(简写成H2Y2-)标准溶液的滴定管用蒸馏水洗净后未用标准液润洗
 .铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
.铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。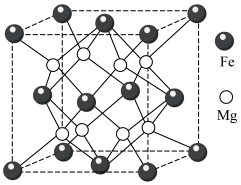
(4)若该晶胞的边长为d nm,则该合金的密度为
 。(列出计算式即可,设阿伏加德罗常数的值为NA)
。(列出计算式即可,设阿伏加德罗常数的值为NA)(5)若该晶体储氢时,H2分子在晶胞的体心和棱心位置,则含镁 48g的该储氢合金可储存标准状况下H2的体积约为
您最近一年使用:0次
名校
解题方法
4 . 采用氧化沉淀法可以利用绿矾制取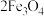 ,其制取流程如图所示:
,其制取流程如图所示:___________ (填写化学式),由溶液 获得该副产品的操作是:蒸发浓缩→
获得该副产品的操作是:蒸发浓缩→___________ →过滤洗涤 晶体加热至完全失去结晶水。
晶体加热至完全失去结晶水。
(2)某兴趣小组模仿如图流程制取 ,在实验前要测定绿矾的含量:称取
,在实验前要测定绿矾的含量:称取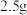 工业绿矾,配制成
工业绿矾,配制成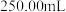 溶液。量取
溶液。量取 溶液于锥形瓶中,用
溶液于锥形瓶中,用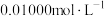 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为
溶液的平均体积为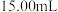 。(滴定时发生反应的离子方程式为
。(滴定时发生反应的离子方程式为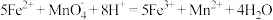 )则绿矾的质量分数为
)则绿矾的质量分数为___________ (计算结果保留三位小数)。
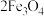 ,其制取流程如图所示:
,其制取流程如图所示:
 获得该副产品的操作是:蒸发浓缩→
获得该副产品的操作是:蒸发浓缩→ 晶体加热至完全失去结晶水。
晶体加热至完全失去结晶水。(2)某兴趣小组模仿如图流程制取
 ,在实验前要测定绿矾的含量:称取
,在实验前要测定绿矾的含量:称取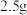 工业绿矾,配制成
工业绿矾,配制成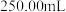 溶液。量取
溶液。量取 溶液于锥形瓶中,用
溶液于锥形瓶中,用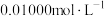 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为
溶液的平均体积为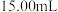 。(滴定时发生反应的离子方程式为
。(滴定时发生反应的离子方程式为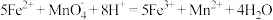 )则绿矾的质量分数为
)则绿矾的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 某处工厂排出的烟道气中含氮氧化物(主要为NO、 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式______________ ;若反应后尾气无残留,则参加反应的 、NO物质的量比值为
、NO物质的量比值为_____ (填字母)。
a.≥1 b.≤1 c.任意值
(2)可使用适量酸性 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(4)有氧条件下,NO在催化剂作用下可被 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是___________ 。
(5)羟基自由基( )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程:______________ 。 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加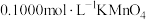 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗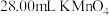 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数__________ 。(写出计算过程)
 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: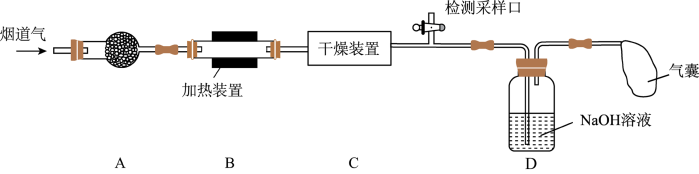
 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式 、NO物质的量比值为
、NO物质的量比值为a.≥1 b.≤1 c.任意值
(2)可使用适量酸性
 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性
 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是(4)有氧条件下,NO在催化剂作用下可被
 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: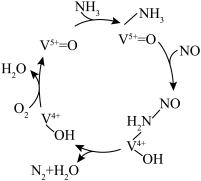
 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是(5)羟基自由基(
 )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程: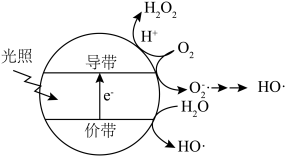
 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加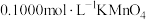 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗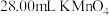 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数
您最近一年使用:0次
2024-05-03更新
|
256次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
6 . Cl2是工业制备的一种重要原料,很多物质的制备都需要用到氯气。比如工业上用Cl2制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3,2PCl3+O2=2POCl3。
已知:PCl3、POCl3的部分性质如下:
某化学兴趣小组模拟该工艺设计实验装置如图(某些夹持装置已略去):
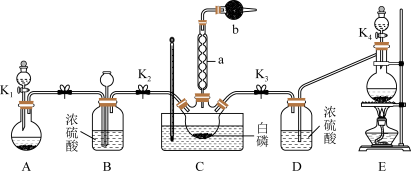
(1)装置E中制备的气体是___________ 。
(2)b中盛放的药品及作用是___________ 。
(3)C反应温度控制在60~65℃,不能过高或过低的原因是___________ 。
(4)通过测定三氯氧磷粗产品(还含有一定量的PCl3)中氯元素含量,可进一步计算产品三氯氧磷的纯度,实验步骤如下:①取ag产品置于盛50.00mL蒸馏水的水解瓶中,摇动至完全水解,将水解液配成100.00mL溶液,预处理排除含磷粒子的影响。②取10.00mL溶液于锥形瓶中,向其中加入C0 mol/L的AgNO3溶液V0mL,使Cl-完全沉淀,然后选择Fe(NO3)3,指示剂,用c1mol/L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为V1mL。滴定终点的现象:___________ 。
(5)产品中POCl3的质量分数为___________ 。
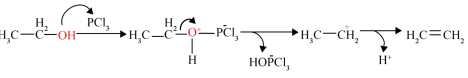
(6)乙醇制备乙烯可在无水PCl3的催化作用下,该催化机理如下所示,某同学判断该机理中一定有水生成,请写出生成H2O的步骤中反应方程式___________ 。
已知:PCl3、POCl3的部分性质如下:
| 熔点/℃ | 沸点/℃ | 相对分子质量 | 其它 | |
| PCl3 | -112 | 75.5 | 137.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 153.5 | 遇水生成H3PO4和HCl |

(1)装置E中制备的气体是
(2)b中盛放的药品及作用是
(3)C反应温度控制在60~65℃,不能过高或过低的原因是
(4)通过测定三氯氧磷粗产品(还含有一定量的PCl3)中氯元素含量,可进一步计算产品三氯氧磷的纯度,实验步骤如下:①取ag产品置于盛50.00mL蒸馏水的水解瓶中,摇动至完全水解,将水解液配成100.00mL溶液,预处理排除含磷粒子的影响。②取10.00mL溶液于锥形瓶中,向其中加入C0 mol/L的AgNO3溶液V0mL,使Cl-完全沉淀,然后选择Fe(NO3)3,指示剂,用c1mol/L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为V1mL。滴定终点的现象:
(5)产品中POCl3的质量分数为
(6)乙醇制备乙烯可在无水PCl3的催化作用下,该催化机理如下所示,某同学判断该机理中一定有水生成,请写出生成H2O的步骤中反应方程式

您最近一年使用:0次
名校
7 . 阅读下列短文,并回答相关问题。
宴会上有一道菜肴烤鲜鱼。服务员手捧一个 内盛一条被
内盛一条被 严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点
严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点 ,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点
,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点 ,只见火焰呈现鲜明的橙黄色。
,只见火焰呈现鲜明的橙黄色。
(1)物质①~④中,属于单质的有______ (填序号,下同),属于化合物的有______ ,属于混合物的有______ 。
(2)酒精的分子式为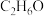 ,燃烧时的化学方程式为
,燃烧时的化学方程式为______ ,酒精中 的质量分数为
的质量分数为______ (用百分数表示,保留3位数字),已知物质碳元素含量较高时,在空气中燃烧时冒黑烟。乙醇在空气中充分燃烧时火焰为淡蓝色的原因可能是______ 。
(3)已知铝燃烧发出耀眼的白光,撒一点食盐后火焰呈黄色与化学定性操作______ 有关。
(4)已知淀粉遇碘单质 会变为蓝色,某学生为了检验食盐中的碘酸钾
会变为蓝色,某学生为了检验食盐中的碘酸钾 ,往食盐中加入少量
,往食盐中加入少量 溶液与醋酸
溶液与醋酸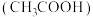 ,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:
,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:______ 。
宴会上有一道菜肴烤鲜鱼。服务员手捧一个
 内盛一条被
内盛一条被 严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点
严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点 ,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点
,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点 ,只见火焰呈现鲜明的橙黄色。
,只见火焰呈现鲜明的橙黄色。(1)物质①~④中,属于单质的有
(2)酒精的分子式为
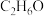 ,燃烧时的化学方程式为
,燃烧时的化学方程式为 的质量分数为
的质量分数为(3)已知铝燃烧发出耀眼的白光,撒一点食盐后火焰呈黄色与化学定性操作
(4)已知淀粉遇碘单质
 会变为蓝色,某学生为了检验食盐中的碘酸钾
会变为蓝色,某学生为了检验食盐中的碘酸钾 ,往食盐中加入少量
,往食盐中加入少量 溶液与醋酸
溶液与醋酸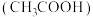 ,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:
,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:
您最近一年使用:0次
2023-12-26更新
|
57次组卷
|
2卷引用:江西省鹰潭市2023-2024学年高一上学期11月期中化学试题
名校
解题方法
8 . 以高硫铝土矿(主要成分为 、
、 、
、 ,还含少量
,还含少量 和硫酸盐)为原料制备聚合硫酸铁
和硫酸盐)为原料制备聚合硫酸铁 (
(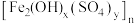 )的工艺流程如图:
)的工艺流程如图:
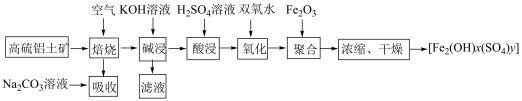
已知:常温下,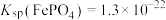 ,
,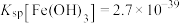 。
。
(1)铁元素位于元素周期表的第______ 周期第______ 族。
(2)①“焙烧”过程会产生 ,足量
,足量 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为___________ 。
②用某浓度的 溶液吸收
溶液吸收 的过程中,溶液的
的过程中,溶液的 随吸收时间的关系、尾气中
随吸收时间的关系、尾气中 质量分数与溶液
质量分数与溶液 的关系分别如图所示。
的关系分别如图所示。
则每隔___________  需要更换
需要更换 溶液。
溶液。
(3)若在实验室“焙烧”,则盛放固体物质的容器名称为___________ ;“碱浸”时应将焙烧渣粉碎后再研磨成细粉,目的是___________ 。
(4)聚合硫酸铁(PFS)是一种新型的无机高分子絮凝剂,能有效去除污水中的含磷化合物。处理后的污水中的不同含磷物质的浓度(计为磷浓度,单位略)与PFS投加量的关系如图所示。
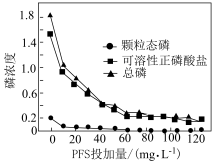
①当PFS投加量小于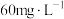 时,可溶性正磷酸盐浓度显著下降的原因为
时,可溶性正磷酸盐浓度显著下降的原因为___________ 。
②随着PFS投加量的增加,污水中颗粒态磷的浓度几乎为零的原因为___________ 。
(5)已知:聚合硫酸铁一等品质总铁含量指标要求为铁的质量分数大于11.0%。为测定某聚合硫酸铁样品中铁的含量是否达到一等品质指标要求,进行如下实验:
a.准确称取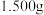 该聚合硫酸铁样品溶于适量硫酸,配成
该聚合硫酸铁样品溶于适量硫酸,配成 溶液
溶液 。
。
b.准确量取 溶液
溶液 ,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液
,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液 。
。
c.用 的酸性
的酸性 溶液滴定溶液
溶液滴定溶液 ,恰好反应完全时消耗酸性
,恰好反应完全时消耗酸性 溶液的体积为
溶液的体积为 。
。
该聚合硫酸铁样品中铁的含量___________ (填“已达到”或“未达到”)一等品质指标要求。
 、
、 、
、 ,还含少量
,还含少量 和硫酸盐)为原料制备聚合硫酸铁
和硫酸盐)为原料制备聚合硫酸铁 (
(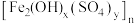 )的工艺流程如图:
)的工艺流程如图:
已知:常温下,
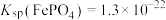 ,
,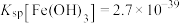 。
。(1)铁元素位于元素周期表的第
(2)①“焙烧”过程会产生
 ,足量
,足量 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为②用某浓度的
 溶液吸收
溶液吸收 的过程中,溶液的
的过程中,溶液的 随吸收时间的关系、尾气中
随吸收时间的关系、尾气中 质量分数与溶液
质量分数与溶液 的关系分别如图所示。
的关系分别如图所示。
则每隔
 需要更换
需要更换 溶液。
溶液。(3)若在实验室“焙烧”,则盛放固体物质的容器名称为
(4)聚合硫酸铁(PFS)是一种新型的无机高分子絮凝剂,能有效去除污水中的含磷化合物。处理后的污水中的不同含磷物质的浓度(计为磷浓度,单位略)与PFS投加量的关系如图所示。

①当PFS投加量小于
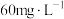 时,可溶性正磷酸盐浓度显著下降的原因为
时,可溶性正磷酸盐浓度显著下降的原因为②随着PFS投加量的增加,污水中颗粒态磷的浓度几乎为零的原因为
(5)已知:聚合硫酸铁一等品质总铁含量指标要求为铁的质量分数大于11.0%。为测定某聚合硫酸铁样品中铁的含量是否达到一等品质指标要求,进行如下实验:
a.准确称取
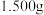 该聚合硫酸铁样品溶于适量硫酸,配成
该聚合硫酸铁样品溶于适量硫酸,配成 溶液
溶液 。
。b.准确量取
 溶液
溶液 ,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液
,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液 。
。c.用
 的酸性
的酸性 溶液滴定溶液
溶液滴定溶液 ,恰好反应完全时消耗酸性
,恰好反应完全时消耗酸性 溶液的体积为
溶液的体积为 。
。该聚合硫酸铁样品中铁的含量
您最近一年使用:0次
9 . 身体缺钙影响的不只有骨质,还有许多身体部位,补钙片是常见的补钙手段。某种补钙片的有效成分为碳酸钙,某同学设计如下实验测定其中碳酸钙的含量(该药片中的其他成分不与盐酸和氢氧化钠反应且不含钙元素):
①配制 的盐酸和
的盐酸和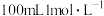 的
的 溶液;
溶液;
②取10粒补钙片(每粒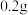 ),放研钵中研碎后,放入锥形瓶中并加入
),放研钵中研碎后,放入锥形瓶中并加入 蒸馏水;
蒸馏水;
③往锥形瓶中加入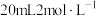 的盐酸(过量);
的盐酸(过量);
④用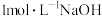 溶液中和过量的稀盐酸,记录所消耗
溶液中和过量的稀盐酸,记录所消耗 溶液的体积;
溶液的体积;
⑤重复试验3次。
回答下列问题:
(1)质量分数为36.5%的浓盐酸(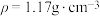 )的物质的量浓度为
)的物质的量浓度为_______  ;用该浓盐酸配制
;用该浓盐酸配制 的稀盐酸,需要用量筒量取
的稀盐酸,需要用量筒量取_______  该浓盐酸。
该浓盐酸。
(2)下列操作会导致所配的 溶液的物质的量浓度偏高的是
溶液的物质的量浓度偏高的是_______ (填标号)。
a.配制 溶液时,
溶液时, 固体中含有
固体中含有 杂质
杂质
b.用托盘天平称量 固体时,配套使用的砝码已经生锈
固体时,配套使用的砝码已经生锈
c定容后发现液面高于刻度线,用胶头滴管将多余的水吸出
d.溶液未冷却至室温即进行定容
(3)步骤③中发生反应的化学方程式为______________ ;步骤④中发生反应的离子方程式为______________ 。
(4)该同学3次测定所消耗的 溶液的体积如下表所示。计算得出每粒补钙片中含有
溶液的体积如下表所示。计算得出每粒补钙片中含有_______ 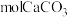 ,补钙片中钙元素的质量分数为
,补钙片中钙元素的质量分数为_______ 。
①配制
 的盐酸和
的盐酸和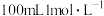 的
的 溶液;
溶液;②取10粒补钙片(每粒
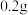 ),放研钵中研碎后,放入锥形瓶中并加入
),放研钵中研碎后,放入锥形瓶中并加入 蒸馏水;
蒸馏水;③往锥形瓶中加入
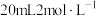 的盐酸(过量);
的盐酸(过量);④用
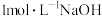 溶液中和过量的稀盐酸,记录所消耗
溶液中和过量的稀盐酸,记录所消耗 溶液的体积;
溶液的体积;⑤重复试验3次。
回答下列问题:
(1)质量分数为36.5%的浓盐酸(
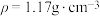 )的物质的量浓度为
)的物质的量浓度为 ;用该浓盐酸配制
;用该浓盐酸配制 的稀盐酸,需要用量筒量取
的稀盐酸,需要用量筒量取 该浓盐酸。
该浓盐酸。(2)下列操作会导致所配的
 溶液的物质的量浓度偏高的是
溶液的物质的量浓度偏高的是a.配制
 溶液时,
溶液时, 固体中含有
固体中含有 杂质
杂质b.用托盘天平称量
 固体时,配套使用的砝码已经生锈
固体时,配套使用的砝码已经生锈c定容后发现液面高于刻度线,用胶头滴管将多余的水吸出
d.溶液未冷却至室温即进行定容
(3)步骤③中发生反应的化学方程式为
(4)该同学3次测定所消耗的
 溶液的体积如下表所示。计算得出每粒补钙片中含有
溶液的体积如下表所示。计算得出每粒补钙片中含有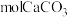 ,补钙片中钙元素的质量分数为
,补钙片中钙元素的质量分数为测定次数 | 1 | 2 | 3 |
| 10.00 | 10.10 | 9.90 |
您最近一年使用:0次
名校
解题方法
10 . 某膨松剂由碳酸氢钠与碳酸钠组成。某学校兴趣小组为研究该膨松剂中碳酸氢钠的含量,利用下图所示装置进行相关实验。已知各装置中的试剂皆为足量。

(1)装置A中NaOH溶液的作用是_________ ;
(2)装置C的作用是_________ ;
(3)装置E中所用仪器的名称是_________ ;
(4)已知碱石灰是固体氢氧化钠和氧化钙的混合物,则装置D中NaOH发生化学方程式为_________ ;
(5)将一定质量的该膨松剂样品装入装置B中,测定实验前后装置_________ (填装置对应的字母符号)的质量,其质量差即为样品产生的CO2的质量。
(6)上述实验中,若没有装置E,可能会造成测定结果_________ (填“偏大”、“偏小”或“不变”);
(7)若上述实验中加入的样品质量为30g,测得生成的CO2的质量为6.6g。则样品中NaHCO3的质量分数为_________ 。

(1)装置A中NaOH溶液的作用是
(2)装置C的作用是
(3)装置E中所用仪器的名称是
(4)已知碱石灰是固体氢氧化钠和氧化钙的混合物,则装置D中NaOH发生化学方程式为
(5)将一定质量的该膨松剂样品装入装置B中,测定实验前后装置
(6)上述实验中,若没有装置E,可能会造成测定结果
(7)若上述实验中加入的样品质量为30g,测得生成的CO2的质量为6.6g。则样品中NaHCO3的质量分数为
您最近一年使用:0次
2023-12-11更新
|
72次组卷
|
2卷引用:湖北省宜昌市远安县第一高级中学2023-2024学年高一上学期期中考试化学试题