2023高三上·江苏·专题练习
解题方法
1 . 以银锰精矿(主要含 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下。
)为原料联合提取银和锰的一种流程示意图如下。
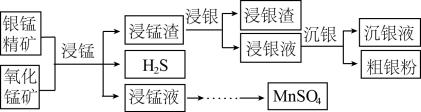
已知:酸性条件下, 的氧化性强于
的氧化性强于 。
。
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出:矿石中的银以
,有利于后续银的浸出:矿石中的银以 的形式残留于浸锰渣中。“浸锰”过程中,银锰精矿中的
的形式残留于浸锰渣中。“浸锰”过程中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有_______ 。
(2)“浸银”时,使用过量 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出并生成S。写出“浸银”反应的离子方程式:
形式浸出并生成S。写出“浸银”反应的离子方程式:_______ 。结合平衡移动原理,解释浸出剂中 、
、 的作用:
的作用:_______ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①写出“沉银”的离子方程式_______ 。
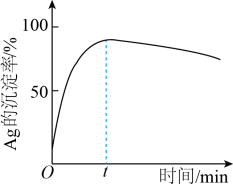
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:_______ 。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优点:可将两种矿石中的锰元素同时提取到浸锰液中得到 ;将银元素和锰元素分离;
;将银元素和锰元素分离;_______ 。
 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下。
)为原料联合提取银和锰的一种流程示意图如下。
已知:酸性条件下,
 的氧化性强于
的氧化性强于 。
。(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出:矿石中的银以
,有利于后续银的浸出:矿石中的银以 的形式残留于浸锰渣中。“浸锰”过程中,银锰精矿中的
的形式残留于浸锰渣中。“浸锰”过程中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出并生成S。写出“浸银”反应的离子方程式:
形式浸出并生成S。写出“浸银”反应的离子方程式: 、
、 的作用:
的作用:(3)“沉银”过程中需要过量的铁粉作为还原剂。
①写出“沉银”的离子方程式
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:

(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优点:可将两种矿石中的锰元素同时提取到浸锰液中得到
 ;将银元素和锰元素分离;
;将银元素和锰元素分离;
您最近一年使用:0次
名校
解题方法
2 . 黏土钒矿中,钒以+3价、+4价、+5价的化合物存在,还包括SiO2、Fe2O3和铝硅酸盐(Al2O3•SiO2)等。采用以下流程可由黏土钒矿制备V2O5、Fe2O3和硫酸铝铵。
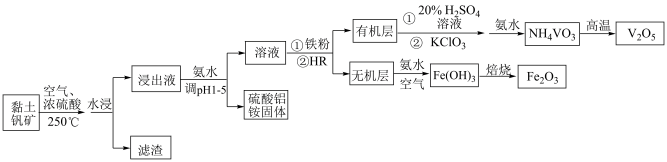
已知:i.有机酸性萃取剂HR的萃取原理为:Mn+(aq)+nHR(org) MRn(org)+Nh+(aq)(org表示有机溶液)
MRn(org)+Nh+(aq)(org表示有机溶液)
ii.酸性溶液中,HR对VO2+、Fe3+萃取能力强,而对 的萃取能力较弱
的萃取能力较弱
(1)从黏土钒矿到浸出液的流程中,加快浸出速率的措施还有_______ 。(任写一条)
(2)滤渣的主要成分是_______ 。
(3)浸出液中钒以+4价、+5价的形式存在,简述加入铁粉的原因_______ 。
(4)KClO3和VO2+反应生成 和Cl-的离子方程式
和Cl-的离子方程式_______ 。
(5)硫酸工业中,V2O5是反应2SO2+O2 2SO3的催化剂,催化过程经两步完成,可能的催化过程为:
2SO3的催化剂,催化过程经两步完成,可能的催化过程为:_______ 、_______ 。(用化学方程式表示,中间产物为VO2)。
(6)从无机层获得Fe(OH)3的离子方程式是_______ 。
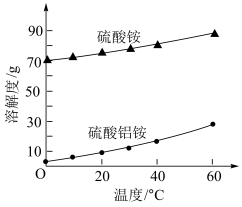
(7)硫酸铝铵固体中含有少量硫酸铵杂质,根据如图的溶解度曲线,进一步提纯硫酸铝铵的操作名称是_______ 。

已知:i.有机酸性萃取剂HR的萃取原理为:Mn+(aq)+nHR(org)
 MRn(org)+Nh+(aq)(org表示有机溶液)
MRn(org)+Nh+(aq)(org表示有机溶液)ii.酸性溶液中,HR对VO2+、Fe3+萃取能力强,而对
 的萃取能力较弱
的萃取能力较弱(1)从黏土钒矿到浸出液的流程中,加快浸出速率的措施还有
(2)滤渣的主要成分是
(3)浸出液中钒以+4价、+5价的形式存在,简述加入铁粉的原因
(4)KClO3和VO2+反应生成
 和Cl-的离子方程式
和Cl-的离子方程式(5)硫酸工业中,V2O5是反应2SO2+O2
 2SO3的催化剂,催化过程经两步完成,可能的催化过程为:
2SO3的催化剂,催化过程经两步完成,可能的催化过程为:(6)从无机层获得Fe(OH)3的离子方程式是
(7)硫酸铝铵固体中含有少量硫酸铵杂质,根据如图的溶解度曲线,进一步提纯硫酸铝铵的操作名称是

您最近一年使用:0次
名校
3 . 合成某药物的中间体G的流程如图:
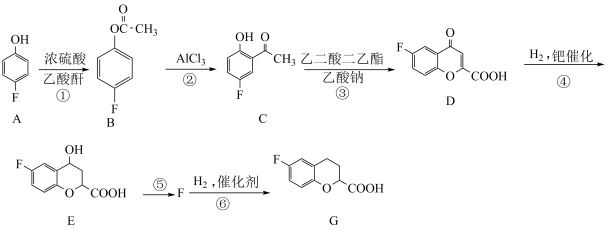
请回答下列问题:
(1)A的名称为___________ (系统命名法),A的酸性比苯酚___________ (填“强”或“弱”),原因是___________ 。
(2)反应④的反应类型是___________ ,D中含氧官能团的名称为___________ 。
(3)写出反应⑤的化学方程式:___________ 。
(4)写出满足下列条件的E的同分异构体的结构简式:___________ 。
①苯环上只有3个取代基;
②核磁共振氢谱图中吸收峰面积比为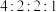 ;
;
③ 该物质与足量
该物质与足量 溶液反应生成
溶液反应生成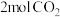 。
。
(5)根据已有知识并结合相关信息,写出以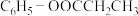 为原料制备
为原料制备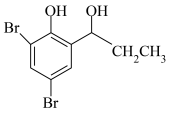 的合成路线流程图(无机试剂任选)。
的合成路线流程图(无机试剂任选)。_______

请回答下列问题:
(1)A的名称为
(2)反应④的反应类型是
(3)写出反应⑤的化学方程式:
(4)写出满足下列条件的E的同分异构体的结构简式:
①苯环上只有3个取代基;
②核磁共振氢谱图中吸收峰面积比为
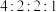 ;
;③
 该物质与足量
该物质与足量 溶液反应生成
溶液反应生成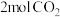 。
。(5)根据已有知识并结合相关信息,写出以
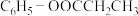 为原料制备
为原料制备 的合成路线流程图(无机试剂任选)。
的合成路线流程图(无机试剂任选)。
您最近一年使用:0次
名校
4 .  催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:
反应1:
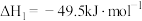
反应2:
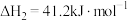
恒压下,将起始 的混合气体以一定流速通过装有催化剂的反应管,测得出口处
的混合气体以一定流速通过装有催化剂的反应管,测得出口处 的转化率及
的转化率及 和
和 的选择性[
的选择性[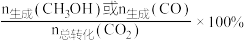 ]随温度的变化如图所示,下列说法正确的是
]随温度的变化如图所示,下列说法正确的是
 催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:反应1:

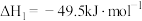
反应2:

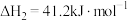
恒压下,将起始
 的混合气体以一定流速通过装有催化剂的反应管,测得出口处
的混合气体以一定流速通过装有催化剂的反应管,测得出口处 的转化率及
的转化率及 和
和 的选择性[
的选择性[ ]随温度的变化如图所示,下列说法正确的是
]随温度的变化如图所示,下列说法正确的是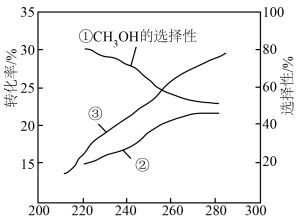
A.曲线②表示 的选择性 的选择性 |
B.280℃时出口处 的物质的量浓度大于220℃时 的物质的量浓度大于220℃时 |
C.一定温度下,增大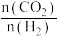 可提高 可提高 平衡转化率 平衡转化率 |
D.为提高 生产效率,需研发 生产效率,需研发 转化率高和 转化率高和 选择性高的催化剂 选择性高的催化剂 |
您最近一年使用:0次
2023-10-15更新
|
672次组卷
|
4卷引用:选择题11-13
(已下线)选择题11-13江苏省连云港市2023~2024学年高三上学期教学质量调研(一)化学试题(已下线)题型04 化学反应速率与平衡图像分析-2024年高考化学答题技巧与模板构建2024届广西2024年“贵百河”高三下学期4月新高考模拟二模化学试题
5 . 2023年全球电动汽车销量预计超过1400万辆,为全球经济复苏和环境保护做出较大贡献。燃油汽车尾气中除大量CO2外,还含有NO和CO气体。某研究小组用新型催化剂对CO、NO催化转化进行研究,测得一段时间内, 条件下,NO的转化率、CO剩余的百分率以及无CO时NO直接分解为N2的转化率随温度的变化情况如图所示。
条件下,NO的转化率、CO剩余的百分率以及无CO时NO直接分解为N2的转化率随温度的变化情况如图所示。

反应Ⅱ: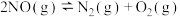

下列叙述不正确 的是
 条件下,NO的转化率、CO剩余的百分率以及无CO时NO直接分解为N2的转化率随温度的变化情况如图所示。
条件下,NO的转化率、CO剩余的百分率以及无CO时NO直接分解为N2的转化率随温度的变化情况如图所示。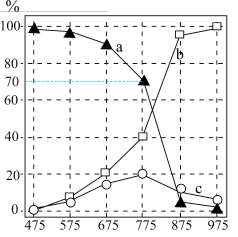


反应Ⅱ:
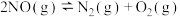

下列叙述
A.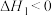 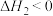 |
| B.曲线c表示:无CO时,NO直接分解为N2的转化率 |
C.775K, 时,不考虑其他反应,该时刻 时,不考虑其他反应,该时刻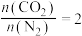 |
| D.温度在775K~875K时,催化剂活性较强 |
您最近一年使用:0次
6 . VIA族元素单质及其化合物在自然界广泛存在且具有重要应用。 可用于有机废水处理,
可用于有机废水处理, 约为8时,
约为8时, 可与
可与 反应生成
反应生成 、
、 和
和 。
。 是绿色氧化剂,也是一种弱酸,可由
是绿色氧化剂,也是一种弱酸,可由 和
和 制得。
制得。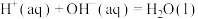
 。
。 可作漂白剂,用
可作漂白剂,用 等碱性溶液吸收多余的
等碱性溶液吸收多余的 ,可得到
,可得到 、
、 等化工产品。下列化学反应表示
等化工产品。下列化学反应表示不正确 的是
 可用于有机废水处理,
可用于有机废水处理, 约为8时,
约为8时, 可与
可与 反应生成
反应生成 、
、 和
和 。
。 是绿色氧化剂,也是一种弱酸,可由
是绿色氧化剂,也是一种弱酸,可由 和
和 制得。
制得。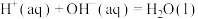
 。
。 可作漂白剂,用
可作漂白剂,用 等碱性溶液吸收多余的
等碱性溶液吸收多余的 ,可得到
,可得到 、
、 等化工产品。下列化学反应表示
等化工产品。下列化学反应表示A. 处理含 处理含 废水的反应: 废水的反应: |
B.制备双氧水: |
C.双氧水一级电离方程式: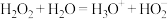 |
D.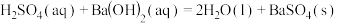 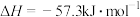 |
您最近一年使用:0次
2023高三上·江苏·专题练习
解题方法
7 . 溴化亚铜(CuBr)是一种白色结晶状粉末,微溶于水,不溶于乙醇,在热水中或见光都会分解,在空气中逐渐变为浅绿色。实验室制备CuBr的实验步骤和装置如下图。
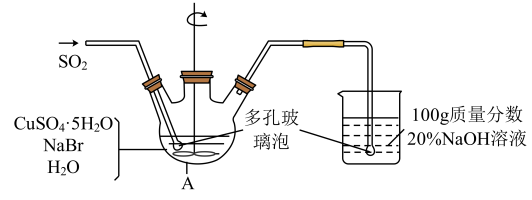
回答下列问题:
(1)装置A中的离子方程式为_______ 。
(2)装置常采用60℃水浴加热,温度不宜过高的原因是_______ ;加料完成后,60℃水浴加热,以一定速率搅拌,能提高 吸收率的方法为
吸收率的方法为_______ 。
(3)欲利用上述装置烧杯中的吸收液(经检测含有 、
、 )制取较纯净的
)制取较纯净的 晶体。补充完整制取
晶体。补充完整制取 晶体的实验方案:向烧杯内的吸收液中,
晶体的实验方案:向烧杯内的吸收液中,_______ ,置于真空干燥箱中干燥。(已知:室温下从饱和 溶液中结晶出
溶液中结晶出 ,34~100℃结晶出
,34~100℃结晶出 ;可选用试剂:
;可选用试剂: 气体、20% NaOH溶液、乙醇)
气体、20% NaOH溶液、乙醇)
(4)CuBr在空气中氧化所得绿色粉末为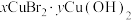 ,为探究该粉末的化学式,现进行如下实验:准确称取一定质量的绿色粉末,溶于足量乙酸中,用蒸馏水配制成100 mL溶液。
,为探究该粉末的化学式,现进行如下实验:准确称取一定质量的绿色粉末,溶于足量乙酸中,用蒸馏水配制成100 mL溶液。
①取25mL溶液,向其中加入足量的 溶液,充分反应后过滤、洗涤、干燥,所得淡黄色固体质量为0.94 g。
溶液,充分反应后过滤、洗涤、干燥,所得淡黄色固体质量为0.94 g。
②另取25 mL溶液,向其中加入过量的KI溶液,再用0.400 mol⋅L
 标准溶液滴定至终点,消耗25.00 mL。已知反应的方程式如下:
标准溶液滴定至终点,消耗25.00 mL。已知反应的方程式如下: 、
、 。请确定该绿色粉末的化学式
。请确定该绿色粉末的化学式_______ (请写出计算过程)。
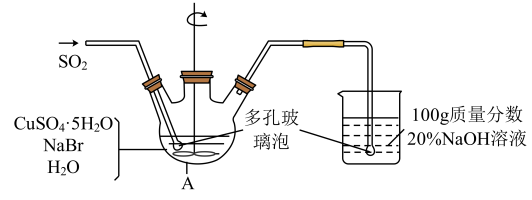
回答下列问题:
(1)装置A中的离子方程式为
(2)装置常采用60℃水浴加热,温度不宜过高的原因是
 吸收率的方法为
吸收率的方法为(3)欲利用上述装置烧杯中的吸收液(经检测含有
 、
、 )制取较纯净的
)制取较纯净的 晶体。补充完整制取
晶体。补充完整制取 晶体的实验方案:向烧杯内的吸收液中,
晶体的实验方案:向烧杯内的吸收液中, 溶液中结晶出
溶液中结晶出 ,34~100℃结晶出
,34~100℃结晶出 ;可选用试剂:
;可选用试剂: 气体、20% NaOH溶液、乙醇)
气体、20% NaOH溶液、乙醇)(4)CuBr在空气中氧化所得绿色粉末为
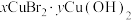 ,为探究该粉末的化学式,现进行如下实验:准确称取一定质量的绿色粉末,溶于足量乙酸中,用蒸馏水配制成100 mL溶液。
,为探究该粉末的化学式,现进行如下实验:准确称取一定质量的绿色粉末,溶于足量乙酸中,用蒸馏水配制成100 mL溶液。①取25mL溶液,向其中加入足量的
 溶液,充分反应后过滤、洗涤、干燥,所得淡黄色固体质量为0.94 g。
溶液,充分反应后过滤、洗涤、干燥,所得淡黄色固体质量为0.94 g。②另取25 mL溶液,向其中加入过量的KI溶液,再用0.400 mol⋅L

 标准溶液滴定至终点,消耗25.00 mL。已知反应的方程式如下:
标准溶液滴定至终点,消耗25.00 mL。已知反应的方程式如下: 、
、 。请确定该绿色粉末的化学式
。请确定该绿色粉末的化学式
您最近一年使用:0次
2023高三上·江苏·专题练习
名校
解题方法
8 . 科研人员发现利用低温固体质子导体作电解质,催化合成 ,与传统的热催化合成氨相比,催化效率较高。其合成原理如图甲所示,其他条件不变,电源电压改变与生成
,与传统的热催化合成氨相比,催化效率较高。其合成原理如图甲所示,其他条件不变,电源电压改变与生成 速率的关系如图乙所示,下列说法
速率的关系如图乙所示,下列说法不正确 的是
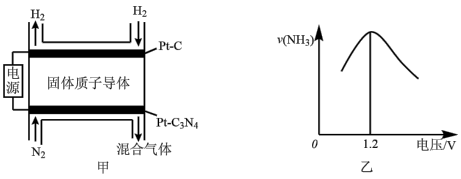
 ,与传统的热催化合成氨相比,催化效率较高。其合成原理如图甲所示,其他条件不变,电源电压改变与生成
,与传统的热催化合成氨相比,催化效率较高。其合成原理如图甲所示,其他条件不变,电源电压改变与生成 速率的关系如图乙所示,下列说法
速率的关系如图乙所示,下列说法
A. 是该合成氨装置的阳极 是该合成氨装置的阳极 |
B. 电极出口混合气可能含有 电极出口混合气可能含有 、 、 、 、 |
C.若H₂的进出口流量差为22.4 L/min(标准状况),则固体质子导体中 的流速为1 mol/min 的流速为1 mol/min |
D.当电压高于1.2V时,随电压升高, 在阴极放电生成 在阴极放电生成 的速率加快 的速率加快 |
您最近一年使用:0次
2023-10-12更新
|
177次组卷
|
3卷引用:选择题11-13
2023高三上·江苏·专题练习
解题方法
9 . 高氯酸铵( )受热或撞击可分解成
)受热或撞击可分解成 、
、 、
、 和
和 ,可用作火箭推进剂。一种以工业
,可用作火箭推进剂。一种以工业 (含少量的
(含少量的 和
和 )溶液制取高氯酸铵的流程如下,电解时使用惰性电极,电解后溶液中有
)溶液制取高氯酸铵的流程如下,电解时使用惰性电极,电解后溶液中有 生成。
生成。
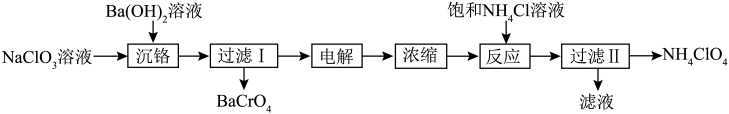
关于制取高氯酸铵的反应,下列说法正确的是
 )受热或撞击可分解成
)受热或撞击可分解成 、
、 、
、 和
和 ,可用作火箭推进剂。一种以工业
,可用作火箭推进剂。一种以工业 (含少量的
(含少量的 和
和 )溶液制取高氯酸铵的流程如下,电解时使用惰性电极,电解后溶液中有
)溶液制取高氯酸铵的流程如下,电解时使用惰性电极,电解后溶液中有 生成。
生成。
关于制取高氯酸铵的反应,下列说法正确的是
A.沉铬时加入 有利于 有利于 转化为 转化为 |
B.电解时阴极电极方程式为: |
C.加入饱和 溶液反应时可能有 溶液反应时可能有 生成 生成 |
D. 、 、 、 、 三种物质中, 三种物质中, 溶解度最大 溶解度最大 |
您最近一年使用:0次
2023高三上·江苏·专题练习
解题方法
10 . 黑鳞的晶体结构是与石墨类似的层状结构,如图所示。下列有关说法不正确的是
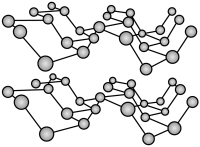

| A.黑磷晶体中片层间作用力为范德华力 | B.黑磷与白磷均可导电 |
| C.黑磷晶体的熔沸点比白磷高 | D.1 mol黑磷晶体中含有1.5 mol P-P键 |
您最近一年使用:0次



