1 . 从某矿渣[成分为 (铁酸镍)、
(铁酸镍)、 、
、 、
、 、
、 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下:
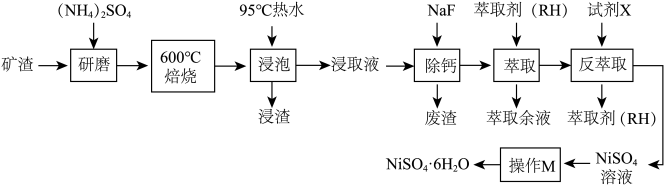
已知:① 在350℃以上会分解生成
在350℃以上会分解生成 和
和 ;
;
②萃取剂(RH)萃取 的原理为
的原理为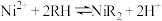 。
。
回答下列问题:
(1) 在元素周期表中的位置是
在元素周期表中的位置是___________ 。
(2)600℃焙烧时, 几乎不发生反应,
几乎不发生反应, 、
、 、
、 转化为相应的硫酸盐。
转化为相应的硫酸盐。 生成
生成 、
、 ,发生该反应的化学方程式为
,发生该反应的化学方程式为___________ 。
(3)“浸渣”的成分除了有 、
、 、
、 外,还含有
外,还含有___________ (填化学式)。为检验浸出液中是否含有 ,可选用的化学试剂是
,可选用的化学试剂是___________ 。
(4)将“浸取液”冷却到室温,测得溶液中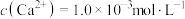 ,向其中加入一定量的
,向其中加入一定量的 晶体,搅拌,当溶液中
晶体,搅拌,当溶液中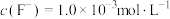 时,除钙率为
时,除钙率为___________ %[室温时,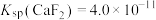 ,
,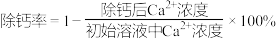 ]。
]。
(5)反萃取试剂X为___________ (填化学式)。
(6)资料显示,硫酸镍结晶水合物的形态与温度有如表所示关系:
从 溶液中获得稳定的
溶液中获得稳定的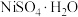 晶体的操作是
晶体的操作是___________ 、___________ 、过滤、洗涤、干燥等多步操作。
 (铁酸镍)、
(铁酸镍)、 、
、 、
、 、
、 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下:
已知:①
 在350℃以上会分解生成
在350℃以上会分解生成 和
和 ;
;②萃取剂(RH)萃取
 的原理为
的原理为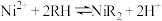 。
。回答下列问题:
(1)
 在元素周期表中的位置是
在元素周期表中的位置是(2)600℃焙烧时,
 几乎不发生反应,
几乎不发生反应, 、
、 、
、 转化为相应的硫酸盐。
转化为相应的硫酸盐。 生成
生成 、
、 ,发生该反应的化学方程式为
,发生该反应的化学方程式为(3)“浸渣”的成分除了有
 、
、 、
、 外,还含有
外,还含有 ,可选用的化学试剂是
,可选用的化学试剂是(4)将“浸取液”冷却到室温,测得溶液中
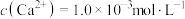 ,向其中加入一定量的
,向其中加入一定量的 晶体,搅拌,当溶液中
晶体,搅拌,当溶液中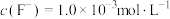 时,除钙率为
时,除钙率为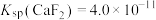 ,
,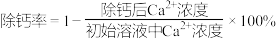 ]。
]。(5)反萃取试剂X为
(6)资料显示,硫酸镍结晶水合物的形态与温度有如表所示关系:
| 温度 | 低于30.8℃ | 30.8~53.8℃ | 53.8~280℃ | 高于280℃ |
| 晶体形态 |  | 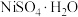 | 多种结晶水合物 |  |
 溶液中获得稳定的
溶液中获得稳定的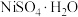 晶体的操作是
晶体的操作是
您最近一年使用:0次
2023-08-11更新
|
200次组卷
|
2卷引用:贵州省2024届高三8月入学考试化学试题
2022高三·全国·专题练习
2 . 化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:

回答下列问题:
(1) 的反应类型是
的反应类型是___________ 。
(2)化合物B核磁共振氢谱的吸收峰有___________ 组。
(3)化合物C的结构简式为___________ 。
(4) 的过程中,被还原的官能团是
的过程中,被还原的官能团是___________ ,被氧化的官能团是___________ 。
(5)若只考虑氟的位置异构,则化合物F的同分异构体有___________ 种。
(6)已知 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为___________ 。
(7) 配合物可催化
配合物可催化 转化中
转化中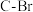 键断裂,也能催化反应①:
键断裂,也能催化反应①:
反应①: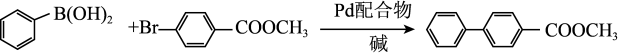
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子 (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
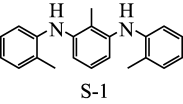
根据上述信息,甲、乙两组合成的 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是___________ 。

回答下列问题:
(1)
 的反应类型是
的反应类型是(2)化合物B核磁共振氢谱的吸收峰有
(3)化合物C的结构简式为
(4)
 的过程中,被还原的官能团是
的过程中,被还原的官能团是(5)若只考虑氟的位置异构,则化合物F的同分异构体有
(6)已知
 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为(7)
 配合物可催化
配合物可催化 转化中
转化中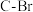 键断裂,也能催化反应①:
键断裂,也能催化反应①:反应①:
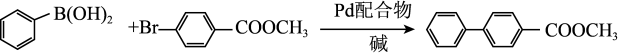
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子
 (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
根据上述信息,甲、乙两组合成的
 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是
您最近一年使用:0次
2022-07-12更新
|
9037次组卷
|
15卷引用:湖北省武汉市第一中学2022-2023学年高三上学期9月开学考试化学试题
湖北省武汉市第一中学2022-2023学年高三上学期9月开学考试化学试题陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题(已下线)专题18 有机化学基础(综合题)-2022年高考真题模拟题分项汇编2022年湖北省高考真题化学试题(已下线)2022年湖北省高考真题变式题16-19(已下线)考点45 有机化合物的合成-备战2023年高考化学一轮复习考点帮(全国通用)陕西师范大学附属中学、渭北中学等2023届高三上学期期初检测联考化学试题(已下线)第35讲 生物大分子与合成高分子(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)热点情景汇编-专题十一 有机推断中的新发展(已下线)第一部分 二轮专题突破 大题突破5 有机综合推断(选考)(已下线)专题21 有机推断题(已下线)专题21 有机推断题(已下线)专题16 有机合成与推断-2023年高考化学真题题源解密(新高考专用)(已下线)考点39 有机推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)新疆乌鲁木齐市第四十中学2023-2024学年高三上学期11月月考化学试题
名校
3 . 电镀污泥(主要含Cr、Cu、Zn、Ni、Fe、Si)中金属大多以氢氧化物的形式存在,硅以SiO2形式存在。某科研团队用萃取——沉淀法回收电镀污泥中金属的技术路线如图所示。
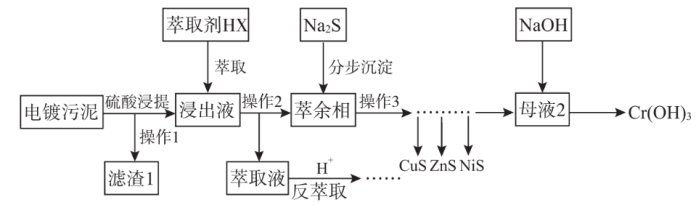
已知:①萃取反应可简单表示为nHX+Mn+ MXn+nH+
MXn+nH+
②相关资料显示,分步沉淀工序中投加硫化钠生成沉淀时,可以认为水溶液中的H2S饱和,饱和c(H2S)=1.0mol·L-1。
回答下列问题:
(1)铁元素在元素周期表中位置为___ ;滤渣1的主要成分是___ 。
(2)操作2的名称为___ 。
(3)萃取浸出液除去的元素为___ (填元素符号),由于该元素在分步沉淀工序中与硫化钠发生氧化还原反应生成多种沉淀难以分离,故该元素不可在分步沉淀工序中除去,写出此反应的化学方程式___ 。
(4)反萃取工序发生的离子方程式为____ 。
(5)萃余相中的Ni元素恰好完全转化为沉淀的pH为___ [通常认为溶液中离子浓度小于10-5mol·L-1为沉淀完全,Ksp(NiS)=1×10-19,考虑H2S的二级电离Ka1(H2S)=1×10-7,Ka2(H2S)=1×10-15]。

已知:①萃取反应可简单表示为nHX+Mn+
 MXn+nH+
MXn+nH+②相关资料显示,分步沉淀工序中投加硫化钠生成沉淀时,可以认为水溶液中的H2S饱和,饱和c(H2S)=1.0mol·L-1。
回答下列问题:
(1)铁元素在元素周期表中位置为
(2)操作2的名称为
(3)萃取浸出液除去的元素为
(4)反萃取工序发生的离子方程式为
(5)萃余相中的Ni元素恰好完全转化为沉淀的pH为
您最近一年使用:0次
2021-09-23更新
|
278次组卷
|
2卷引用:河北省省级联测2021-2022学年高三上学期第一次考试化学试题
真题
名校
4 . 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
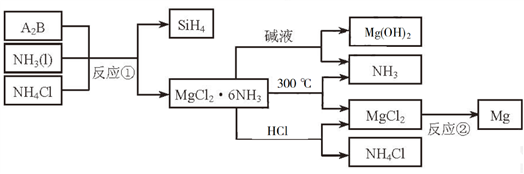
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________ ,Mg在元素周期表中的位置:_____________________ ,Mg(OH)2的电子式:____________________ 。
(2)A2B的化学式为_______________ 。反应②的必备条件是_______________ 。上图中可以循环使用的物质有_______________ 。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________ (写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________ 。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备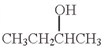 所需醛的可能结构简式:
所需醛的可能结构简式:_______________ 。

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):
(2)A2B的化学式为
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备
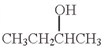 所需醛的可能结构简式:
所需醛的可能结构简式:
您最近一年使用:0次
2018-06-09更新
|
3025次组卷
|
13卷引用:云南省玉溪元江民中2020届高三开学考试化学试题
云南省玉溪元江民中2020届高三开学考试化学试题云南省石屏县第二中学2020届高三上学期开学考试化学试题2018年全国普通高等学校招生统一考试化学(天津卷)(已下线)2018年高考题及模拟题汇编 专题13 元素及其化合物知识的综合应用(已下线)高考母题题源15 物质结构与推断(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第2讲 铝及其化合物云南省弥勒市第四中学2019-2020学年高二上学期开学考试化学试题云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题云南省绿春县二中2019-2020学年高一上学期期中考试化学试题
名校
解题方法
5 . 碲(Te)广泛用于太阳能、电子、医药等领域,对碲的综合回收利用尤为重要。工业上,从含碲化亚铜的废渣(主要成分Cu2Te,还有少量的Ag、Cu)中提取碲的流程如图:

回答下列问题:
(1)写出碲元素在元素周期表中的位置____ 。
(2)“酸浸”过程中生成TeOSO4的离子方程式为____ 。
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl?通过计算说明____ 。
(4)电解除铜时,铜、碲沉淀的关系如表。
①电解初始阶段阴极的电极反应式是____ 。
②最佳电解时间为30min,原因是____ 。
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从5.0g/L下降到0.2g/L,写出TeOSO4生成Te的化学方程式____ ,其中Te元素的回收率为____ (忽略溶液体积变化,结果用百分数表示,保留二位有效数字)。
(6)整个过程中可循环利用的物质为____ (填化学式)。

回答下列问题:
(1)写出碲元素在元素周期表中的位置
(2)“酸浸”过程中生成TeOSO4的离子方程式为
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl?通过计算说明
(4)电解除铜时,铜、碲沉淀的关系如表。
| 电解时间(min) | 铜沉淀率 | 碲沉淀率 |
| 10 | 25% | 0.1% |
| 20 | 40% | 0.2% |
| 30 | 62% | 0.4% |
| 40 | 65% | 2.0% |
②最佳电解时间为30min,原因是
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从5.0g/L下降到0.2g/L,写出TeOSO4生成Te的化学方程式
(6)整个过程中可循环利用的物质为
您最近一年使用:0次
2022-05-05更新
|
667次组卷
|
3卷引用:陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题
陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题(已下线)微专题28 有关工艺流程和实验探究方程式的书写-备战2023年高考化学一轮复习考点微专题
名校
解题方法
6 . 药物M可用于治疗动脉硬化,其合成路线如下。
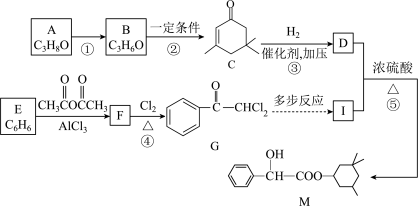
已知:i.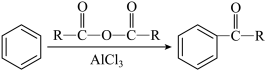
ii.B的核磁共振氢谱只有一组峰
回答下列问题:
(1)M的官能团名称为___________ 。
(2)有机物A的名称为___________ 。
(3)C的分子式为___________ 。
(4)反应④的反应类型是___________ 。
(5)写出反应⑤的化学方程式为___________ 。
(6)写出满足下列条件的G的所有同分异构体的结构简式___________ 。
①结构中含有酚羟基 ②苯环上只有两个取代基且位于间位
(7)已知: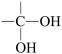 →
→ 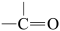 +H2O ,以G为原料,选择必要的无机试剂合成I,设计合成路线
+H2O ,以G为原料,选择必要的无机试剂合成I,设计合成路线___________ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。

已知:i.

ii.B的核磁共振氢谱只有一组峰
回答下列问题:
(1)M的官能团名称为
(2)有机物A的名称为
(3)C的分子式为
(4)反应④的反应类型是
(5)写出反应⑤的化学方程式为
(6)写出满足下列条件的G的所有同分异构体的结构简式
①结构中含有酚羟基 ②苯环上只有两个取代基且位于间位
(7)已知:
 →
→ 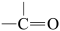 +H2O ,以G为原料,选择必要的无机试剂合成I,设计合成路线
+H2O ,以G为原料,选择必要的无机试剂合成I,设计合成路线
您最近一年使用:0次
7 . 药物合成在有机合成中具有重要作用。某种药物H是一种具有抗菌作用的化合物,实验室由芳香族化合物A制备的一种合成路线如下:

已知:①RCH2Br R-CH=CH-R′
R-CH=CH-R′
②2R-CH=CH-R′
 (以上R、R′代表氢或烃基等)
(以上R、R′代表氢或烃基等)
(1)A的化学名称是_______ ;C中所含官能团的名称为_______ 。
(2)试剂a是_______ ,G生成H的反应类型是_______ 。
(3)由F生成G化学方程式是_______ 。
(4)能同时满足下列条件的D的同分异构体共有_______ 种(不考虑立体异构),其中核磁共振氢谱为五组峰的有机物结构简式为_______ 。
①苯环上只有两个取代基
②除苯环外不含其他环状结构
③既能发生银镜反应又能发生水解反应且水解产物之一能与氯化铁溶液发生显色反应
(5)以乙醇为起始原料,结合已知信息选用必要的无机试剂合成 ,写出合成路线
,写出合成路线_______ 。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)

已知:①RCH2Br
 R-CH=CH-R′
R-CH=CH-R′②2R-CH=CH-R′

 (以上R、R′代表氢或烃基等)
(以上R、R′代表氢或烃基等)(1)A的化学名称是
(2)试剂a是
(3)由F生成G化学方程式是
(4)能同时满足下列条件的D的同分异构体共有
①苯环上只有两个取代基
②除苯环外不含其他环状结构
③既能发生银镜反应又能发生水解反应且水解产物之一能与氯化铁溶液发生显色反应
(5)以乙醇为起始原料,结合已知信息选用必要的无机试剂合成
 ,写出合成路线
,写出合成路线
您最近一年使用:0次
解题方法
8 . A、B、C、D、E、F、G 为短周期主族元素,其原子半径与最外层电子数的关系如图,下列说法正确的是
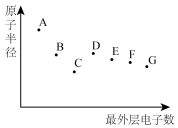

| A.根据元素B 在元素周期表中的位置推测,其最高价氧化物对应的水化物可能具有两性 |
| B.元素D在自然界中主要以游离态存在,其单质可用作半导体材料 |
| C.元素A的离子半径大于元素G的离子半径 |
| D.元素F 的气态氢化物比元素G的气态氢化物更稳定 |
您最近一年使用:0次
名校
9 . 工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。沉淀渣中除含有铜 、硒
、硒 、碲
、碲 外,还含有少量稀贵金属,主要物质为
外,还含有少量稀贵金属,主要物质为 、
、 和
和 。
。
(1)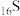 、
、 、
、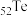 为同主族元素,其中
为同主族元素,其中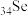 在元素周期表中的位置
在元素周期表中的位置____ 。
其中铜、硒、碲的主要回收流程如图:
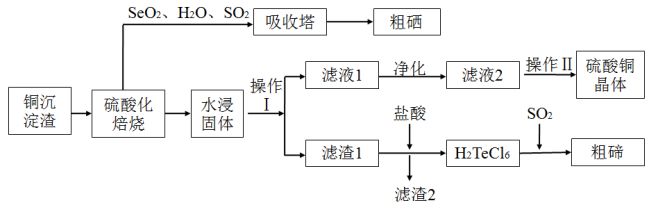
(2)经过硫酸化焙烧 ,铜、硒化铜和碲化铜转变为硫酸铜。
①写出 硫酸化焙烧的化学方程式
硫酸化焙烧的化学方程式____ 。
②“水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因___ 。
③滤液2经过____ 、_____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
(3)所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示。蒸馏操作中控制的最佳温度是____ (填序号)。
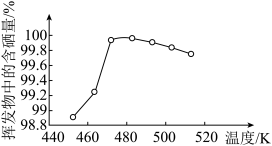
a.455℃ b.462℃ c.475℃ d.515℃
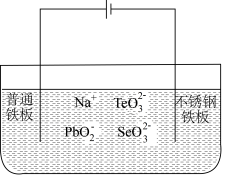
(4)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着 浓度的增加,促进了
浓度的增加,促进了 的沉积。写出
的沉积。写出 的沉积的电极反应式为
的沉积的电极反应式为____ 。
 、硒
、硒 、碲
、碲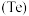 外,还含有少量稀贵金属,主要物质为
外,还含有少量稀贵金属,主要物质为 、
、 和
和 。
。(1)
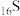 、
、 、
、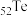 为同主族元素,其中
为同主族元素,其中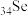 在元素周期表中的位置
在元素周期表中的位置其中铜、硒、碲的主要回收流程如图:

(2)经过
①写出
 硫酸化焙烧的化学方程式
硫酸化焙烧的化学方程式②“水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因
③滤液2经过
(3)所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示。蒸馏操作中控制的最佳温度是

a.455℃ b.462℃ c.475℃ d.515℃
(4)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着
 浓度的增加,促进了
浓度的增加,促进了 的沉积。写出
的沉积。写出 的沉积的电极反应式为
的沉积的电极反应式为
您最近一年使用:0次
2019-09-27更新
|
359次组卷
|
2卷引用:河北省张家口市2020届高三上学期入学摸底联合考试(全国卷)化学试题
10 . 随原子序数的递增,五种短周期元素原子半径与原子序数的关系如图所示。
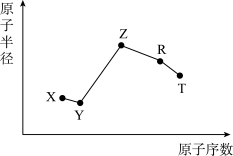
已知:TX2是现代光学及光纤制品的基本原料;ZY 能破坏水的电离平衡;Z3RY6在工业上常用作助熔剂。
(1)R在元素周期表中的位置是___ 。
(2)上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的电子式为___ 。
(3)请用一个化学方程式比较X和Y的非金属性的强弱_____ 。
(4)工业上以Z3RY6作助熔剂的目的是____ 。
(5)已知11.5gZ的单质在X2中完全燃烧,恢复至室温,放出QkJ热量,该反应的热化学方程式为___ 。

已知:TX2是现代光学及光纤制品的基本原料;ZY 能破坏水的电离平衡;Z3RY6在工业上常用作助熔剂。
(1)R在元素周期表中的位置是
(2)上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的电子式为
(3)请用一个化学方程式比较X和Y的非金属性的强弱
(4)工业上以Z3RY6作助熔剂的目的是
(5)已知11.5gZ的单质在X2中完全燃烧,恢复至室温,放出QkJ热量,该反应的热化学方程式为
您最近一年使用:0次
2019-09-11更新
|
154次组卷
|
2卷引用:湖北省武汉市部分学校2020届新高三起点质量监测化学试题



