名校
解题方法
1 . ①现有6.6 g铜镁合金与一定量浓硝酸恰好完全反应,得到 、NO的混合气体(不考虑
、NO的混合气体(不考虑 等其它气体)体积为4.48 L(本题气体体积均为标准状况下):②这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸。若向①所得溶液中加入:5 mol/L NaOH溶液至金属离子恰好完全沉淀,消耗NaOH溶液的体积是60 mL。试回答下列问题(要求写出计算过程):
等其它气体)体积为4.48 L(本题气体体积均为标准状况下):②这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸。若向①所得溶液中加入:5 mol/L NaOH溶液至金属离子恰好完全沉淀,消耗NaOH溶液的体积是60 mL。试回答下列问题(要求写出计算过程):
(1)①中参加反应的硝酸是___________ mol;
(2)②中消耗氧气的体积是___________ L;
(3)铜镁合金中镁的质量为___________ g。
 、NO的混合气体(不考虑
、NO的混合气体(不考虑 等其它气体)体积为4.48 L(本题气体体积均为标准状况下):②这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸。若向①所得溶液中加入:5 mol/L NaOH溶液至金属离子恰好完全沉淀,消耗NaOH溶液的体积是60 mL。试回答下列问题(要求写出计算过程):
等其它气体)体积为4.48 L(本题气体体积均为标准状况下):②这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸。若向①所得溶液中加入:5 mol/L NaOH溶液至金属离子恰好完全沉淀,消耗NaOH溶液的体积是60 mL。试回答下列问题(要求写出计算过程):(1)①中参加反应的硝酸是
(2)②中消耗氧气的体积是
(3)铜镁合金中镁的质量为
您最近一年使用:0次
名校
2 . 对烟气高效的脱硫、脱硝是防治空气污染的重要方式。
Ⅰ.尿素液相脱硫脱硝
(1)尿素[ ]中碳元素的化合价是
]中碳元素的化合价是___________ 。
(2)尿素溶液吸收烟气中的 ,生成一种正盐和
,生成一种正盐和 ,反应的化学方程式是
,反应的化学方程式是___________ 。
(3)研究发现,用尿素溶液吸收烟气中的NO时,脱除率很低。若 与尿素溶液联用,将NO转化为
与尿素溶液联用,将NO转化为 ,可大大提高NO的脱除率。
,可大大提高NO的脱除率。 与
与 溶液反应可生成两种无毒无污染的气体,反应的化学方程式是
溶液反应可生成两种无毒无污染的气体,反应的化学方程式是___________ 。
Ⅱ. 气相脱硫脱硝
气相脱硫脱硝
一定温度下,将模拟烟气通入气相氧化反应器中。NO和 的初始浓度相同,改变
的初始浓度相同,改变 的浓度,相同时间内,气体的氧化率随
的浓度,相同时间内,气体的氧化率随 与NO或
与NO或 的物质的量浓度之比的变化如图所示。其中①、④分别为NO和
的物质的量浓度之比的变化如图所示。其中①、④分别为NO和 单独通入反应器时NO、
单独通入反应器时NO、 的氧化率,②、③分别为将NO和
的氧化率,②、③分别为将NO和 同时通入反应器时NO、
同时通入反应器时NO、 的氧化率。
的氧化率。
 气相氧化NO的关键基元反应:
气相氧化NO的关键基元反应:
基元反应1:

基元反应2:
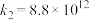
 气相氧化
气相氧化 的关键基元反应:
的关键基元反应:
基元反应3:
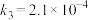
基元反应4:
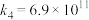
(4) 单独氧化
单独氧化 时,氧化率很低。原因是
时,氧化率很低。原因是___________ 。
(5)将 和NO同时通入气相氧化反应器中时,
和NO同时通入气相氧化反应器中时, 和NO的氧化率与将其单独通入反应器中时不同。原因分别是
和NO的氧化率与将其单独通入反应器中时不同。原因分别是___________ 。
(6)当体系中有水蒸气时, 单独氧化
单独氧化 的氧化率有很大提升。研究表明,此时
的氧化率有很大提升。研究表明,此时 被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是___________ 。
Ⅰ.尿素液相脱硫脱硝
(1)尿素[
 ]中碳元素的化合价是
]中碳元素的化合价是(2)尿素溶液吸收烟气中的
 ,生成一种正盐和
,生成一种正盐和 ,反应的化学方程式是
,反应的化学方程式是(3)研究发现,用尿素溶液吸收烟气中的NO时,脱除率很低。若
 与尿素溶液联用,将NO转化为
与尿素溶液联用,将NO转化为 ,可大大提高NO的脱除率。
,可大大提高NO的脱除率。 与
与 溶液反应可生成两种无毒无污染的气体,反应的化学方程式是
溶液反应可生成两种无毒无污染的气体,反应的化学方程式是Ⅱ.
 气相脱硫脱硝
气相脱硫脱硝一定温度下,将模拟烟气通入气相氧化反应器中。NO和
 的初始浓度相同,改变
的初始浓度相同,改变 的浓度,相同时间内,气体的氧化率随
的浓度,相同时间内,气体的氧化率随 与NO或
与NO或 的物质的量浓度之比的变化如图所示。其中①、④分别为NO和
的物质的量浓度之比的变化如图所示。其中①、④分别为NO和 单独通入反应器时NO、
单独通入反应器时NO、 的氧化率,②、③分别为将NO和
的氧化率,②、③分别为将NO和 同时通入反应器时NO、
同时通入反应器时NO、 的氧化率。
的氧化率。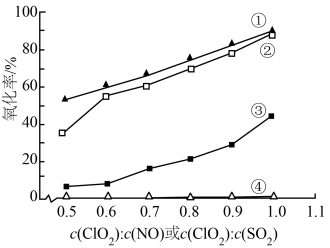
 气相氧化NO的关键基元反应:
气相氧化NO的关键基元反应:基元反应1:


基元反应2:

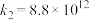
 气相氧化
气相氧化 的关键基元反应:
的关键基元反应:基元反应3:

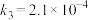
基元反应4:

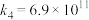
(4)
 单独氧化
单独氧化 时,氧化率很低。原因是
时,氧化率很低。原因是(5)将
 和NO同时通入气相氧化反应器中时,
和NO同时通入气相氧化反应器中时, 和NO的氧化率与将其单独通入反应器中时不同。原因分别是
和NO的氧化率与将其单独通入反应器中时不同。原因分别是(6)当体系中有水蒸气时,
 单独氧化
单独氧化 的氧化率有很大提升。研究表明,此时
的氧化率有很大提升。研究表明,此时 被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
您最近一年使用:0次
名校
解题方法
3 . 到目前为止,由化学能转变的热能或电能仍然是人类使用的主要能源。现有反应①Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑②Zn+H2SO4=ZnSO4+H2↑。试回答下列问题:
(1)两反应中属于吸热反应的是_______ (填序号,下同),能设计成原电池的是_______ 。
(2)化学课外活动小组设计的用铜-锌-稀硫酸原电池使LED灯发光的装置示意图。_______ (填“锌”或“铜”)电极方向移动。
②正极的电极方程式为_______ 。
③若反应过程中有0.2 mol电子的转移,则生成的氢气在标准状况下的体积为_______ L。
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:_______ 。(填“正极”或“负极”)
②电极b的电极反应式为_______ 。
(1)两反应中属于吸热反应的是
(2)化学课外活动小组设计的用铜-锌-稀硫酸原电池使LED灯发光的装置示意图。
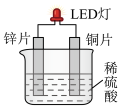
②正极的电极方程式为
③若反应过程中有0.2 mol电子的转移,则生成的氢气在标准状况下的体积为
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:
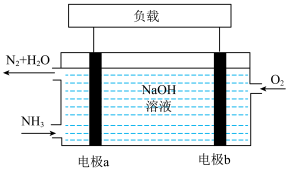
②电极b的电极反应式为
您最近一年使用:0次
4 . 氢气是未来理想的能源。
(1)实验室用铁与 的硫酸反应生成
的硫酸反应生成 的物质的量与反应时间的关系如图所示。按要求回答下列问题:
的物质的量与反应时间的关系如图所示。按要求回答下列问题: 的平均反应速率最大的时间段是
的平均反应速率最大的时间段是_______ (填“0~2min”“2~4min”或“4~6min”),该时间段内对反应速率起关键作用的影响因素是_______ 。
②若向体系中加入少量硫酸铜溶液,可以加快氢气的生成速率,其原因是_______ 。
③要加快上述实验中产生氢气的速率,还可采取的措施是_______ (填一种)。
(2)工业上用海水制氢气的新技术的原理为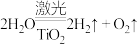 。回答下列问题:
。回答下列问题:
①分解海水的反应属于_______ 反应(填“放热”或“吸热”)。
②分解产生的氢气储存比较困难,有一种储存方法的原理可表示为
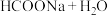 。下列说法正确的是
。下列说法正确的是_______ (填序号)。
A.储氢、释氢过程中均有能量变化
B.储氢时反应物中只有离子键的断裂
C.储氢过程中, 被还原
被还原
D.释氢过程中,每消耗0.1mol 放出2.24L
放出2.24L
(3) 可与
可与 发生反应:
发生反应: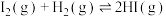 。一定温度下,在恒容密闭容器中进行该反应,下列叙述能说明该反应达到平衡的是_______(填序号)。
。一定温度下,在恒容密闭容器中进行该反应,下列叙述能说明该反应达到平衡的是_______(填序号)。
(1)实验室用铁与
 的硫酸反应生成
的硫酸反应生成 的物质的量与反应时间的关系如图所示。按要求回答下列问题:
的物质的量与反应时间的关系如图所示。按要求回答下列问题: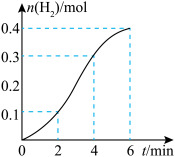
 的平均反应速率最大的时间段是
的平均反应速率最大的时间段是②若向体系中加入少量硫酸铜溶液,可以加快氢气的生成速率,其原因是
③要加快上述实验中产生氢气的速率,还可采取的措施是
(2)工业上用海水制氢气的新技术的原理为
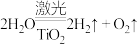 。回答下列问题:
。回答下列问题:①分解海水的反应属于
②分解产生的氢气储存比较困难,有一种储存方法的原理可表示为

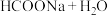 。下列说法正确的是
。下列说法正确的是A.储氢、释氢过程中均有能量变化
B.储氢时反应物中只有离子键的断裂
C.储氢过程中,
 被还原
被还原D.释氢过程中,每消耗0.1mol
 放出2.24L
放出2.24L
(3)
 可与
可与 发生反应:
发生反应: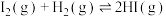 。一定温度下,在恒容密闭容器中进行该反应,下列叙述能说明该反应达到平衡的是_______(填序号)。
。一定温度下,在恒容密闭容器中进行该反应,下列叙述能说明该反应达到平衡的是_______(填序号)。A. |
| B.断裂1mol H―H键的同时形成1mol I―I键 |
| C.容器内气体的压强不变 |
| D.容器内气体的颜色不变 |
您最近一年使用:0次
名校
5 . 过氧化钠有着独特的结构和性质,因而具有广泛的用途,如作为漂白剂、印染剂、空气中二氧化碳吸收剂、潜艇中供氧剂等。
(1) 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
(2)关于 和
和 的异同,下列说法错误的是___________(填字母)。
的异同,下列说法错误的是___________(填字母)。
(3)下列各组物质相互混合进行反应,最终既有气体又有沉淀生成的是___________(填字母)。
(4)将一定量的 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有___________ (填离子符号)。
(1)
 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与
与 反应的化学方程式
反应的化学方程式(2)关于
 和
和 的异同,下列说法错误的是___________(填字母)。
的异同,下列说法错误的是___________(填字母)。| A.常温常压下状态相同,颜色不同 |
| B.包含的正负离子相同,但个数比不同 |
| C.均可由Na和氧气反应得到,但反应条件不同 |
| D.均可与水反应,但产物不同 |
A.金属钠投入 溶液中 溶液中 | B. 投入 投入 溶液中 溶液中 |
C. 投入 投入 溶液中 溶液中 | D. 投入到 投入到 溶液中 溶液中 |
 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有
您最近一年使用:0次
名校
6 . 下图是以合成氨为基础的传统硝酸生产工艺流程(其中空气等基础原料已略去)。 分子的结构式为
分子的结构式为_______________ 。
(2)吸收装置中,发生的反应为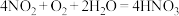 ,若用
,若用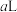
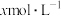 的稀硝酸作为吸收液,反应后得到
的稀硝酸作为吸收液,反应后得到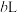
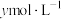 的浓硝酸,则理论上吸收装置中需消耗的
的浓硝酸,则理论上吸收装置中需消耗的 的物质的量为
的物质的量为_______  。
。
(3)实验室常用 溶液吸收
溶液吸收 (
( 和
和 的混合气体),反应的化学方程式如下:
的混合气体),反应的化学方程式如下: ;
; (已知
(已知 不能与
不能与 溶液反应,不考虑
溶液反应,不考虑 与
与 的转化)。
的转化)。
①若 能被
能被 溶液完全吸收,则
溶液完全吸收,则 的取值范围为
的取值范围为_______________ 。
②若
 恰好完全反应,则被吸收的
恰好完全反应,则被吸收的 的体积为
的体积为_________  (标准状况下)。
(标准状况下)。
(4) 催化还原氯氧化物技术(
催化还原氯氧化物技术( )是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示。若催化剂表面参与反应的
)是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示。若催化剂表面参与反应的 和
和 物质的量之比为
物质的量之比为 ,则总反应的化学方程式为
,则总反应的化学方程式为_______________ 。
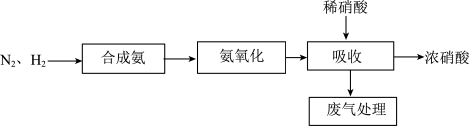
 分子的结构式为
分子的结构式为(2)吸收装置中,发生的反应为
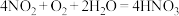 ,若用
,若用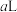
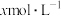 的稀硝酸作为吸收液,反应后得到
的稀硝酸作为吸收液,反应后得到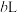
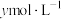 的浓硝酸,则理论上吸收装置中需消耗的
的浓硝酸,则理论上吸收装置中需消耗的 的物质的量为
的物质的量为 。
。(3)实验室常用
 溶液吸收
溶液吸收 (
( 和
和 的混合气体),反应的化学方程式如下:
的混合气体),反应的化学方程式如下: ;
; (已知
(已知 不能与
不能与 溶液反应,不考虑
溶液反应,不考虑 与
与 的转化)。
的转化)。①若
 能被
能被 溶液完全吸收,则
溶液完全吸收,则 的取值范围为
的取值范围为②若

 恰好完全反应,则被吸收的
恰好完全反应,则被吸收的 的体积为
的体积为 (标准状况下)。
(标准状况下)。(4)
 催化还原氯氧化物技术(
催化还原氯氧化物技术( )是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示。若催化剂表面参与反应的
)是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示。若催化剂表面参与反应的 和
和 物质的量之比为
物质的量之比为 ,则总反应的化学方程式为
,则总反应的化学方程式为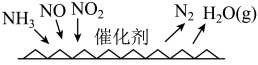
您最近一年使用:0次
名校
7 . 若两种化合物为 ,向溶于水所得溶液中通入足量的
,向溶于水所得溶液中通入足量的 气体,随
气体,随 的通入生成的沉淀质量如图所示:
的通入生成的沉淀质量如图所示: 通入
通入 混合溶液,反应分多个阶段,
混合溶液,反应分多个阶段,
① 阶段的离子反应方程式:
阶段的离子反应方程式:___________ 、___________ 。
②从离子反应发生条件角度说明 段反应先于
段反应先于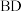 反应的理由:
反应的理由:___________ 。
2.随着 的通入,混合溶液的导电性会发生一些变化,导电性:O点___________B点。
的通入,混合溶液的导电性会发生一些变化,导电性:O点___________B点。
3.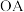 段和
段和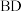 段消耗
段消耗 用量的关系:___________(用
用量的关系:___________(用 和c表示)。
和c表示)。
 ,向溶于水所得溶液中通入足量的
,向溶于水所得溶液中通入足量的 气体,随
气体,随 的通入生成的沉淀质量如图所示:
的通入生成的沉淀质量如图所示:
 通入
通入 混合溶液,反应分多个阶段,
混合溶液,反应分多个阶段,①
 阶段的离子反应方程式:
阶段的离子反应方程式:②从离子反应发生条件角度说明
 段反应先于
段反应先于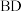 反应的理由:
反应的理由:2.随着
 的通入,混合溶液的导电性会发生一些变化,导电性:O点___________B点。
的通入,混合溶液的导电性会发生一些变化,导电性:O点___________B点。| A.> | B.= | C.< | D.无法确定 |
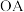 段和
段和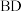 段消耗
段消耗 用量的关系:___________(用
用量的关系:___________(用 和c表示)。
和c表示)。A.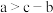 | B. | C.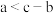 | D.无法确定 |
您最近一年使用:0次
名校
8 . 近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的 、
、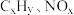 三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。___________ ,X的化学式为___________ 。
②钡元素在周期表中的位置是___________ 。
(2)SCR技术可使 与
与 直接反应,实现无害转化。当
直接反应,实现无害转化。当 与
与 的物质的最之比为2:1时,写出发生反应的化学方程式:
的物质的最之比为2:1时,写出发生反应的化学方程式:___________ 。
(3)利用 氧化氮氧化物反应过程如下:
氧化氮氧化物反应过程如下: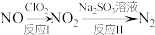 反应I的化学方程式是
反应I的化学方程式是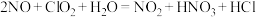 ,反应II的离子方程式是
,反应II的离子方程式是_______________ 。
(4)加入过量次氯酸钠可使废水中 完全转化为
完全转化为 ,而本身被还原为
,而本身被还原为 。检验废水中是否存在
。检验废水中是否存在 的方法是
的方法是___________ 。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的
 、
、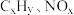 三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。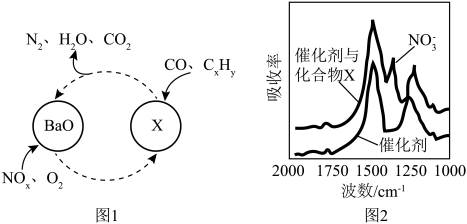
②钡元素在周期表中的位置是
(2)SCR技术可使
 与
与 直接反应,实现无害转化。当
直接反应,实现无害转化。当 与
与 的物质的最之比为2:1时,写出发生反应的化学方程式:
的物质的最之比为2:1时,写出发生反应的化学方程式:(3)利用
 氧化氮氧化物反应过程如下:
氧化氮氧化物反应过程如下: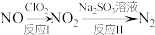 反应I的化学方程式是
反应I的化学方程式是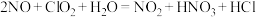 ,反应II的离子方程式是
,反应II的离子方程式是(4)加入过量次氯酸钠可使废水中
 完全转化为
完全转化为 ,而本身被还原为
,而本身被还原为 。检验废水中是否存在
。检验废水中是否存在 的方法是
的方法是
您最近一年使用:0次
名校
9 . 电池在人们的生产生活中起着重要的作用,请回答下列问题:
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,放电时的总反应为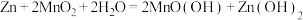 。该电池的正极为
。该电池的正极为 ,其电极反应式为:
,其电极反应式为:___________ 。___________ ;
②写出a电极上发生的电极反应___________ 。
(3)钴酸锂电池的正极采用钴酸锂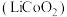 ,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式:
,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式: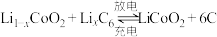 ,写出放电时负极的电极反应
,写出放电时负极的电极反应___________ 。
(4)利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
①烧渣是LiCl、 和
和 的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为
的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为___________ ;
②“滤饼2”的主要成分是___________ ,常温下, 的溶解度比LiOH
的溶解度比LiOH___________ (填“大”或“小”);
③“850℃煅烧”时的化学方程式为:___________ ;
④在实验室检查滤饼2是否洗涤干净的具体操作是:___________ 。
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,放电时的总反应为
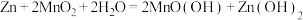 。该电池的正极为
。该电池的正极为 ,其电极反应式为:
,其电极反应式为:
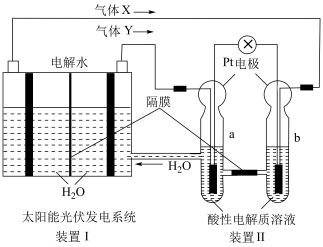
②写出a电极上发生的电极反应
(3)钴酸锂电池的正极采用钴酸锂
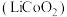 ,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式:
,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式: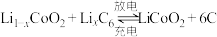 ,写出放电时负极的电极反应
,写出放电时负极的电极反应(4)利用
 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: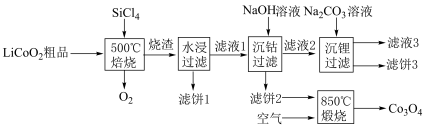
①烧渣是LiCl、
 和
和 的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为
的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为②“滤饼2”的主要成分是
 的溶解度比LiOH
的溶解度比LiOH③“850℃煅烧”时的化学方程式为:
④在实验室检查滤饼2是否洗涤干净的具体操作是:
您最近一年使用:0次
名校
10 .  (亚硝酸钙)广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。
(亚硝酸钙)广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。
(1)用石灰乳吸收硝酸工业尾气中 、
、 ,既能获得
,既能获得 ,亦能净化尾气。
,亦能净化尾气。
① 和
和 与石灰乳生成
与石灰乳生成 的化学方程式为
的化学方程式为_______ 。
②下列措施能提高尾气中 和
和 去除率的有
去除率的有_______ (填字母)
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量石灰乳
③吸收后经处理得到 晶体,该晶体的主要杂质是
晶体,该晶体的主要杂质是_______ (填化学式);吸收后排放的尾气含量较高的氮氧化物是_______ (填化学式)。
(2)实验室可用反应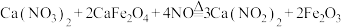 制备
制备 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为_______ 。对于 硫酸和硝酸的混合溶液,若硫酸和硝酸的物质的量浓度存在如下关系:
硫酸和硝酸的混合溶液,若硫酸和硝酸的物质的量浓度存在如下关系: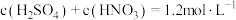 ,则理论上最多能溶解的铜的物质的量为
,则理论上最多能溶解的铜的物质的量为_______  .
.
 (亚硝酸钙)广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。
(亚硝酸钙)广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。(1)用石灰乳吸收硝酸工业尾气中
 、
、 ,既能获得
,既能获得 ,亦能净化尾气。
,亦能净化尾气。①
 和
和 与石灰乳生成
与石灰乳生成 的化学方程式为
的化学方程式为②下列措施能提高尾气中
 和
和 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量石灰乳
③吸收后经处理得到
 晶体,该晶体的主要杂质是
晶体,该晶体的主要杂质是(2)实验室可用反应
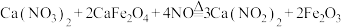 制备
制备 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为 硫酸和硝酸的混合溶液,若硫酸和硝酸的物质的量浓度存在如下关系:
硫酸和硝酸的混合溶液,若硫酸和硝酸的物质的量浓度存在如下关系: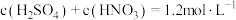 ,则理论上最多能溶解的铜的物质的量为
,则理论上最多能溶解的铜的物质的量为 .
.
您最近一年使用:0次



