1 . 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,其中的关键技术是运用催化转化法实现二氧化碳的碳捕集和碳利用。请回答下列问题:
Ⅰ、一定温度下, 和
和 在催化剂作用下可发生a、b两个平行反应,分别生成
在催化剂作用下可发生a、b两个平行反应,分别生成 和
和 。
。
a: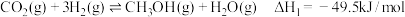
b: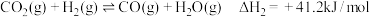
(1)相同温度下,反应 的
的
___________  。
。
(2)在传统的催化固定反应床 中,
中, 的转化率和甲醇的选择性通常都比较低。后来,科学团队研制了一种具有反应和分离双功能的分子筛膜催化反应器
的转化率和甲醇的选择性通常都比较低。后来,科学团队研制了一种具有反应和分离双功能的分子筛膜催化反应器 ,极大地改善了该问题,其原理如图1所示:
,极大地改善了该问题,其原理如图1所示:

保持压强为 ,温度为
,温度为 ,向密闭容器中按投料比,
,向密闭容器中按投料比,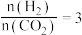 投入一定量
投入一定量 和
和 ,不同反应模式下
,不同反应模式下 的平衡化率和
的平衡化率和 的选择性的相关实验数据如下表所示。
的选择性的相关实验数据如下表所示。
已知: 的选择性是指转化的
的选择性是指转化的 中生成
中生成 的百分比。
的百分比。
①在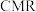 模式下,按上述条件发生反应。下列说法能证明反应a达到平衡状态的是
模式下,按上述条件发生反应。下列说法能证明反应a达到平衡状态的是___________ (填字母)。
A.气体压强不再变化
B.气体的平均相对分子质量不再变化
C. 不再变化
不再变化
D.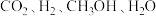 的物质的量之比为
的物质的量之比为
②由表中数据可知,在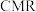 模式下,
模式下, 的转化率明显提高,结合具体反应分析可能的原因是
的转化率明显提高,结合具体反应分析可能的原因是___________ 。
(3)反应b在进气比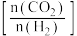 不同时,测得
不同时,测得 的平衡转化率如图2所示(各点对应的反应温度可能相同,也可能不同,其他反应条件均相同)。
的平衡转化率如图2所示(各点对应的反应温度可能相同,也可能不同,其他反应条件均相同)。
①D和F两点对应的温度关系: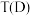
___________  (填“>”、“=”或“<”),其原因是
(填“>”、“=”或“<”),其原因是___________ 。

②恒温条件下,在达到平衡状态为G点的反应过程中,当 的转化率刚好达到
的转化率刚好达到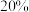 时,
时,
___________ 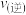 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
Ⅱ、用图3所示装置电解二氧化碳也可制取甲醇,控制在一定温度范围内,持续通入二氧化碳,电解过程中 的物质的量基本不变。
的物质的量基本不变。
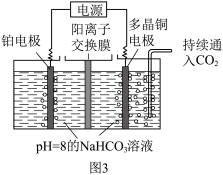
(4)阴极的电极反应式为___________ 。
Ⅰ、一定温度下,
 和
和 在催化剂作用下可发生a、b两个平行反应,分别生成
在催化剂作用下可发生a、b两个平行反应,分别生成 和
和 。
。a:
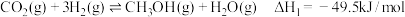
b:
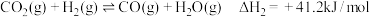
(1)相同温度下,反应
 的
的
 。
。(2)在传统的催化固定反应床
 中,
中, 的转化率和甲醇的选择性通常都比较低。后来,科学团队研制了一种具有反应和分离双功能的分子筛膜催化反应器
的转化率和甲醇的选择性通常都比较低。后来,科学团队研制了一种具有反应和分离双功能的分子筛膜催化反应器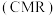 ,极大地改善了该问题,其原理如图1所示:
,极大地改善了该问题,其原理如图1所示:
保持压强为
 ,温度为
,温度为 ,向密闭容器中按投料比,
,向密闭容器中按投料比,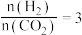 投入一定量
投入一定量 和
和 ,不同反应模式下
,不同反应模式下 的平衡化率和
的平衡化率和 的选择性的相关实验数据如下表所示。
的选择性的相关实验数据如下表所示。| 实验组 | 反应模式 |  | 温度/ |  的平衡转化率 的平衡转化率 |  的选择性 的选择性 |
| ① | 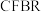 | 3 | 260 | 21.9 | 67.3 |
| ② | 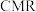 | 3 | 260 | 36.1 | 100.0 |
 的选择性是指转化的
的选择性是指转化的 中生成
中生成 的百分比。
的百分比。①在
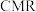 模式下,按上述条件发生反应。下列说法能证明反应a达到平衡状态的是
模式下,按上述条件发生反应。下列说法能证明反应a达到平衡状态的是A.气体压强不再变化
B.气体的平均相对分子质量不再变化
C.
 不再变化
不再变化D.
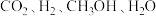 的物质的量之比为
的物质的量之比为
②由表中数据可知,在
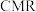 模式下,
模式下, 的转化率明显提高,结合具体反应分析可能的原因是
的转化率明显提高,结合具体反应分析可能的原因是(3)反应b在进气比
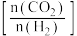 不同时,测得
不同时,测得 的平衡转化率如图2所示(各点对应的反应温度可能相同,也可能不同,其他反应条件均相同)。
的平衡转化率如图2所示(各点对应的反应温度可能相同,也可能不同,其他反应条件均相同)。①D和F两点对应的温度关系:
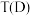
 (填“>”、“=”或“<”),其原因是
(填“>”、“=”或“<”),其原因是
②恒温条件下,在达到平衡状态为G点的反应过程中,当
 的转化率刚好达到
的转化率刚好达到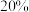 时,
时,
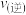 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。Ⅱ、用图3所示装置电解二氧化碳也可制取甲醇,控制在一定温度范围内,持续通入二氧化碳,电解过程中
 的物质的量基本不变。
的物质的量基本不变。
(4)阴极的电极反应式为
您最近一年使用:0次
解题方法
2 . 二甲醚( )是一种清洁能源,可由合成气(
)是一种清洁能源,可由合成气( 、
、 )来制备,反应原理如下:
)来制备,反应原理如下:
反应Ⅰ: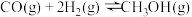

反应Ⅱ: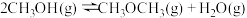

回答下列问题:
(1)上述反应符合“原子经济性”原则的是__________ (填“反应Ⅰ”或“反应Ⅱ”)。
(2)图中使曲线 对应反应按曲线
对应反应按曲线 进行的措施是
进行的措施是__________ ,由合成气( 、
、 )制备
)制备 的热化学方程式为
的热化学方程式为__________ ,该反应自发进行的条件为_________ (填“低温”或“高温”)。

(3)模拟该制备原理,起始时在某容器中充入 和
和 合成
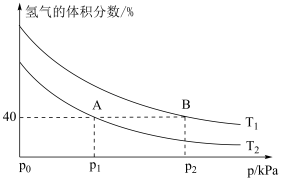
合成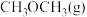 ,平衡时混合物中氢气的体积分数与温度、压强的关系如图所示:
,平衡时混合物中氢气的体积分数与温度、压强的关系如图所示:
①下列有关说法能够证明恒温恒压时,反应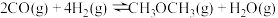
 一定达到平衡状态的是
一定达到平衡状态的是__________ (填序号)。
 .
. 和
和 的转化率相等
的转化率相等
 .反应体系中混合气体密度保持不变
.反应体系中混合气体密度保持不变
 .
. 的值保持不变
的值保持不变
 .反应体系压强保持不变
.反应体系压强保持不变
②图中
________  (填“>”“<”或“=”);理由是
(填“>”“<”或“=”);理由是____________ 。
③在 、
、 两点对应的条件下,该反应从开始到平衡时生成二甲醚的平均速率:
两点对应的条件下,该反应从开始到平衡时生成二甲醚的平均速率: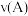
_____ 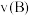 。
。
④ 点对应的
点对应的
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 )是一种清洁能源,可由合成气(
)是一种清洁能源,可由合成气( 、
、 )来制备,反应原理如下:
)来制备,反应原理如下:反应Ⅰ:
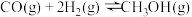

反应Ⅱ:
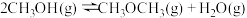

回答下列问题:
(1)上述反应符合“原子经济性”原则的是
(2)图中使曲线
 对应反应按曲线
对应反应按曲线 进行的措施是
进行的措施是 、
、 )制备
)制备 的热化学方程式为
的热化学方程式为
(3)模拟该制备原理,起始时在某容器中充入
 和
和 合成
合成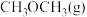 ,平衡时混合物中氢气的体积分数与温度、压强的关系如图所示:
,平衡时混合物中氢气的体积分数与温度、压强的关系如图所示:
①下列有关说法能够证明恒温恒压时,反应
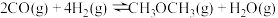
 一定达到平衡状态的是
一定达到平衡状态的是 .
. 和
和 的转化率相等
的转化率相等 .反应体系中混合气体密度保持不变
.反应体系中混合气体密度保持不变 .
. 的值保持不变
的值保持不变 .反应体系压强保持不变
.反应体系压强保持不变②图中

 (填“>”“<”或“=”);理由是
(填“>”“<”或“=”);理由是③在
 、
、 两点对应的条件下,该反应从开始到平衡时生成二甲醚的平均速率:
两点对应的条件下,该反应从开始到平衡时生成二甲醚的平均速率: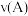
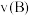 。
。④
 点对应的
点对应的
您最近一年使用:0次
2013·上海崇明·二模
解题方法
3 . 在构成宇宙万物的一百多种元素中,金属约占了80%,它们在现代工业和新材料、新技术研究中具有至关重要的意义。现有a、b、c、d四种金属元素,a是人体内含量最多的金属元素,b是地壳中含量最多的金属元素,c是海水中含量最多的金属元素,d是人类冶炼最多的金属元素。
(1)元素a在元素周期表中的位置为______ ;a原子的核外能量不同的电子有____ 种。
(2)下列可以证明b、c金属性强弱的是_____ 。
A.最高价氧化物对应水化物的溶解性:b<c
B.单质与水反应的剧烈程度:b<c
C.相同条件下,氯化物水溶液的pH值:b<c
D.c可以从b的氯化物水溶液中置换出b
(3)人类冶炼d的时候一般得到的是d的合金,潮湿环境中其表面会产生一层水膜,从而发生腐蚀。下列关于该腐蚀的说法正确的是_____ 。
A.腐蚀过程中,一定会有气体放出
B.腐蚀过程中,水膜的碱性会增强
C.在酸性条件下,负极的电极反应式为:2H++2e-=H2↑
D.与电源的负极相连,可以防止发生这种腐蚀
(4)d单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1 mol该易燃气体放出37.68 kJ热量,请写出此反应的热化学方程式:_____________ 。
(1)元素a在元素周期表中的位置为
(2)下列可以证明b、c金属性强弱的是
A.最高价氧化物对应水化物的溶解性:b<c
B.单质与水反应的剧烈程度:b<c
C.相同条件下,氯化物水溶液的pH值:b<c
D.c可以从b的氯化物水溶液中置换出b
(3)人类冶炼d的时候一般得到的是d的合金,潮湿环境中其表面会产生一层水膜,从而发生腐蚀。下列关于该腐蚀的说法正确的是
A.腐蚀过程中,一定会有气体放出
B.腐蚀过程中,水膜的碱性会增强
C.在酸性条件下,负极的电极反应式为:2H++2e-=H2↑
D.与电源的负极相连,可以防止发生这种腐蚀
(4)d单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1 mol该易燃气体放出37.68 kJ热量,请写出此反应的热化学方程式:
您最近一年使用:0次
解题方法
4 .
(1)下列有关说法正确的是____ 。
A.用pH试纸测得新制氯水的pH为4
B.碳酸钠和硫酸钡可按溶解、过滤、蒸发的操作顺序分离
C.除去C2H5OH中的CH3COOH,先加足量的氢氧化钠溶液,再分液
D.溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀,则该溶液中一定存在
E.将乙醇与浓硫酸共热制得的气体通入酸性 溶液中,检验气体中是否含有乙烯
溶液中,检验气体中是否含有乙烯
F.用铂丝灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,没有K+
G.金属氧化物不一定是碱性氧化物,但碱性氧化物一定是金属氧化物;非金属氧化物不一定是酸性氧化物,酸性氧化物也不一定是非金属氧化物
H.在两个容积相同的容器中,一盛有HCl气体,另一个盛有H2和Cl2的混合气体,在同温同压下,两容器内的气体一定具有相同的原子数
I.实验室配制1mol/L盐酸250mL,需要的仪器只有:250mL容量瓶、胶头滴管、量筒和烧杯
J.在NH4Al(SO4)2(一种复盐)的溶液中加入Ba(OH)2溶液至沉淀的质量达到最大时:

K.硝酸钡溶液中通入足量的SO2: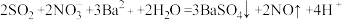
(2)ClO2的制备方法比较实用的有数十种,下列是几种常见的方法.
①方法一: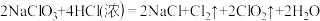
对于该反应,下列说法中正确的是_____ 。
A.该反应中Cl2是氧化产物
B.该反应中NaCl、ClO2是还原产物
C.在反应中HCl既作氧化剂又具有酸的作用
D.1mol NaClO3参加反应时,有1mol电子发生转移
E.1mol NaClO3参加反应,理论上能得到33.6L气体
方法二:氯化钠电解法
该法工艺原理如图。

②其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。指出工艺中方框中物质为______ (填化学式),理由为_______ 。
③将NCl3与NaClO2(亚氯酸钠)按物质的量之比1:6混合,在碱性溶液中恰好反应生成ClO2,试写出该反应的离子方程式____ 。
(1)下列有关说法正确的是
A.用pH试纸测得新制氯水的pH为4
B.碳酸钠和硫酸钡可按溶解、过滤、蒸发的操作顺序分离
C.除去C2H5OH中的CH3COOH,先加足量的氢氧化钠溶液,再分液
D.溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀,则该溶液中一定存在

E.将乙醇与浓硫酸共热制得的气体通入酸性
 溶液中,检验气体中是否含有乙烯
溶液中,检验气体中是否含有乙烯F.用铂丝灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,没有K+
G.金属氧化物不一定是碱性氧化物,但碱性氧化物一定是金属氧化物;非金属氧化物不一定是酸性氧化物,酸性氧化物也不一定是非金属氧化物
H.在两个容积相同的容器中,一盛有HCl气体,另一个盛有H2和Cl2的混合气体,在同温同压下,两容器内的气体一定具有相同的原子数
I.实验室配制1mol/L盐酸250mL,需要的仪器只有:250mL容量瓶、胶头滴管、量筒和烧杯
J.在NH4Al(SO4)2(一种复盐)的溶液中加入Ba(OH)2溶液至沉淀的质量达到最大时:

K.硝酸钡溶液中通入足量的SO2:
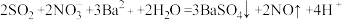
(2)ClO2的制备方法比较实用的有数十种,下列是几种常见的方法.
①方法一:
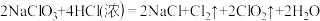
对于该反应,下列说法中正确的是
A.该反应中Cl2是氧化产物
B.该反应中NaCl、ClO2是还原产物
C.在反应中HCl既作氧化剂又具有酸的作用
D.1mol NaClO3参加反应时,有1mol电子发生转移
E.1mol NaClO3参加反应,理论上能得到33.6L气体
方法二:氯化钠电解法
该法工艺原理如图。

②其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。指出工艺中方框中物质为
③将NCl3与NaClO2(亚氯酸钠)按物质的量之比1:6混合,在碱性溶液中恰好反应生成ClO2,试写出该反应的离子方程式
您最近一年使用:0次
解题方法
5 . 金属Mg及其化合物有重要的用途,请回答下列问题
(1)MgO的重要用途有_______ 。(写出一种)
(2)井水中含有较多的Ca2+、Mg2+、HCO3-等离子,可以通过煮沸的方式将Mg2+转化为Mg(OH)2,发生的离子方程式是:__________________ 。
(3)金属Mg可以用来冶炼Ti:2Mg+TiCl4 Ti+2MgCl2。可以用作该反应保护气的是
Ti+2MgCl2。可以用作该反应保护气的是_______ 。
A. He B. CO2C.N2D.HCl
(4)在蒸发皿中放入研细的碘和镁粉,无现象,滴入几滴水后立即产生大量的紫烟,紫烟的成分是_________ (填分子式);对于实验中水的作用,甲同学认为是水溶解了I2,增大了I2与Mg的接触面积,导致了反应加快,乙同学认为是I2与H2O反应生成了酸,是酸与Mg反应放出热量,加快了I2与Mg的反应,请利用供选试剂:0.01mol/L I2的CCl4溶液、0.01 mol/L I2水、I2粉、Mg粉、蒸馏水,设计实验证明哪位同学的说法合理:____________ 。(包括实验过程、现象和结论)
(5)一种新型的Mg-H2O2酸性介质电池工作原理如图,正极发生的电极方程式为:__________ 。

(1)MgO的重要用途有
(2)井水中含有较多的Ca2+、Mg2+、HCO3-等离子,可以通过煮沸的方式将Mg2+转化为Mg(OH)2,发生的离子方程式是:
(3)金属Mg可以用来冶炼Ti:2Mg+TiCl4
 Ti+2MgCl2。可以用作该反应保护气的是
Ti+2MgCl2。可以用作该反应保护气的是A. He B. CO2C.N2D.HCl
(4)在蒸发皿中放入研细的碘和镁粉,无现象,滴入几滴水后立即产生大量的紫烟,紫烟的成分是
(5)一种新型的Mg-H2O2酸性介质电池工作原理如图,正极发生的电极方程式为:

您最近一年使用:0次
名校
解题方法
6 . 高铁酸钠 微溶于
微溶于 溶液,在碱性溶液中较稳定,溶液呈紫色,在酸性或中性溶液中快速产生
溶液,在碱性溶液中较稳定,溶液呈紫色,在酸性或中性溶液中快速产生 。某化学兴趣小组利用如图所示装置(夹持装置略),制取
。某化学兴趣小组利用如图所示装置(夹持装置略),制取 并探究有关性质。回答下列问题:
并探究有关性质。回答下列问题:___________ 。
(2)检查装置B气密性的方法:关闭 ,
, ,
,___________ ,则装置气密性良好。
(3)盛放氯酸钾的仪器名称为___________ ,装置B中试剂的作用为___________ 。
(4)装置C中产生 的离子方程式为
的离子方程式为___________ 。
(5)充分反应后,将装置C中所得混合物经净化处理后得到产品 ,进行如下性质探究:
,进行如下性质探究:
①净水作用:取适量样品溶于蒸馏水后,用一束光照射出现丁达尔效应,用离子方程式解释该出现该现象的原因:___________ 。
②强氧化性:将样品溶于 制成稀溶液,取该溶液滴入
制成稀溶液,取该溶液滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,证明氧化性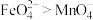 。判断该实验设计是否合理并说明理由:
。判断该实验设计是否合理并说明理由:___________ 。
 微溶于
微溶于 溶液,在碱性溶液中较稳定,溶液呈紫色,在酸性或中性溶液中快速产生
溶液,在碱性溶液中较稳定,溶液呈紫色,在酸性或中性溶液中快速产生 。某化学兴趣小组利用如图所示装置(夹持装置略),制取
。某化学兴趣小组利用如图所示装置(夹持装置略),制取 并探究有关性质。回答下列问题:
并探究有关性质。回答下列问题: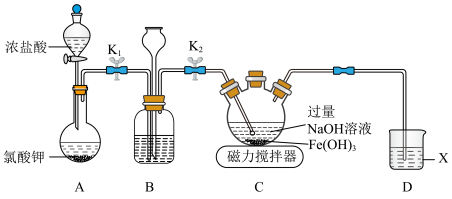
(2)检查装置B气密性的方法:关闭
 ,
, ,
,(3)盛放氯酸钾的仪器名称为
(4)装置C中产生
 的离子方程式为
的离子方程式为(5)充分反应后,将装置C中所得混合物经净化处理后得到产品
 ,进行如下性质探究:
,进行如下性质探究:①净水作用:取适量样品溶于蒸馏水后,用一束光照射出现丁达尔效应,用离子方程式解释该出现该现象的原因:
②强氧化性:将样品溶于
 制成稀溶液,取该溶液滴入
制成稀溶液,取该溶液滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,证明氧化性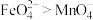 。判断该实验设计是否合理并说明理由:
。判断该实验设计是否合理并说明理由:
您最近一年使用:0次
2024-05-30更新
|
267次组卷
|
2卷引用:重庆市荣昌仁义中学校2024届高三下学期模拟预测化学试题1
解题方法
7 . 某校化学兴趣小组利用如图所示装置模拟进行CO还原 的实验。
的实验。________ 。
(2)有同学认为这套装置的最后不用再加尾气处理装置,请写出原因______ 。
(3)实验结束后,请设计实验证明反应后丙装置剩余液体中溶质的成分______ 。(写出步骤、现象和结论)
 的实验。
的实验。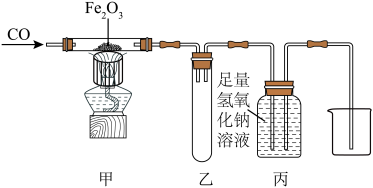
(2)有同学认为这套装置的最后不用再加尾气处理装置,请写出原因
(3)实验结束后,请设计实验证明反应后丙装置剩余液体中溶质的成分
您最近一年使用:0次
名校
解题方法
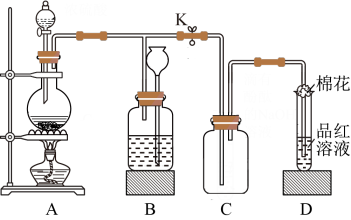
8 . 某化学课外兴趣小组用如图所示装置进行实验,制备某气体并验证其性质。请回答下列问题:
①装置A中发生反应的化学方程式为___________ 。
②实验中,取一定质量的铜片和一定体积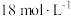 的浓硫酸在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
的浓硫酸在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
A.有一定量的余酸但未能使铜片完全溶解,你认为原因是___________ 。
B.下列药品中能用来证明反应结束后的烧瓶中确有余酸的是___________ (填标号)。
a.铁粉 b. 溶液 c.银粉 d.
溶液 c.银粉 d. 溶液
溶液
(2)若装置A中分液漏斗盛装浓硫酸,圆底烧瓶盛装木炭。
①装置A中发生反应的化学方程式为___________ 。
②设计实验证明装置C中含有 时,所需的试剂有
时,所需的试剂有___________ (填标号)。
a. 溶液 b.澄清石灰水 c.品红溶液 d.酸性
溶液 b.澄清石灰水 c.品红溶液 d.酸性 溶液
溶液
(3)若装置A中分液漏斗盛装浓盐酸,圆底烧瓶盛装 粉末。
粉末。
①装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭止水夹K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是___________ 。
②D中品红溶液褪色,加热试管里已褪色溶液时的现象为___________ 。
(4)装置D中试管口放置的棉花中浸了一种液体,可适用于(1)(2)(3)小题中实验,该液体是___________ 。
①装置A中发生反应的化学方程式为
②实验中,取一定质量的铜片和一定体积
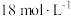 的浓硫酸在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
的浓硫酸在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。A.有一定量的余酸但未能使铜片完全溶解,你认为原因是
B.下列药品中能用来证明反应结束后的烧瓶中确有余酸的是
a.铁粉 b.
 溶液 c.银粉 d.
溶液 c.银粉 d. 溶液
溶液(2)若装置A中分液漏斗盛装浓硫酸,圆底烧瓶盛装木炭。
①装置A中发生反应的化学方程式为
②设计实验证明装置C中含有
 时,所需的试剂有
时,所需的试剂有a.
 溶液 b.澄清石灰水 c.品红溶液 d.酸性
溶液 b.澄清石灰水 c.品红溶液 d.酸性 溶液
溶液(3)若装置A中分液漏斗盛装浓盐酸,圆底烧瓶盛装
 粉末。
粉末。①装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭止水夹K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
②D中品红溶液褪色,加热试管里已褪色溶液时的现象为
(4)装置D中试管口放置的棉花中浸了一种液体,可适用于(1)(2)(3)小题中实验,该液体是
您最近一年使用:0次
2024-03-13更新
|
410次组卷
|
4卷引用:四川省雅安市天全中学2024届高三下学期模拟预测化学试题4
9 . 铅及其化合物用途多样。查资料得知 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:
(1)铅是碳的同族元索,铅原子基态价电子排布式为___________ ,常见价态为_____ 和_____ 。
(2) 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为___________ 。
(3) 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为___________ ; 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为___________ 。
(4) 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即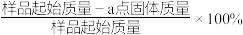 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为___________ 。 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:
①
②
上述过程中 的作用是
的作用是___________ ,请设计实验方案证明 的作用
的作用___________ 。
 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:(1)铅是碳的同族元索,铅原子基态价电子排布式为
(2)
 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为(3)
 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为(4)
 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即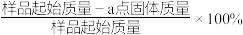 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为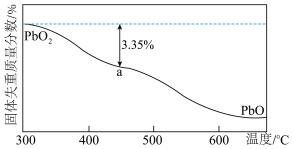
 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:①

②

上述过程中
 的作用是
的作用是 的作用
的作用
您最近一年使用:0次
10 . Ⅰ.某化学兴趣小组的同学学了金属的电化学腐蚀,对教材叙述[钢铁在酸性环境中发生析氢腐蚀;在酸性很弱或呈中性,溶有 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
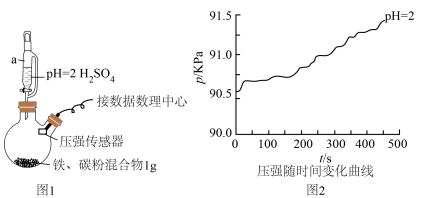
(1)用图1所示装置进行实验:打开a________ (填仪器名称)的活塞,加入1mL溶液,测得压强随时间变化曲线如图2。
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是___________ ,提出改进措施___________ 。改进后,再次实验,证明甲、乙的猜想均正确,请在图2绘制出改进后的曲线___________ 。
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是___________ 。
(4)对于图3中 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为___________ 。
综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
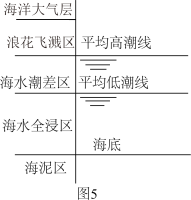
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因___________ 。 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应___________ (离子方程式)。___________ (任写一点即可)。
 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。(1)用图1所示装置进行实验:打开a
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用
 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是(4)对于图3中
 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。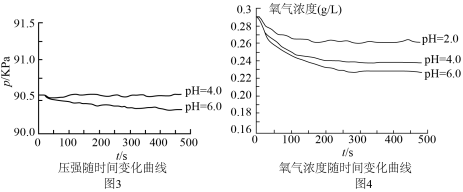
 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因
 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应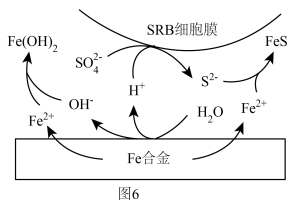
您最近一年使用:0次
2024-01-05更新
|
961次组卷
|
3卷引用:2024届广东东莞中学、广州二中、惠州一中、深圳实验、珠海一中、中山纪念中学六校高三上学期第三次联考化学



