解题方法
1 . 一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s),完成下列填空:
KCl(l)+NaAlSi3O8(s),完成下列填空:
(1)上述反应涉及的第三周期元素中,离子半径最小的是___ ;Cl原子与Si原子可构成有5个原子核的分子,其分子的空间构型为____ 。
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态_____ 。
(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为__ ;NaAlSi3O8改写成氧化物形式是___ 。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量分数)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
分析数据可以得出,氯化钠熔浸钾长石是__________ 反应(填“放热”或“吸热”);在950℃时,欲提高熔出钾的速率可以采取的一种措施是_______ 。
(5)Na(l)+KCl(l) NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是___ 。
(6)铝可用于冶炼难熔金属,利用铝的亲氧性,还可用于制取耐高温的金属陶瓷。例如将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面上,然后在高温下煅烧,可在金属表面形成耐高温的涂层TiC,该反应的化学方程式为_____ 。
 KCl(l)+NaAlSi3O8(s),完成下列填空:
KCl(l)+NaAlSi3O8(s),完成下列填空:(1)上述反应涉及的第三周期元素中,离子半径最小的是
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态
(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量分数)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
| 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
| 950℃ | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
(5)Na(l)+KCl(l)
 NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是(6)铝可用于冶炼难熔金属,利用铝的亲氧性,还可用于制取耐高温的金属陶瓷。例如将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面上,然后在高温下煅烧,可在金属表面形成耐高温的涂层TiC,该反应的化学方程式为
您最近一年使用:0次
2 . 矾是一类含硫化合物,在生活和生产中有着重要应用。
(1)蓝矾(CuSO4•5H2O)属于的物质类别有___ (填序号)。
a.混合物 b.电解质 c.氧化物 d.离子化合物
(2)绿矾(FeSO4•7H2O)溶于水后水溶液显__ 性,绿矾水溶液在空气中久置出现红褐色沉淀,写出相关的离子方程式___ ,绿矾水溶液保存时防止变质可加入试剂为___ (填化学式)。
(3)黄矾[FexSyO9•zH2O]中Fe、S的化合价分别为+3、+6。y=2时,x=__ ,采用热重分析法测定该黄矾样品所含结晶水数,将样品加热到110℃时,只失掉2个结晶水,失重7.2%,黄矾的化学式为___ 。
(1)蓝矾(CuSO4•5H2O)属于的物质类别有
a.混合物 b.电解质 c.氧化物 d.离子化合物
(2)绿矾(FeSO4•7H2O)溶于水后水溶液显
(3)黄矾[FexSyO9•zH2O]中Fe、S的化合价分别为+3、+6。y=2时,x=
您最近一年使用:0次
3 . 纳米硫化亚铁是一种很有潜在价值的新材料,值得深入研究。
1.关于铁元素的认识正确的是_________。
2.可用于检验FeSO4溶液是否变质的是_________。
3.高铁酸钠( Na2FeO4) 可用作净水剂,其原因是_________。
4.Fe、Co、Ni三种元素二价氧化物的晶胞类型相同,其熔点最高的是____ 。
A. FeO B. CoO C. NiO
纳米FeS可去除水中微量六价铬[Cr(Ⅵ)]。在pH=4~7的水溶液中,纳米FeS颗粒表面带正电荷,Cr(Ⅵ)主要以CrO 等形式存在,纳米FeS去除水中Cr(Ⅵ)主要经过“吸附→反应→沉淀”的过程。已知: Ksp(FeS)=6.5×10-18,Ksp[Fe(OH)2]=5.0×10-17;H2S的电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。
等形式存在,纳米FeS去除水中Cr(Ⅵ)主要经过“吸附→反应→沉淀”的过程。已知: Ksp(FeS)=6.5×10-18,Ksp[Fe(OH)2]=5.0×10-17;H2S的电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。
5.在弱酸性溶液中,反应FeS+H+ Fe2++HS-的平衡常数K的数值为
Fe2++HS-的平衡常数K的数值为____ 。
在pH=4~7溶液中,pH越大,FeS去除水中Cr(Ⅵ)的速率越慢,原因是____________ 。
6.FeS2的一种晶体与NaCl晶体的结构相似,该FeS2晶体的一个晶胞中S 的数目为_________。
的数目为_________。
7.在FeS2晶体中,每个S原子与三个Fe2+紧邻,且Fe—S间距相等,如图给出了FeS2晶胞中的Fe2+和位于晶胞体心的S (S
(S 中的S—S键位于晶胞体对角线上,晶胞中的其他S
中的S—S键位于晶胞体对角线上,晶胞中的其他S 已省略)。图1中用“—”将其中一个S原子与紧邻的Fe2+连接起来
已省略)。图1中用“—”将其中一个S原子与紧邻的Fe2+连接起来_________ 。

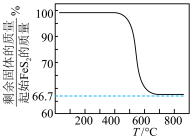
8.FeS2、FeS在空气中易被氧化。将FeS2在空气中氧化,测得氧化过程中剩余固体的质量与起始FeS2的质量的比值随温度变化的曲线如图所示。800℃时,FeS2氧化成含有两种元素的固体产物_______ 。
1.关于铁元素的认识正确的是_________。
| A.能存在于人体的血红蛋白中 | B.是地壳中含量最多的金属元素 |
| C.单质是人类最早使用的金属 | D.铁的氧化物都具有致密的结构 |
| A.稀盐酸 | B.酚酞试液 | C.KSCN溶液 | D.苯酚 |
| A.能吸附水中杂质,氧化产物能消毒杀菌 |
| B.可消毒杀菌,氧化产物能吸附水中杂质 |
| C.能吸附水中杂质,还原产物能消毒杀菌 |
| D.可消毒杀菌,还原产物能吸附水中杂质 |
A. FeO B. CoO C. NiO
纳米FeS可去除水中微量六价铬[Cr(Ⅵ)]。在pH=4~7的水溶液中,纳米FeS颗粒表面带正电荷,Cr(Ⅵ)主要以CrO
 等形式存在,纳米FeS去除水中Cr(Ⅵ)主要经过“吸附→反应→沉淀”的过程。已知: Ksp(FeS)=6.5×10-18,Ksp[Fe(OH)2]=5.0×10-17;H2S的电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。
等形式存在,纳米FeS去除水中Cr(Ⅵ)主要经过“吸附→反应→沉淀”的过程。已知: Ksp(FeS)=6.5×10-18,Ksp[Fe(OH)2]=5.0×10-17;H2S的电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。5.在弱酸性溶液中,反应FeS+H+
 Fe2++HS-的平衡常数K的数值为
Fe2++HS-的平衡常数K的数值为在pH=4~7溶液中,pH越大,FeS去除水中Cr(Ⅵ)的速率越慢,原因是
6.FeS2的一种晶体与NaCl晶体的结构相似,该FeS2晶体的一个晶胞中S
 的数目为_________。
的数目为_________。| A.2 | B.4 | C.6 | D.8 |
 (S
(S 中的S—S键位于晶胞体对角线上,晶胞中的其他S
中的S—S键位于晶胞体对角线上,晶胞中的其他S 已省略)。图1中用“—”将其中一个S原子与紧邻的Fe2+连接起来
已省略)。图1中用“—”将其中一个S原子与紧邻的Fe2+连接起来
8.FeS2、FeS在空气中易被氧化。将FeS2在空气中氧化,测得氧化过程中剩余固体的质量与起始FeS2的质量的比值随温度变化的曲线如图所示。800℃时,FeS2氧化成含有两种元素的固体产物

您最近一年使用:0次
4 . 中国高铁被誉为中国新“四大发明”之一,它对实现“一带一路”的构想有重要的作用。
(1)建设高铁轨道需要大量的水泥,生产水泥的主要原材料是黏土和___________ 。
(2)高铁车厢的大部分材料是铝合金,是利用了铝合金材料___________ (填2种)等优点。
(3)高铁上安装有许多玻璃,氢氟酸可以处理玻璃表面的微裂纹,氢氟酸与玻璃中的二氧化硅反应的化学方程式为___________ 。
(4)高铁洗手间中有一瓶“84”消毒液。
①在“84”消毒液中滴加几滴酚酞试液,可观察到的现象是___________ 。
②“84”消毒液必须避光密封保存,目的是防止与空气中的二氧化碳反应而变质,用化学方程式解释其原因:a.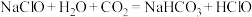 ;b.
;b.___________ 。
③“84”消毒液还可作为水处理剂除去水中的杂质离子。例如过量次氯酸钠可使酸性废水中的 完全转化为
完全转化为 ,该反应中氧化剂与氧化产物的物质的量之比为
,该反应中氧化剂与氧化产物的物质的量之比为___________ 。
(1)建设高铁轨道需要大量的水泥,生产水泥的主要原材料是黏土和
(2)高铁车厢的大部分材料是铝合金,是利用了铝合金材料
(3)高铁上安装有许多玻璃,氢氟酸可以处理玻璃表面的微裂纹,氢氟酸与玻璃中的二氧化硅反应的化学方程式为
(4)高铁洗手间中有一瓶“84”消毒液。
①在“84”消毒液中滴加几滴酚酞试液,可观察到的现象是
②“84”消毒液必须避光密封保存,目的是防止与空气中的二氧化碳反应而变质,用化学方程式解释其原因:a.
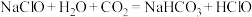 ;b.
;b.③“84”消毒液还可作为水处理剂除去水中的杂质离子。例如过量次氯酸钠可使酸性废水中的
 完全转化为
完全转化为 ,该反应中氧化剂与氧化产物的物质的量之比为
,该反应中氧化剂与氧化产物的物质的量之比为
您最近一年使用:0次
2023-09-17更新
|
170次组卷
|
2卷引用:陕西省商洛市山阳中学2022-2023学年高三一模考试化学试题
17-18高三上·北京·期中
名校
解题方法
5 . 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:
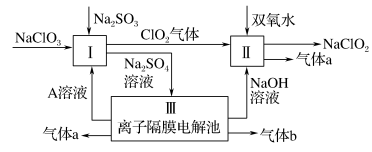
(1)Ⅰ中发生反应的还原剂是____ (填化学式)。
(2)Ⅱ中反应的离子方程式是____ 。
(3)Ⅲ中离子隔膜电解池的装置如下:
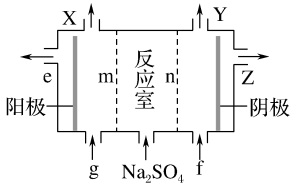
①A的化学式是________ ,A在____ 口产生。
②m为____ (填“阴”或“阳”)离子交换膜。
③结合化学用语和文字说明解释NaOH产生的原因:________
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是____ 。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是____ 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者____ (填“>”“<”或“=”)后者。

(1)Ⅰ中发生反应的还原剂是
(2)Ⅱ中反应的离子方程式是
(3)Ⅲ中离子隔膜电解池的装置如下:

①A的化学式是
②m为
③结合化学用语和文字说明解释NaOH产生的原因:
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者
您最近一年使用:0次
名校
解题方法
6 . 戊二醛( )是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。
)是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。
I.吡喃法制备戊二醛的反应步骤如下:
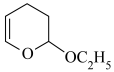
第一步:
第二步:CH2=CHCHO+CH2=CHOC2H5
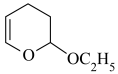
第三步: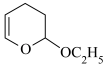

有关有机物性质如下表所示:
(1)分离第二步反应后混合物的方法是_______ 。
(2)第二步反应中有管道堵塞情况,分析原因。
原因1:产物在催化剂条件下发生开环聚合生成堵塞管道的物质。
原因2:反应物与产物反应生成堵塞管道的物质。写出 与
与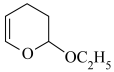 发生类似第二步反应所生成产物的结构简式:①
发生类似第二步反应所生成产物的结构简式:①_______ 。
原因3:②_______ 。
(3)该制备过程中可循环使用的物质是_______ 。
Ⅱ.在某催化剂下,用环戊烯( )法制备戊二醛的反应途径如下图所示。
)法制备戊二醛的反应途径如下图所示。
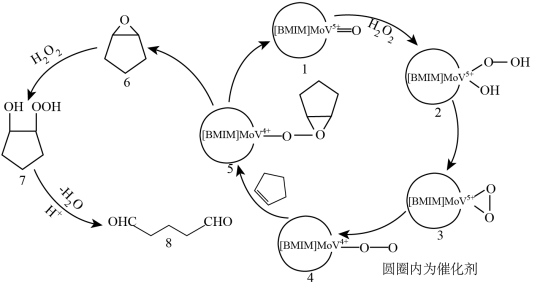
(4)过氧化氢氧化环戊烯的化学方程式为_______ 。
(5)已知过氧化氢用量过少、过多都降低戊二醛的选择性。请结合反应途径解释可能的原因:_______ 。
Ⅲ.测定戊二醛的含量:取 含戊二醛的样品液于
含戊二醛的样品液于 碘量瓶中。加入过量6.5%三乙醇胺
碘量瓶中。加入过量6.5%三乙醇胺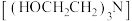 溶液
溶液 与盐酸羟胺
与盐酸羟胺 中性溶液
中性溶液 ,摇匀,静置反应
,摇匀,静置反应 。用
。用 硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液
硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液 。
。
以不含戊二醛的三乙醇胺、盐酸羟胺中性溶液重复上述操作,消耗硫酸标准液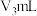 。
。
滴定过程中发生如下反应:
反应a: +
+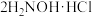 =
=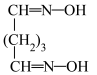 +2HCl+2H2O(反应较慢)
+2HCl+2H2O(反应较慢)
反应b: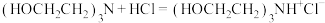
反应c: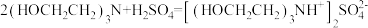
(6)该样品液中戊二醛的含量为_______  。(戊二醛的摩尔质量:
。(戊二醛的摩尔质量: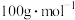 )
)
 )是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。
)是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。I.吡喃法制备戊二醛的反应步骤如下:
第一步:

第二步:CH2=CHCHO+CH2=CHOC2H5


第三步:


有关有机物性质如下表所示:
| 结构简式 | 溶解性 | 密度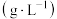 | 沸点( ) ) |
 | 溶于水 | 0.84 | 52.5 |
 | 微溶于水 | 0.753 | 33.0 |
 | 微溶于水 | 0.969 | 144.8 |
 | 溶于水 | 1.063 | 187.0 |
(2)第二步反应中有管道堵塞情况,分析原因。
原因1:产物在催化剂条件下发生开环聚合生成堵塞管道的物质。
原因2:反应物与产物反应生成堵塞管道的物质。写出
 与
与 发生类似第二步反应所生成产物的结构简式:①
发生类似第二步反应所生成产物的结构简式:①原因3:②
(3)该制备过程中可循环使用的物质是
Ⅱ.在某催化剂下,用环戊烯(
 )法制备戊二醛的反应途径如下图所示。
)法制备戊二醛的反应途径如下图所示。
(4)过氧化氢氧化环戊烯的化学方程式为
(5)已知过氧化氢用量过少、过多都降低戊二醛的选择性。请结合反应途径解释可能的原因:
Ⅲ.测定戊二醛的含量:取
 含戊二醛的样品液于
含戊二醛的样品液于 碘量瓶中。加入过量6.5%三乙醇胺
碘量瓶中。加入过量6.5%三乙醇胺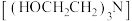 溶液
溶液 与盐酸羟胺
与盐酸羟胺 中性溶液
中性溶液 ,摇匀,静置反应
,摇匀,静置反应 。用
。用 硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液
硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液 。
。以不含戊二醛的三乙醇胺、盐酸羟胺中性溶液重复上述操作,消耗硫酸标准液
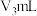 。
。滴定过程中发生如下反应:
反应a:
 +
+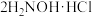 =
=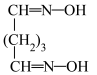 +2HCl+2H2O(反应较慢)
+2HCl+2H2O(反应较慢)反应b:
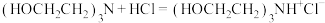
反应c:
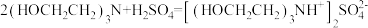
(6)该样品液中戊二醛的含量为
 。(戊二醛的摩尔质量:
。(戊二醛的摩尔质量: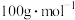 )
)
您最近一年使用:0次
2023-05-28更新
|
356次组卷
|
2卷引用:北京市十一学校2023届高三下学期三模化学试题
7 . 草酸、KMnO4均是重要的化学分析试剂,某次实验中需要使用480mL0.2000mol/L的草酸溶液,回答下列问题。
(1)实验中需要称取___________ g草酸晶体(H2C2O4•2H2O),称量后___________ (填“需要”或“不需要”)加热除去相应的结晶水;配制过程中需要使用的玻璃仪器有玻璃棒、胶头滴管及___________ 。
(2)假设称取草酸时使用的是托盘天平,称量中试剂与砝码位置错放,则所配制溶液中c(H2C2O4)0.2000
___________ (填“>”、“=”或“<”,下同);若定容时俯视刻度线,则所配溶液中c(H2C2O4)___________ 0.2000 。
。
(3)若配置溶液时所取草酸晶体不纯(杂质无还原性),为测定草酸的纯度,某同学量取20.00mL,上述所配溶液放入锥形瓶中,然后用0.1000 的酸性KMnO4标准溶液滴定(氧化产物是CO2),滴定终点时消耗VmL标准溶液。
的酸性KMnO4标准溶液滴定(氧化产物是CO2),滴定终点时消耗VmL标准溶液。
①标准溶液应使用___________ (填“酸”或“碱”)式滴定管取用,合理的V值可能是___________ 。
A. 15.8 B. 16.20 C. 15.82 D. 16.18
②滴定终点时溶液颜色的变化为___________ ,样品中草酸晶体的质量分数为___________ (用含V的式子表示)。
(1)实验中需要称取
(2)假设称取草酸时使用的是托盘天平,称量中试剂与砝码位置错放,则所配制溶液中c(H2C2O4)0.2000

 。
。(3)若配置溶液时所取草酸晶体不纯(杂质无还原性),为测定草酸的纯度,某同学量取20.00mL,上述所配溶液放入锥形瓶中,然后用0.1000
 的酸性KMnO4标准溶液滴定(氧化产物是CO2),滴定终点时消耗VmL标准溶液。
的酸性KMnO4标准溶液滴定(氧化产物是CO2),滴定终点时消耗VmL标准溶液。①标准溶液应使用
A. 15.8 B. 16.20 C. 15.82 D. 16.18
②滴定终点时溶液颜色的变化为
您最近一年使用:0次
名校
解题方法
8 . 某化学小组在实验室制取Na2O2。 查阅资料可知,温度在573~673 K之间可生成Na2O2,若温度提高到733 K以上Na2O2会分解。除Li外其他碱金属不与N2反应。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为______ 。
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是_____ 。水槽中量筒中收集到的气体为_____ 。测定装置的接口从左至右正确的连接顺序是_____ 。
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果____ (填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案I中发生反应的化学方程式为_______ 。 根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是______ 。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液,加入少量MnO2粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液后先变红后褪色 |
您最近一年使用:0次
2020-09-11更新
|
789次组卷
|
10卷引用:2021年河北省高考化学试卷变式题10-18题
2021年河北省高考化学试卷变式题10-18题山西省忻州市第一中学2020-2021学年高二上学期开学考试化学试题山西省运城市景胜中学2020-2021学年高一10月月考化学试题河北省邢台市2022届高三9月第二次联合考试化学试题河北省邯郸市肥乡区第一中学2022届高三开学考试化学试卷山东省济南市商河县第三中学2022届高三10月月考化学试题广西贺州市昭平中学2021-2022学年高二下学期第一次月考化学试题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)河南省顶级名校2023届高三上学期10月月考化学试题(已下线)第1讲 钠及其重要化合物
2013·上海徐汇·二模
解题方法
9 . (1)三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式_________ 。
(2)加入过量的KMnO4才能将水中的三氯乙烯彻底除去。已知n(KMnO4):n(C2HCl3)=5:1时,水样中的三氯乙烯基本完全去除。某地下水样品中三氯乙烯的质量浓度为1×10-4g/L,计算每处理1m3该地下水,需KMnO4_______ g。
(2)加入过量的KMnO4才能将水中的三氯乙烯彻底除去。已知n(KMnO4):n(C2HCl3)=5:1时,水样中的三氯乙烯基本完全去除。某地下水样品中三氯乙烯的质量浓度为1×10-4g/L,计算每处理1m3该地下水,需KMnO4
您最近一年使用:0次
10 . 高氯酸盐(ClO4-)有高稳定性和强氧化性,常作为氧化剂用于工业生产。
(1)高氯酸盐中氯元素的化合价为________ 。
(2)下列叙述中可说明氯元素比硫元素非金属性强的是_________ 。
① HCl比H2S稳定
② HClO4的酸性比H2SO3的强
③ Cl2可与Na2S发生置换反应
(3)NH4ClO4是复合火箭推进剂的重要成分,实验室可通过反应NaClO4+NH4Cl NH4ClO4+NaCl制取。相关物质的溶解度曲线如图:
NH4ClO4+NaCl制取。相关物质的溶解度曲线如图:

① 结合溶解度,分析该反应能够发生的原因________ 。
② 从反应后热的混合液中获得较多NH4ClO4晶体的实验操作依次为________ 、蒸发浓缩、冷却结晶、过滤、冰水洗涤。
(4)高氯酸盐是一种新型的无机污染物,ClO4-的主要危害是与碘离子竞争进入人体甲状腺,影响甲状腺的正常功能。利用电化学催化法,酸性环境中,可将ClO4-还原为Cl-,该电极反应式为________ 。
(5)已知,加热时Cu(ClO4)2的分解方式有以下两种:
2Cu(ClO4)2 2CuO+7O2↑+2Cl2↑
2CuO+7O2↑+2Cl2↑
Cu(ClO4)2 CuCl2+4O2↑
CuCl2+4O2↑
取一定质量的Cu(ClO4)2·6H2O样品,加热至某温度使其完全分解,若测得V(O2)∶V(Cl2)=5∶1,则分解所得固体产物中CuO与CuCl2的物质的量之比为________ 。
(1)高氯酸盐中氯元素的化合价为
(2)下列叙述中可说明氯元素比硫元素非金属性强的是
① HCl比H2S稳定
② HClO4的酸性比H2SO3的强
③ Cl2可与Na2S发生置换反应
(3)NH4ClO4是复合火箭推进剂的重要成分,实验室可通过反应NaClO4+NH4Cl
 NH4ClO4+NaCl制取。相关物质的溶解度曲线如图:
NH4ClO4+NaCl制取。相关物质的溶解度曲线如图:
① 结合溶解度,分析该反应能够发生的原因
② 从反应后热的混合液中获得较多NH4ClO4晶体的实验操作依次为
(4)高氯酸盐是一种新型的无机污染物,ClO4-的主要危害是与碘离子竞争进入人体甲状腺,影响甲状腺的正常功能。利用电化学催化法,酸性环境中,可将ClO4-还原为Cl-,该电极反应式为
(5)已知,加热时Cu(ClO4)2的分解方式有以下两种:
2Cu(ClO4)2
 2CuO+7O2↑+2Cl2↑
2CuO+7O2↑+2Cl2↑ Cu(ClO4)2
 CuCl2+4O2↑
CuCl2+4O2↑取一定质量的Cu(ClO4)2·6H2O样品,加热至某温度使其完全分解,若测得V(O2)∶V(Cl2)=5∶1,则分解所得固体产物中CuO与CuCl2的物质的量之比为
您最近一年使用:0次



