名校
1 . 已知草酸钙( )加热易分解。某实验小组对其分解产物进行探究。
)加热易分解。某实验小组对其分解产物进行探究。
【查阅资料】草酸钙加热分解产生金属氧化物和非金属氧化物。
【提出问题】非金属氧化物的成分是什么?
【提出猜想】猜想一:CO
猜想二:
猜想三:CO和
猜想四:
【提出质疑】
(1)猜想四不成立,原因是_______ 。
【设计实验】
(2)实验装置如图:
【实验结论】
(3)猜想_______ 成立,则草酸钙分解的化学方程式为_______ 。
【交流反思】
(4)从环保的角度考虑,该实验装置的不足之处是_______ 。
 )加热易分解。某实验小组对其分解产物进行探究。
)加热易分解。某实验小组对其分解产物进行探究。【查阅资料】草酸钙加热分解产生金属氧化物和非金属氧化物。
【提出问题】非金属氧化物的成分是什么?
【提出猜想】猜想一:CO
猜想二:

猜想三:CO和

猜想四:

【提出质疑】
(1)猜想四不成立,原因是
【设计实验】
(2)实验装置如图:
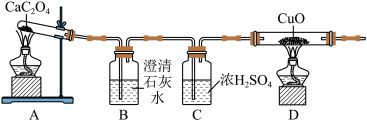
| 实验现象 | 结论 |
| B中观察到澄清石灰水变浑浊 | 非金属氧化物中有 |
| D中观察到 | 非金属氧化物中有CO |
【实验结论】
(3)猜想
【交流反思】
(4)从环保的角度考虑,该实验装置的不足之处是
您最近一年使用:0次
2 . 铜冶炼是“有色金属王国”云南省的重要产业。铜电解精炼产生的阳极泥是提取Cu、Ag、Au等金属的原料之一,阳极泥中的As主要以 形式存在,对金属提取和废水达标排放都会产生影响,需预先分离脱除。一种从铜阳极泥中分离As的工艺流程如图:
形式存在,对金属提取和废水达标排放都会产生影响,需预先分离脱除。一种从铜阳极泥中分离As的工艺流程如图:
(1)As与N同族,其基态原子的价层电子排布式为_______ 。
(2)“操作X”为_______ 。
(3)“加热氧化”中,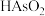 转化为
转化为 (结构如图),As的杂化类型由
(结构如图),As的杂化类型由_______ 转变为_______ 。
①发生的化学反应为__________ 。
_______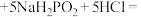 _______
_______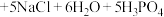
②As产率随还原温度变化如图,当温度达到_______ ℃时,As产率最高。_______ g 。[已知:
。[已知: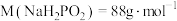 ]
]
(5)工艺中可循环利用的物质为_______ (写出一种即可)。
(6)砷化镓是一种半导体材料,晶胞结构示意图如图。_______ 。
②砷化镓晶胞体积为 ,晶体密度
,晶体密度
_______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 形式存在,对金属提取和废水达标排放都会产生影响,需预先分离脱除。一种从铜阳极泥中分离As的工艺流程如图:
形式存在,对金属提取和废水达标排放都会产生影响,需预先分离脱除。一种从铜阳极泥中分离As的工艺流程如图: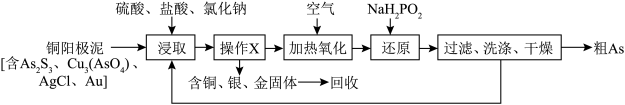
(1)As与N同族,其基态原子的价层电子排布式为
(2)“操作X”为
(3)“加热氧化”中,
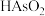 转化为
转化为 (结构如图),As的杂化类型由
(结构如图),As的杂化类型由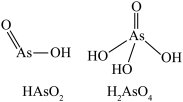
①发生的化学反应为
_______
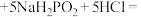 _______
_______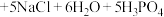
②As产率随还原温度变化如图,当温度达到

 。[已知:
。[已知: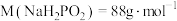 ]
](5)工艺中可循环利用的物质为
(6)砷化镓是一种半导体材料,晶胞结构示意图如图。
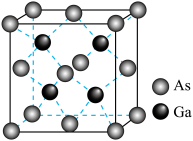
②砷化镓晶胞体积为
 ,晶体密度
,晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
3 . 某待测液中可能含有 、
、 ,
, ,
, ,
, ,
, ,
, ,
, ,
, ,
, ,
, ,
, 等12种离子中的某几种。为探究其组成现设计如图流程。
等12种离子中的某几种。为探究其组成现设计如图流程。
(1)待测液中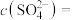
_______  。
。
(2)生成不溶物I的离子方程式为_______ 。
(3)不溶物Ⅱ和不溶物Ⅲ的化学式分别为_______ 、_______ 。
(4)若向溶液I中加入过量的稀盐酸,观察到的现象为_______ 。
(5)待测液中,一定含有的阴离子有 、
、_______ ,一定不含的离子是_______ 。
 、
、 ,
, ,
, ,
, ,
, ,
, ,
, ,
, ,
, ,
, ,
, 等12种离子中的某几种。为探究其组成现设计如图流程。
等12种离子中的某几种。为探究其组成现设计如图流程。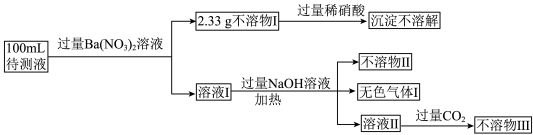
(1)待测液中
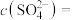
 。
。(2)生成不溶物I的离子方程式为
(3)不溶物Ⅱ和不溶物Ⅲ的化学式分别为
(4)若向溶液I中加入过量的稀盐酸,观察到的现象为
(5)待测液中,一定含有的阴离子有
 、
、
您最近一年使用:0次
名校
解题方法
4 . 亚硝酸钙 广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂,其为白色粉末,易潮解、易溶于水。某实验小组采用下列装置,用干燥NO与过氧化钙反应制备固体
广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂,其为白色粉末,易潮解、易溶于水。某实验小组采用下列装置,用干燥NO与过氧化钙反应制备固体 。
。
已知:浓硫酸与 不反应。
不反应。 的名称是
的名称是___________ 。
(2)装置Ⅳ中反应的化学方程式为___________ 。
(3)装置的连接顺序是:___________ 。
c→___________→___________→___________→___________→___________→___________→h(填字母,按气体由左到右顺序)
(4)装置V的作用是___________ 。
(5)装置Ⅵ中氮元素被氧化为 价,锰元素被还原为
价,锰元素被还原为 ,则反应的离子方程式为
,则反应的离子方程式为___________ 。
(6)所得亚硝酸钙 产品中只含硝酸钙杂质,测定该产品中亚硝酸钙纯度。实验步骤如下:称量
产品中只含硝酸钙杂质,测定该产品中亚硝酸钙纯度。实验步骤如下:称量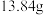 产品溶于水中,加入足量碳酸钠溶液充分反应后,经过滤、洗涤、干燥并称重,得固体质量为
产品溶于水中,加入足量碳酸钠溶液充分反应后,经过滤、洗涤、干燥并称重,得固体质量为 。
。
①如何洗涤沉淀?___________ (写出具体操作)。
②所得产品中亚硝酸钙的纯度为___________  (保留三位有效数字)。
(保留三位有效数字)。
 广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂,其为白色粉末,易潮解、易溶于水。某实验小组采用下列装置,用干燥NO与过氧化钙反应制备固体
广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂,其为白色粉末,易潮解、易溶于水。某实验小组采用下列装置,用干燥NO与过氧化钙反应制备固体 。
。已知:浓硫酸与
 不反应。
不反应。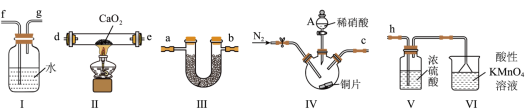
 的名称是
的名称是(2)装置Ⅳ中反应的化学方程式为
(3)装置的连接顺序是:
c→___________→___________→___________→___________→___________→___________→h(填字母,按气体由左到右顺序)
(4)装置V的作用是
(5)装置Ⅵ中氮元素被氧化为
 价,锰元素被还原为
价,锰元素被还原为 ,则反应的离子方程式为
,则反应的离子方程式为(6)所得亚硝酸钙
 产品中只含硝酸钙杂质,测定该产品中亚硝酸钙纯度。实验步骤如下:称量
产品中只含硝酸钙杂质,测定该产品中亚硝酸钙纯度。实验步骤如下:称量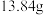 产品溶于水中,加入足量碳酸钠溶液充分反应后,经过滤、洗涤、干燥并称重,得固体质量为
产品溶于水中,加入足量碳酸钠溶液充分反应后,经过滤、洗涤、干燥并称重,得固体质量为 。
。①如何洗涤沉淀?
②所得产品中亚硝酸钙的纯度为
 (保留三位有效数字)。
(保留三位有效数字)。
您最近一年使用:0次
名校
解题方法
5 . 化学反应在发生物质变化的同时伴随有能量的变化,是人类获取能量的重要途径,请回答下列问题。
(1)硅是太阳能电池的重要材料,“精炼硅”反应历程中的能量变化如下图所示:___________ (填序号)。
①酸碱中和反应;②碳酸钙分解;③金属钠与水反应;④酒精燃烧;⑤灼热的碳与二氧化碳反应;⑥ 与
与 反应
反应
(2)为了减轻大气污染,可将汽车尾气中CO和NO转化为无污染气体。在一定条件下,向一容积为VL的恒容密闭容器中充入10molCO、10molNO,使之在催化剂作用下发生反应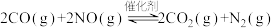 ,测得反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。
,测得反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。 的物质的量随时间变化的曲线为
的物质的量随时间变化的曲线为___________ (填“I”“Ⅱ”或“Ⅲ”): 内,
内,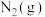 的平均反应速率为
的平均反应速率为___________  。
。
②根据图示可知,用同一物质表示反应速率时,a点的正反应速率___________ (填“大于”、“小于”或“等于”)c点的逆反应速率。
③反应达到平衡时,CO的转化率为___________ ;设平衡时容器内压强为p,反应起始时容器内压强为 ,则
,则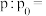
___________ 。
④若在容积固定的绝热容器中发生上述反应,不能说明该反应已达到平衡状态的是___________ (填字母)。
A.容器内温度不再变化
B.容器内的气体压强保持不变
C.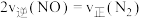
D.容器内混合气体的密度保持不变
(1)硅是太阳能电池的重要材料,“精炼硅”反应历程中的能量变化如下图所示:
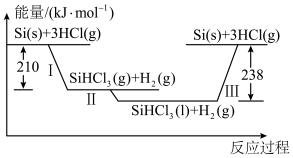
①酸碱中和反应;②碳酸钙分解;③金属钠与水反应;④酒精燃烧;⑤灼热的碳与二氧化碳反应;⑥
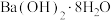 与
与 反应
反应(2)为了减轻大气污染,可将汽车尾气中CO和NO转化为无污染气体。在一定条件下,向一容积为VL的恒容密闭容器中充入10molCO、10molNO,使之在催化剂作用下发生反应
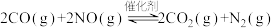 ,测得反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。
,测得反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。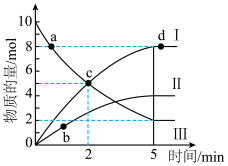
 的物质的量随时间变化的曲线为
的物质的量随时间变化的曲线为 内,
内,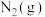 的平均反应速率为
的平均反应速率为 。
。②根据图示可知,用同一物质表示反应速率时,a点的正反应速率
③反应达到平衡时,CO的转化率为
 ,则
,则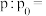
④若在容积固定的绝热容器中发生上述反应,不能说明该反应已达到平衡状态的是
A.容器内温度不再变化
B.容器内的气体压强保持不变
C.
D.容器内混合气体的密度保持不变
您最近一年使用:0次
名校
解题方法
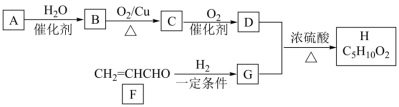
6 . 烃A是一种果实催熟剂,A的产量是衡量一个国家石油工业发展水平的标志,H是一种油状、有香味的物质。有关物质转化关系如下图: 。
。
请回答:
(1)C中官能团的名称为___________
(2)写出与F互为同系物的含5个碳原子的有机物的结构简式___________ (任写一种)。
(3)写出B→C的化学方程式___________
(4)写出D+G→H的化学反应方程式___________ ,其反应类型是___________ 反应。
(5)将B设计成燃料电池的工作原理如图所示,a、b均为惰性电极。___________ (填“a”或“b”)电极定向移动。
②电池工作时,a极的电极反应式为___________ 。
 。
。请回答:
(1)C中官能团的名称为
(2)写出与F互为同系物的含5个碳原子的有机物的结构简式
(3)写出B→C的化学方程式
(4)写出D+G→H的化学反应方程式
(5)将B设计成燃料电池的工作原理如图所示,a、b均为惰性电极。
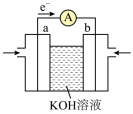
②电池工作时,a极的电极反应式为
您最近一年使用:0次
名校
解题方法
7 . 永利川西化工厂是侯德榜主导的中国早期的制碱厂,其工艺流程图如图,请结合相关知识回答下列问题: 、
、 和
和___________ 。(填化学式)
(2)写出碳酸氢钠在水中电离的电离方程式:___________ 。
(3)某实验小组欲用稀盐酸测定所制得的纯碱中碳酸钠(杂质为NaCl)的含量,预计实验中需要消耗480 mL 1 mol·L 稀盐酸。
稀盐酸。
①实验室用36.5%的浓盐酸(密度为1.2g·cm )配制上述所需稀盐酸。
)配制上述所需稀盐酸。
a.上述浓盐酸的物质的量浓度为___________ mol·L 实验中,需要量取浓盐酸的体积为
实验中,需要量取浓盐酸的体积为___________ (保留一位小数)mL。
b.配制稀盐酸需要用到的仪器有量筒、烧杯、玻璃棒,还缺少的玻璃仪器有___________ (填仪器名称)。
②若实验过程中遇到下列情况,导致所配溶液物质的量浓度偏低的是___________ (填标号)。
A.定容时俯视刻度线读数
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
③产品分析:把5.8 g 溶于足量稀硫酸,生成2.2g
溶于足量稀硫酸,生成2.2g  ,产品纯度为
,产品纯度为___________ %(保留小数点后1位)。

 、
、 和
和(2)写出碳酸氢钠在水中电离的电离方程式:
(3)某实验小组欲用稀盐酸测定所制得的纯碱中碳酸钠(杂质为NaCl)的含量,预计实验中需要消耗480 mL 1 mol·L
 稀盐酸。
稀盐酸。①实验室用36.5%的浓盐酸(密度为1.2g·cm
 )配制上述所需稀盐酸。
)配制上述所需稀盐酸。a.上述浓盐酸的物质的量浓度为
 实验中,需要量取浓盐酸的体积为
实验中,需要量取浓盐酸的体积为b.配制稀盐酸需要用到的仪器有量筒、烧杯、玻璃棒,还缺少的玻璃仪器有
②若实验过程中遇到下列情况,导致所配溶液物质的量浓度偏低的是
A.定容时俯视刻度线读数
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
③产品分析:把5.8 g
 溶于足量稀硫酸,生成2.2g
溶于足量稀硫酸,生成2.2g  ,产品纯度为
,产品纯度为
您最近一年使用:0次
8 . “双碳”背景下,实现CO2的转化与利用对人类社会发展具有重要意义。
I.CO2可与H2作用生产甲醇燃料,涉及反应如下:
反应①:

反应②: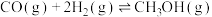

反应③:
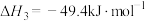
(1)计算可知反应②的
___________ 。
(2)为同时提高反应体系中CO2的平衡转化率和CH3OH的平衡产率,除降低温度外,还可采取的措施有___________ (写出一条即可)。
(3)将CO2和H2按一定比例通入装有催化剂的反应器,持续反应24小时,测得体系中的甲醇产率与催化剂活性、温度间关系如图1所示。其中X点___________ (填“是”“不是”或者“无法确定”)处于平衡状态。体系在310℃后甲醇的产率下降,原因是___________ 。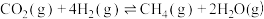 。在2L的恒容密闭容器中,充入2mol CO2和8mol H2,测得体系温度对CO2平衡转化率(%)和催化剂催化效率的影响如图2所示。
。在2L的恒容密闭容器中,充入2mol CO2和8mol H2,测得体系温度对CO2平衡转化率(%)和催化剂催化效率的影响如图2所示。
(5)Kp为气体的平衡分压替代气体的平衡浓度时所表示的化学平衡常数,已知气体的分压=气体的总压×气体体积分数。若Q点时反应体系的总压强为1MPa,则此温度下该反应的平衡常数Kp=___________ MPa-2
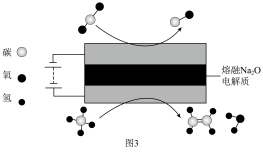
(6)科学家设计电化学装置实现了CO2与CH4分子的耦合转化,原理如图3所示,则阳极的电极反应式为___________ 。
I.CO2可与H2作用生产甲醇燃料,涉及反应如下:
反应①:


反应②:
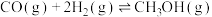

反应③:

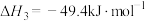
(1)计算可知反应②的

(2)为同时提高反应体系中CO2的平衡转化率和CH3OH的平衡产率,除降低温度外,还可采取的措施有
(3)将CO2和H2按一定比例通入装有催化剂的反应器,持续反应24小时,测得体系中的甲醇产率与催化剂活性、温度间关系如图1所示。其中X点
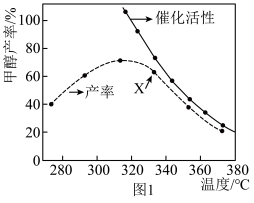
 。在2L的恒容密闭容器中,充入2mol CO2和8mol H2,测得体系温度对CO2平衡转化率(%)和催化剂催化效率的影响如图2所示。
。在2L的恒容密闭容器中,充入2mol CO2和8mol H2,测得体系温度对CO2平衡转化率(%)和催化剂催化效率的影响如图2所示。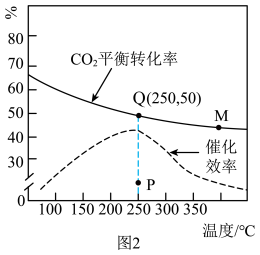
| A.平衡常数大小:KM<KQ |
| B.若体系压强或混合气体密度保持不变,均可说明反应已达平衡状态 |
C.其他条件不变时,加入合适的催化剂,可以降低该反应的活化能和 |
| D.其他条件不变时,若不使用催化剂,则250℃时CO2的平衡转化率可能位于P点 |
(5)Kp为气体的平衡分压替代气体的平衡浓度时所表示的化学平衡常数,已知气体的分压=气体的总压×气体体积分数。若Q点时反应体系的总压强为1MPa,则此温度下该反应的平衡常数Kp=
(6)科学家设计电化学装置实现了CO2与CH4分子的耦合转化,原理如图3所示,则阳极的电极反应式为
您最近一年使用:0次
9 . 镓(Ga)与铝同主族,其单质及其化合物具有广泛的工业应用。回答下列问题:
(1)基态Ga原子的价层电子排布式是___________ 。
(2)镓的卤化物都有较高的催化活性,可用于聚合和脱水等工艺。查得:
① 的熔点高于
的熔点高于 ,却远低于
,却远低于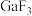 ,原因是
,原因是___________ 。
② 气态时常以:二聚体形式存在,二聚体中各原子均满足
气态时常以:二聚体形式存在,二聚体中各原子均满足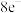 结构,则Ga与Cl之间存在的化学键有
结构,则Ga与Cl之间存在的化学键有___________ (填字母)。
A.极性键 B.氢键 C.配位键 D.离子键 E.金属键
(3)已知氮族元素砷(As)与镓同周期,下列说法不正确的是___________。
(4)砷化镓是一种重要的半导体材料,其晶胞结构如图所示,则化学式为___________ 。若设该晶体的密度为 ,晶胞的边长为a pm,阿伏加德罗常数的值为
,晶胞的边长为a pm,阿伏加德罗常数的值为 ,则
,则
___________ (列出相应计算式)。
(1)基态Ga原子的价层电子排布式是
(2)镓的卤化物都有较高的催化活性,可用于聚合和脱水等工艺。查得:
| 物质 |  |  | 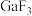 |
| 熔点/℃ | 124 | 78 | 1000 |
 的熔点高于
的熔点高于 ,却远低于
,却远低于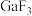 ,原因是
,原因是②
 气态时常以:二聚体形式存在,二聚体中各原子均满足
气态时常以:二聚体形式存在,二聚体中各原子均满足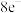 结构,则Ga与Cl之间存在的化学键有
结构,则Ga与Cl之间存在的化学键有A.极性键 B.氢键 C.配位键 D.离子键 E.金属键
(3)已知氮族元素砷(As)与镓同周期,下列说法不正确的是___________。
A.能量最低的激发态Ga原子的轨道表示式:[Ar]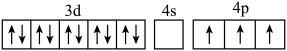 |
| B.化合物中共价键成分的百分数:Al2O3<Ga2O3 |
C.第一电离能: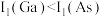 |
D.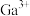 与过量氨水反应的离子反应方程式: 与过量氨水反应的离子反应方程式: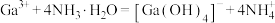 |
(4)砷化镓是一种重要的半导体材料,其晶胞结构如图所示,则化学式为
 ,晶胞的边长为a pm,阿伏加德罗常数的值为
,晶胞的边长为a pm,阿伏加德罗常数的值为 ,则
,则
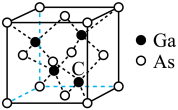
您最近一年使用:0次
名校
10 . 扁桃酸又称为苦杏仁酸,其广泛应用于有机合成和医药工业。由甲苯制备G(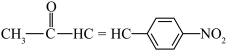 ),合成扁桃酸和化合物合成线路如下(部分产物、反应条件已略去):
),合成扁桃酸和化合物合成线路如下(部分产物、反应条件已略去):
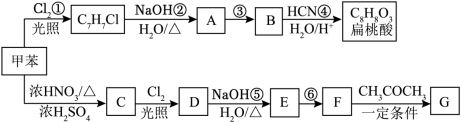
已知:I.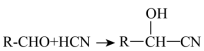
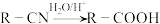
III.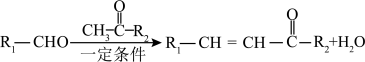
(2)扁桃酸的结构简式为
(3)写出反应②的化学方程式
(4)写出B与银氨溶液反应的化学方程式:
(5)化合物X是比扁桃酸多1个碳原子的扁桃酸的同系物,且苯环上也只有1个取代基。则满足条件的X有
(6)参照上述合成路线,设计以C6H5CH2Cl和CH3CHO为原料合成肉桂醛(
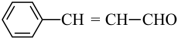 )的路线流程图
)的路线流程图提示:①合成过程中无机试剂任选;
②合成路线流程图示例如下: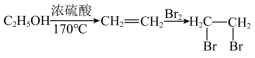
您最近一年使用:0次



