解题方法
1 . 某合金废料主要含铁、铜、铝,为从合金废料中得到Fe2O3、Al2O3和金属Cu等产品,某化学兴趣小组按如图所示工艺流程进行实验(杂质不与稀硫酸反应)。(提示:Al3++4OH-=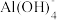 )
)

请回答下列问题:
(1)固体A主要含有的物质是___________ 。
(2)B到C发生反应的离子方程式为_______ ,溶液C中的阳离子主要有__________ 。
(3)若D为NaOH,则溶液E中铝元素的存在形式是___________ (填化学式)。
(4)灼烧沉淀F时所用主要仪器之一是___________(填字母)。
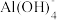 )
)
请回答下列问题:
(1)固体A主要含有的物质是
(2)B到C发生反应的离子方程式为
(3)若D为NaOH,则溶液E中铝元素的存在形式是
(4)灼烧沉淀F时所用主要仪器之一是___________(填字母)。
| A.蒸发皿 | B.烧杯 | C.坩埚 | D.试管 |
您最近一年使用:0次
解题方法
2 . A、B、D、E、F、G为短周期元素,且原子序数依次递增。A、F同主族,E、G同主族。A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,且F+与E2-的核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。请回答以下问题:
(1)F位于第___________ 周期第___________ 族。D元素的名称为___________ 。
(2)G的离子结构示意图为___________ 。
(3)由A、E、F三种元素形成的化合物的化学式为___________ ,含有的化学键有___________ (填化学键类型),属于___________ 化合物。
(1)F位于第
(2)G的离子结构示意图为
(3)由A、E、F三种元素形成的化合物的化学式为
您最近一年使用:0次
解题方法
3 . 下列编号代表元素周期表中的一部分元素,用化学用语回答下列问题:

(1)碳元素在周期表中的位置为________ ,它的最高价氧化物的电子式为_________ 。
(2)①④形成的化合物的化学键类型为___________ ,③⑧形成的化合物的电子式为___________ ,④形成的单质的结构式为___________ 。
(3)②⑥的最高价氧化物的水化物发生反应的离子方程式为___________ 。
(4)⑧⑨简单氢化物的稳定性较强的是___________ (写简单氢化物的化学式),⑤单质的氧化性比⑦的强,请从原子结构的角度解释其原因:___________ 。
(5)写出能证明②的金属性强于③的化学事实___________ (任写一条)。

(1)碳元素在周期表中的位置为
(2)①④形成的化合物的化学键类型为
(3)②⑥的最高价氧化物的水化物发生反应的离子方程式为
(4)⑧⑨简单氢化物的稳定性较强的是
(5)写出能证明②的金属性强于③的化学事实
您最近一年使用:0次
4 . 下列实验装置可用于实验室制备少量无水FeCl3,已知FeCl3遇水会强烈反应。

(1)为达到实验目的,各装置的正确连接顺序是:a→________→________→________→________→h→i→c→b→g→f(填接口的字母,箭头的方向即气流的方向,部分装置可重复使用)。_____ 。
(2)请写出装置⑤圆底烧瓶中制备氯气的离子方程式_______________________ 。
(3)装置②的目的除了降低Cl2在溶液中的溶解度外,还有_______________________ 。
(4)请写出④制备FeCl3的化学方程式______________ 。
(5)本实验装置④⑤两处均有酒精灯,实验开始前应先点燃________ (填装置序号)处酒精灯,后点燃________ (填装置序号)处酒精灯。

(1)为达到实验目的,各装置的正确连接顺序是:a→________→________→________→________→h→i→c→b→g→f(填接口的字母,箭头的方向即气流的方向,部分装置可重复使用)。
(2)请写出装置⑤圆底烧瓶中制备氯气的离子方程式
(3)装置②的目的除了降低Cl2在溶液中的溶解度外,还有
(4)请写出④制备FeCl3的化学方程式
(5)本实验装置④⑤两处均有酒精灯,实验开始前应先点燃
您最近一年使用:0次
5 . 高铁酸钾(K2FeO4)为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,可用于饮用水处理。实验室中可通过如图方法制备K2FeO4。
回答下列问题:
Ⅰ.制备KClO:
(1)仪器a的名称为________ ;装置B中试剂的名称是________ ;装置B的作用是___ 。
(2)装置C中Cl2与KOH反应的离子方程式为____________ 。
(3)若无装置D,可能产生的危害是_______ 。
Ⅱ.制备K2FeO4:
(4)待装置C中得到足量KClO后,将三口烧瓶上的导管取下,依次加入适量KOH溶液、Fe(NO3)3溶液并搅拌,控制水浴温度为25°C,充分反应得到含有KCl和KNO3的紫色溶液,反应的离子方程式为______ 。

回答下列问题:
Ⅰ.制备KClO:
(1)仪器a的名称为
(2)装置C中Cl2与KOH反应的离子方程式为
(3)若无装置D,可能产生的危害是
Ⅱ.制备K2FeO4:
(4)待装置C中得到足量KClO后,将三口烧瓶上的导管取下,依次加入适量KOH溶液、Fe(NO3)3溶液并搅拌,控制水浴温度为25°C,充分反应得到含有KCl和KNO3的紫色溶液,反应的离子方程式为
您最近一年使用:0次
解题方法
6 . 下表为元素周期表的一部分。
(1)表中元素_____ (写元素符号,下同)的非金属性最强;元素_____ 的金属性最强;元素_____ 的单质在室温下呈液态。
(2)表中元素③的原子结构示意图是_____ 。
(3)表中元素⑤⑥氢化物的稳定性顺序为_____ >_____ (填写化学式)。
(4)表中元素最高价氧化物对应水化物的酸性最强的化学式是_____ ;碱性最强的化学式是_____ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | |||||||
| 2 | ② | ⑤ | |||||
| 3 | ③ | ⑥ | |||||
| 4 | ④ | ⑦ | |||||
(2)表中元素③的原子结构示意图是
(3)表中元素⑤⑥氢化物的稳定性顺序为
(4)表中元素最高价氧化物对应水化物的酸性最强的化学式是
您最近一年使用:0次
解题方法
7 . 某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。氧化性强弱探究:
【分析与解释】
(1)实验Ⅰ中a试管中反应的离子方程式是_____ 。
(2)①甲同学认为:实验Ⅱ观察到_____ 现象,得出氧化性:Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性:Br2>I2;他补做了实验Ⅲ。补做实验Ⅲ的目的是_____ 。
【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。氧化性强弱探究:
| 实验Ⅰ |  |
| 实验Ⅱ | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
| 实验Ⅲ | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
(1)实验Ⅰ中a试管中反应的离子方程式是
(2)①甲同学认为:实验Ⅱ观察到
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性:Br2>I2;他补做了实验Ⅲ。补做实验Ⅲ的目的是
您最近一年使用:0次
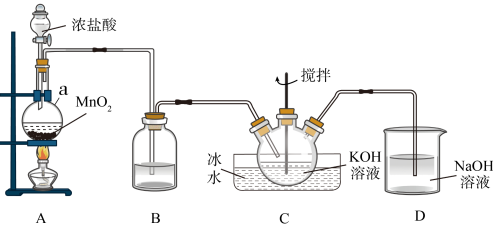
8 . 无水氯化铁呈黑棕色,易潮解,100 ℃左右时升华,冷却后易凝华。如图是两名学生设计的用氯气与铁反应制备无水氯化铁的实验装置图。左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
(1)A仪器的名称是___________ 。
(2)B中反应的离子方程式为___________ 。
(3)气体通过装置C的目的是___________ 。
(4)D中的反应开始前,需进行的操作是___________ ,应采取的方法是___________ 。
(5)D中发生反应的化学方程式:___________ 。
(6)装置(Ⅰ)的主要缺点:___________ 。
(7)装置(Ⅱ)F中发生反应的化学方程式为___________ 。如果选用(Ⅱ)装置来完成实验,则必须采取的改进措施是___________ 。

(1)A仪器的名称是
(2)B中反应的离子方程式为
(3)气体通过装置C的目的是
(4)D中的反应开始前,需进行的操作是
(5)D中发生反应的化学方程式:
(6)装置(Ⅰ)的主要缺点:
(7)装置(Ⅱ)F中发生反应的化学方程式为
您最近一年使用:0次
解题方法
9 . 现有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在元素周期表中的位置如图所示。E的单质可与酸反应,1 mol E的单质与足量酸作用,在标准状况下能产生33.6 L H2;E的阳离子与A的阴离子核外电子层结构相同。
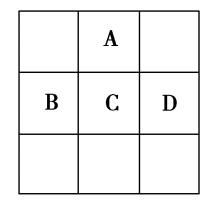
回答下列问题:
(1)写出下列元素的名称:A___________ ,C___________ ,E___________ 。
(2)A离子的结构示意图为___________ 。
(3)B单质在A单质中燃烧,生成物的化学式为___________ 。
(4)A与E形成的化合物的化学式为___________ ,它的性质决定了它在物质的分类中属于___________ 。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至无明显现象,此过程中观察到的现象是___________ 。

回答下列问题:
(1)写出下列元素的名称:A
(2)A离子的结构示意图为
(3)B单质在A单质中燃烧,生成物的化学式为
(4)A与E形成的化合物的化学式为
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至无明显现象,此过程中观察到的现象是
您最近一年使用:0次
10 . 某化学小组甲同学学习了酸、碱、盐化学性质后展开了如下探究活动:
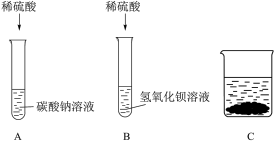
(1)B试管中发生反应的离子方程式为____________________ 。
(2)【实验一】A、B试管中物质分别充分反应后,先将B试管中所有物质倒入空烧杯C中,再将A试管中所得溶液慢慢滴加到C烧杯中,烧杯内固体质量随A试管中加入液体质量变化如图所示;

据此判断B试管中反应后所得溶液中的溶质是___________ (填化学式)。
(3)【实验二】将C烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,观察到___________ 的实验现象,进而证明滤渣为混合物;
(4)【猜想与假设】实验二C烧杯的滤液中含有哪些离子?
猜想一:Na+、Ba2+、OH-
猜想二:Na+、H+、CO
猜想三:Na+、OH-、CO
猜想四:Na+、OH-、SO
猜想五:___________ (写出一种即可);
小组同学一致认为猜想___________ 不正确,理由是___________________ 。

(1)B试管中发生反应的离子方程式为
(2)【实验一】A、B试管中物质分别充分反应后,先将B试管中所有物质倒入空烧杯C中,再将A试管中所得溶液慢慢滴加到C烧杯中,烧杯内固体质量随A试管中加入液体质量变化如图所示;

据此判断B试管中反应后所得溶液中的溶质是
(3)【实验二】将C烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,观察到
(4)【猜想与假设】实验二C烧杯的滤液中含有哪些离子?
猜想一:Na+、Ba2+、OH-
猜想二:Na+、H+、CO

猜想三:Na+、OH-、CO

猜想四:Na+、OH-、SO

猜想五:
小组同学一致认为猜想
您最近一年使用:0次



