名校
解题方法
1 . 利用废旧白铁皮(含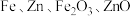 )制备磁性
)制备磁性 胶体流程如图:
胶体流程如图:
②在水溶液中 能与
能与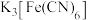 反应生成蓝色沉淀
反应生成蓝色沉淀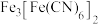 。
。
(1)“碱溶”的目的是去除油污以及溶解镀锌层,写出 溶液与
溶液与 反应的离子方程式
反应的离子方程式___________ 。
(2)部分氧化阶段, 被
被 还原为
还原为 ,该反应的离子方程式是
,该反应的离子方程式是___________ 。
(3)经测定溶液B中 的物质的量之比是
的物质的量之比是 。检验其中
。检验其中 可选用试剂是___________(填字母)。
可选用试剂是___________(填字母)。
(4)用___________ 效应可以确定溶液B中是否产生了 胶体。
胶体。
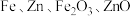 )制备磁性
)制备磁性 胶体流程如图:
胶体流程如图: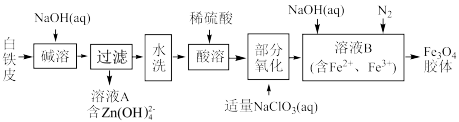
②在水溶液中
 能与
能与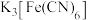 反应生成蓝色沉淀
反应生成蓝色沉淀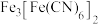 。
。(1)“碱溶”的目的是去除油污以及溶解镀锌层,写出
 溶液与
溶液与 反应的离子方程式
反应的离子方程式(2)部分氧化阶段,
 被
被 还原为
还原为 ,该反应的离子方程式是
,该反应的离子方程式是(3)经测定溶液B中
 的物质的量之比是
的物质的量之比是 。检验其中
。检验其中 可选用试剂是___________(填字母)。
可选用试剂是___________(填字母)。A. 溶液 溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D.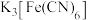 溶液 溶液 |
(4)用
 胶体。
胶体。
您最近一年使用:0次
2024-08-12更新
|
235次组卷
|
5卷引用:第三章 铁 金属材料【单元测试A卷】
2 . 某校化学小组探究酸性KMnO4溶液与H2O2溶液反应速率的影响因素。
(1)邹邹进行了实验I:常温下,向4mL不同浓度的H2O2溶液中滴入一滴0.04mL0.05mol/LKMnO4溶液[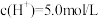 ],记录如下:
],记录如下:
①请写出反应的离子方程式_______ 。
②对于c(H2O2)增大引起的速率异常现象,根据上述实验结果,伟伟排除了一种可能,请用化学方程式表示这种可能性_______ 。
③为了解释c(H2O2)增大到一定浓度后速率减小,波波查得了如下资料:
资料显示: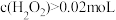 ,H2O2溶液中存在平衡:
,H2O2溶液中存在平衡: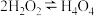
请用平衡移动原理解释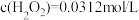 速率忽然减小的原因
速率忽然减小的原因_______ 。
(2)龙龙继续进行实验II,并记录如下:
①对于第10滴溶液与H2O2溶液反应速率剧烈变化的原因,飞飞提出如下假设:_______ 。
②杰杰设计实验方案证实了上述假设合理,请补全他的方案:
现象:完全褪色时间为t秒
_______ 。
(3)综合上述实验,对于酸性KMnO4溶液与H2O2溶液反应速率,臧臧进行了总结。下列因素一定能加快反应速率的是_______ 。
a.增大KMnO4溶液浓度b.增大H2O2溶液浓度c.增大H2SO4浓度
d.加热适当温度e.加入合适的催化剂
(1)邹邹进行了实验I:常温下,向4mL不同浓度的H2O2溶液中滴入一滴0.04mL0.05mol/LKMnO4溶液[
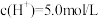 ],记录如下:
],记录如下:| c(H2O2)/mol/L | 0.0010 | 0.0015 | 0.0125 | 0.0312 | 0.044 | 0.0620 |
| 完全褪色时间/s | 25 | 15 | 12 | 23 | 60 | 370 |
| 无色气泡 | 一样多 | |||||
②对于c(H2O2)增大引起的速率异常现象,根据上述实验结果,伟伟排除了一种可能,请用化学方程式表示这种可能性
③为了解释c(H2O2)增大到一定浓度后速率减小,波波查得了如下资料:
资料显示:
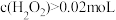 ,H2O2溶液中存在平衡:
,H2O2溶液中存在平衡: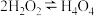
请用平衡移动原理解释
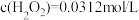 速率忽然减小的原因
速率忽然减小的原因(2)龙龙继续进行实验II,并记录如下:
| 操作 | 现象 | |
| 实验Ⅱ |
| 第1-9滴溶液滴下,完全褪色所需时间很长;第10滴溶液滴下迅速褪色。整个过程中几乎无温度变化。 |
②杰杰设计实验方案证实了上述假设合理,请补全他的方案:

现象:完全褪色时间为t秒
(3)综合上述实验,对于酸性KMnO4溶液与H2O2溶液反应速率,臧臧进行了总结。下列因素一定能加快反应速率的是
a.增大KMnO4溶液浓度b.增大H2O2溶液浓度c.增大H2SO4浓度
d.加热适当温度e.加入合适的催化剂
您最近一年使用:0次
解题方法
3 . 将CO2还原成甲烷,是实现CO2资源化利用的有效途径之一。
I.CO2甲烷化
CO2甲烷化过程可能发生反应:
ⅰ.CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH1
ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ∙mol−1
ⅲ.CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH3=-206.1kJ∙mol−1
……
(1)ΔH1=_______ kJ∙mol−1。
Ⅱ.微生物电化学法
微生物电化学产甲烷法是将电化学法和生物还原法有机结合,装置如图所示。_______ 。
(3)若生成1 mol CH4,理论上阳极室生成CO2的体积是_____ L(标准状况,忽略气体的溶解)。
I.CO2甲烷化
CO2甲烷化过程可能发生反应:
ⅰ.CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH1
ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ∙mol−1
ⅲ.CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH3=-206.1kJ∙mol−1
……
(1)ΔH1=
Ⅱ.微生物电化学法
微生物电化学产甲烷法是将电化学法和生物还原法有机结合,装置如图所示。

(3)若生成1 mol CH4,理论上阳极室生成CO2的体积是
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
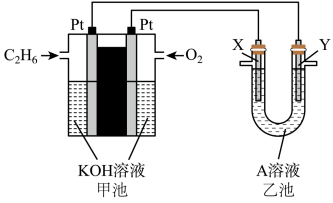
4 . 电化学在化学工业中有着广泛应用。
(1)根据图示电化学装置,回答下列问题:____________ 。
②乙池中,若X、Y都是石墨,A是Na2SO4溶液,实验开始时,同时在两极附近溶液中各滴入几滴紫色石蕊溶液,X极的电极反应式为___________ ;一段时间后,在Y极附近观察到的现象是__________ 。
③乙池中,若X、Y都是石墨,A是足量AgNO3溶液,体积为0.2 L,则Y极的电极反应式为_________ ;电解一段时间后,甲池消耗112 mL O2(标准状况下),则乙池溶液的pH为____ (忽略溶液体积的变化)。
(2)若要用该装置在铁质钥匙表面镀一层金属铜,CuSO4溶液作电解液,则乙池中:
①X极的材料是____ ,电极反应式为____________ 。
②Y极的材料是____ ,电极反应式为__________ 。
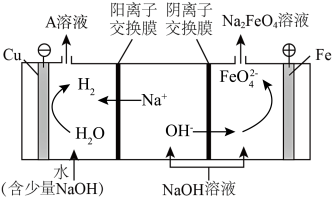
(3)工业上通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,则阳极的电极反应式为____________ ,阴极反应式为___________ 。
(1)根据图示电化学装置,回答下列问题:
②乙池中,若X、Y都是石墨,A是Na2SO4溶液,实验开始时,同时在两极附近溶液中各滴入几滴紫色石蕊溶液,X极的电极反应式为
③乙池中,若X、Y都是石墨,A是足量AgNO3溶液,体积为0.2 L,则Y极的电极反应式为
(2)若要用该装置在铁质钥匙表面镀一层金属铜,CuSO4溶液作电解液,则乙池中:
①X极的材料是
②Y极的材料是
(3)工业上通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,则阳极的电极反应式为
您最近一年使用:0次
24-25高三上·全国·课前预习
解题方法
5 . A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)
(1)D的化学式为___________ 。
(2)反应③的离子方程式为___________ 。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为___________ 。
(4)0.1 mol·L-1的X溶液和0.1 mol·L-1的Y溶液等体积混合,溶液呈___________ 性(填“酸”“碱”或“中”),原因是___________ (用离子方程式说明)。
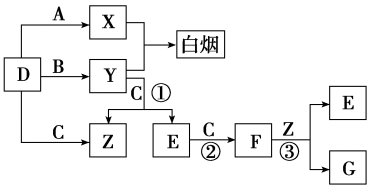
(1)D的化学式为
(2)反应③的离子方程式为
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为
(4)0.1 mol·L-1的X溶液和0.1 mol·L-1的Y溶液等体积混合,溶液呈
您最近一年使用:0次
23-24高一·全国·假期作业
6 . 金属单质A可发生以下反应。试推断:
A____________ 、B____________ 、C_____________ 、D____________ 、E__________ 。
(2)写出反应③和⑤的离子方程式:
③______________ ;
⑤_____________ 。
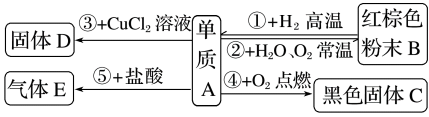
A
(2)写出反应③和⑤的离子方程式:
③
⑤
您最近一年使用:0次
7 . 二氧化锰与浓盐酸混合加热可得到氯气,如图是制取氯气并探究化学性质的装置图。___________ 。
(2)若要得到纯净干燥的气体,则装置B盛放的试剂是___________ ;作用是___________ ;装置C盛放的试剂是___________ ;作用是___________ 。
(3)E中若装有淀粉碘化钾溶液,能观察到的实验现象是:___________ 。
(4)氯气可用___________ 法收集,请说明理由:___________ 。
(5)F装置的作用是___________ ;
(6)G中发生的化学反应方程式为:___________ 。
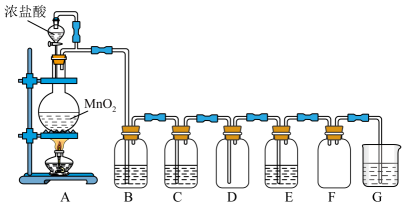
(2)若要得到纯净干燥的气体,则装置B盛放的试剂是
(3)E中若装有淀粉碘化钾溶液,能观察到的实验现象是:
(4)氯气可用
(5)F装置的作用是
(6)G中发生的化学反应方程式为:
您最近一年使用:0次
2024-06-20更新
|
184次组卷
|
3卷引用:第二章 海水中的重要元素——钠和氯【单元测试A卷】
真题
解题方法
8 . 已知: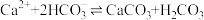
①
②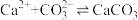
③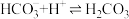
(1)以下能判断总反应达到平衡状态的是_______。
(2) 增大有利于珊瑚的形成,请解释原因
增大有利于珊瑚的形成,请解释原因_______ 。
(3)已知 的
的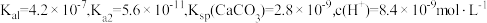 ,
,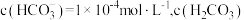 为
为_______ 。当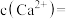
_______  时,开始产生
时,开始产生 沉淀。
沉淀。
(4)根据如图,写出电极a的电极反应式_______ 。
(6)解释在溶液中氧气的浓度变大后,为何有利于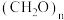 的除去,但不利于硝酸根的除去。
的除去,但不利于硝酸根的除去。_______ 。
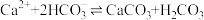
①

②
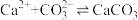
③
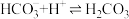
(1)以下能判断总反应达到平衡状态的是_______。
| A.钙离子浓度保持不变 | B. 保持不变 保持不变 |
C.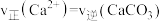 | D.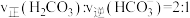 |
(2)
 增大有利于珊瑚的形成,请解释原因
增大有利于珊瑚的形成,请解释原因(3)已知
 的
的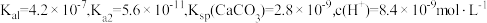 ,
,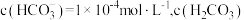 为
为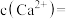
 时,开始产生
时,开始产生 沉淀。
沉淀。(4)根据如图,写出电极a的电极反应式
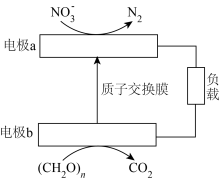
| A.该装置实现电能转化为化学能 |
| B.电极b是负极 |
| C.电子从电极a经过负载到电极b再经过水体回到电极a |
D.每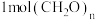 参与反应时,转移 参与反应时,转移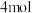 电子 电子 |
(6)解释在溶液中氧气的浓度变大后,为何有利于
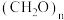 的除去,但不利于硝酸根的除去。
的除去,但不利于硝酸根的除去。
您最近一年使用:0次
2024-06-11更新
|
2321次组卷
|
7卷引用:第三章 水溶液中的离子反应与平衡【单元测试A卷】
第三章 水溶液中的离子反应与平衡【单元测试A卷】2024年上海市等级考化学试题(已下线)09化学反应原理综合(已下线)一、氟及其化合物(已下线)五、珊瑚的形成与保护(已下线)暑假作业15 突破化学反应原理综合题-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)(已下线)暑假作业13 理解原电池 新型电池-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)
名校
9 . 硫酸亚铁是重要的化工原料
Ⅰ.
(1)由 溶液制备硫酸亚铁晶体的方法是
溶液制备硫酸亚铁晶体的方法是___________ 。检验晶体中 是否完全变质,将晶体溶于水,加
是否完全变质,将晶体溶于水,加___________ (填试剂)。
(2) 溶液与过量的
溶液与过量的 溶液混合,可以得到含
溶液混合,可以得到含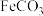 的浊液,离子方程式是
的浊液,离子方程式是___________ 。
Ⅱ.氧化铁黄(FeOOH)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。以 为原料制备FeOOH的流程如下:
为原料制备FeOOH的流程如下:
(3)若在实验室完成上述制备,不需要使用的仪器是___________ 。 时段,pH快速下降的原因是反应生成了FeOOH和
时段,pH快速下降的原因是反应生成了FeOOH和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
② 时段,经历的反应为
时段,经历的反应为 ,该过程pH继续平缓下降的原因可能是
,该过程pH继续平缓下降的原因可能是___________ 。
(5)判断流程中产品洗涤干净的方法是___________ 。
(6)氧化铁黄(FeOOH)纯度可以通过产品的耗酸量确定,如下图所示。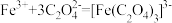 ,
,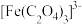 不与稀碱液反应。
不与稀碱液反应。
①在溶液c中滴加NaOH标准溶液,使用的指示剂为___________ 。
②若实验时加入了 的
的 ,消耗
,消耗 ,设氧化铁黄的摩尔质量为
,设氧化铁黄的摩尔质量为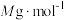 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为___________ (用含w、 、
、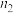 、M的代数式表示)。
、M的代数式表示)。
③测定时,若滴入 不足量,会使实验结果
不足量,会使实验结果___________ (选填“偏大”“偏小”或“无影响”)。
Ⅰ.
(1)由
 溶液制备硫酸亚铁晶体的方法是
溶液制备硫酸亚铁晶体的方法是 是否完全变质,将晶体溶于水,加
是否完全变质,将晶体溶于水,加(2)
 溶液与过量的
溶液与过量的 溶液混合,可以得到含
溶液混合,可以得到含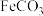 的浊液,离子方程式是
的浊液,离子方程式是Ⅱ.氧化铁黄(FeOOH)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。以
 为原料制备FeOOH的流程如下:
为原料制备FeOOH的流程如下: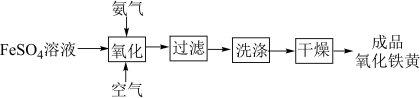
(3)若在实验室完成上述制备,不需要使用的仪器是
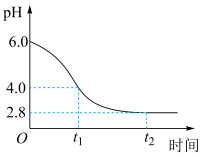
 时段,pH快速下降的原因是反应生成了FeOOH和
时段,pH快速下降的原因是反应生成了FeOOH和 ,该反应的化学方程式为
,该反应的化学方程式为②
 时段,经历的反应为
时段,经历的反应为 ,该过程pH继续平缓下降的原因可能是
,该过程pH继续平缓下降的原因可能是(5)判断流程中产品洗涤干净的方法是
(6)氧化铁黄(FeOOH)纯度可以通过产品的耗酸量确定,如下图所示。
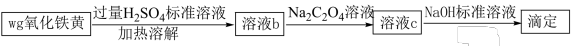
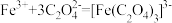 ,
,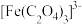 不与稀碱液反应。
不与稀碱液反应。①在溶液c中滴加NaOH标准溶液,使用的指示剂为
②若实验时加入了
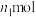 的
的 ,消耗
,消耗 ,设氧化铁黄的摩尔质量为
,设氧化铁黄的摩尔质量为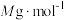 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为 、
、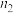 、M的代数式表示)。
、M的代数式表示)。③测定时,若滴入
 不足量,会使实验结果
不足量,会使实验结果
您最近一年使用:0次
2024-06-10更新
|
398次组卷
|
4卷引用:第三章 水溶液中的离子反应与平衡【单元测试B卷】
第三章 水溶液中的离子反应与平衡【单元测试B卷】2024届天津市天津市河西区天津市第四中学模拟预测化学试题(已下线)第三章 金属及其化合物(测试)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)(已下线)专题突破卷03 金属及其化合物-2025年高考化学一轮复习考点通关卷(新教材新高考)
名校
10 . 氨气是重要的化工原料,其制备与热力学研究在化工生产中十分重要。
(1)实验室用熟石灰和氯化铵为原料制备氨气,其化学方程式为___________ 。
(2)从制备到干燥、收集 并处理尾气所需装置的接口连接顺序是
并处理尾气所需装置的接口连接顺序是___________ 。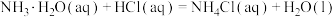 的焓变
的焓变 。
。
查阅资料:反应焓变可通过量热计对反应前后温度的变化测定,利用热量变化数值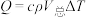 的原理,经换算得到反应的焓变,溶液中的反应可以近似认为
的原理,经换算得到反应的焓变,溶液中的反应可以近似认为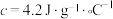 、
、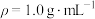 。
。
反应热的测定:取25.0℃下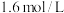 的氨水与
的氨水与 盐酸各
盐酸各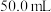 ,在量热计中混合搅拌,三次重复实验测得温度最高点的平均值为33.8℃。
,在量热计中混合搅拌,三次重复实验测得温度最高点的平均值为33.8℃。
①根据测定数据计算反应I的
___________  。
。
②参考上述流程用氢氧化钠与盐酸进行实验,测得反应II: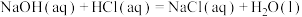 的焓变
的焓变 与
与 有一定差异,其原因是
有一定差异,其原因是___________ (从平衡移动角度作答)。
(4)甲同学欲借鉴(3)的方法测得反应III: 的焓变
的焓变 ,但发现气态反应过程中
,但发现气态反应过程中 、
、 变化大,难以测得准确数值。乙同学则提出在(3)所测数据的基础上,再测得3个过程的焓变即可。实验方案和结果如下:
变化大,难以测得准确数值。乙同学则提出在(3)所测数据的基础上,再测得3个过程的焓变即可。实验方案和结果如下:
①补全b的待测过程___________ 。
②计算反应III的
___________ (列式表示)。
(5)丙同学查阅资料发现,气态反应可通过测定不同温度下的平衡常数,利用以下原理换算得到焓变: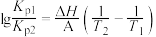
式中A为常数(已知),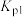 、
、 表示在
表示在 或
或 温度下反应的压强平衡常数。
温度下反应的压强平衡常数。
丙同学根据该原理设计了相关方案,测得了反应III的焓变,该方案是___________ (要求:方案中须写明待测的物理量,可选用仪器、药品:气压计、恒温反应器、温度计、 )。
)。
(1)实验室用熟石灰和氯化铵为原料制备氨气,其化学方程式为
(2)从制备到干燥、收集
 并处理尾气所需装置的接口连接顺序是
并处理尾气所需装置的接口连接顺序是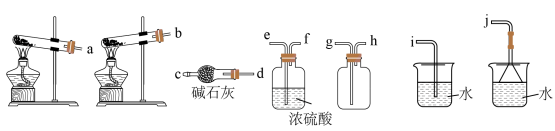
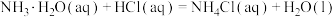 的焓变
的焓变 。
。查阅资料:反应焓变可通过量热计对反应前后温度的变化测定,利用热量变化数值
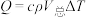 的原理,经换算得到反应的焓变,溶液中的反应可以近似认为
的原理,经换算得到反应的焓变,溶液中的反应可以近似认为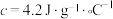 、
、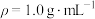 。
。反应热的测定:取25.0℃下
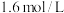 的氨水与
的氨水与 盐酸各
盐酸各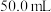 ,在量热计中混合搅拌,三次重复实验测得温度最高点的平均值为33.8℃。
,在量热计中混合搅拌,三次重复实验测得温度最高点的平均值为33.8℃。①根据测定数据计算反应I的

 。
。②参考上述流程用氢氧化钠与盐酸进行实验,测得反应II:
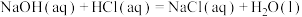 的焓变
的焓变 与
与 有一定差异,其原因是
有一定差异,其原因是(4)甲同学欲借鉴(3)的方法测得反应III:
 的焓变
的焓变 ,但发现气态反应过程中
,但发现气态反应过程中 、
、 变化大,难以测得准确数值。乙同学则提出在(3)所测数据的基础上,再测得3个过程的焓变即可。实验方案和结果如下:
变化大,难以测得准确数值。乙同学则提出在(3)所测数据的基础上,再测得3个过程的焓变即可。实验方案和结果如下:| 实验序号 | 待测过程 | 焓变 |
| a | 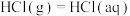 | 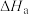 |
| b | 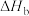 | |
| c |  | 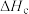 |
②计算反应III的

(5)丙同学查阅资料发现,气态反应可通过测定不同温度下的平衡常数,利用以下原理换算得到焓变:
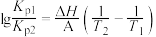
式中A为常数(已知),
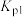 、
、 表示在
表示在 或
或 温度下反应的压强平衡常数。
温度下反应的压强平衡常数。丙同学根据该原理设计了相关方案,测得了反应III的焓变,该方案是
 )。
)。
您最近一年使用:0次
2024-06-06更新
|
478次组卷
|
3卷引用:第一章 化学反应的热效应【单元测试B卷】




