解题方法
1 . 如图为相关物质间的转化关系,其中甲、丙为生活中常见的金属单质,乙、丁为非金属单质且丁为气态,E为白色沉淀,D为浅绿色溶液。请回答:
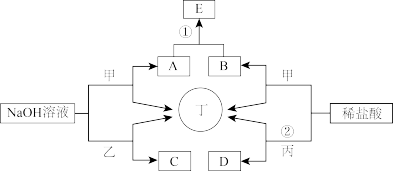
(1)组成甲的元素在元素周期表中的位置为__ ,请列举乙单质的一种用途__ ;用电子式表示丁的形成过程___ 。
(2)在C溶液中滴入2滴酚酞,再逐滴加入稀盐酸至红色消失,可得到一种胶体,该胶体的胶粒成分是__ (化学式);
(3)反应①的离子方程式为__ ;
(4)将B的稀溶液加水稀释,溶液的pH__ (填能或不能)大于7;
(5)若反应②中盐酸过量,向D溶液中滴加84消毒液,溶液的颜色发生了变化,该反应的离子方程式为__ 。

(1)组成甲的元素在元素周期表中的位置为
(2)在C溶液中滴入2滴酚酞,再逐滴加入稀盐酸至红色消失,可得到一种胶体,该胶体的胶粒成分是
(3)反应①的离子方程式为
(4)将B的稀溶液加水稀释,溶液的pH
(5)若反应②中盐酸过量,向D溶液中滴加84消毒液,溶液的颜色发生了变化,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 砷及其化合物被运用在农药、除草剂、杀虫剂与多种合金中,其中三氧化二砷(AS2O3)被称为砒霜,是一 种毒性很强的物质。回答下列问题:
(1)As在元素周期表中的位置是_____________ ,AsH3的电子式_________ 。
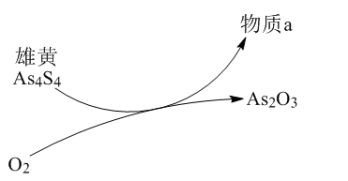
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为_________ (填化学式)。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s) 2As(g) +3CO(g)
2As(g) +3CO(g) 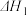 =a kJ· mol-1
=a kJ· mol-1
反应 II.As2O3(g) +3C(s)
 As4(g) +3CO(g)
As4(g) +3CO(g) 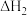 =b kJ ·mol-1
=b kJ ·mol-1
反应III.As4(g) 4As(g)
4As(g) 
①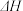 =
=_________ kJ ·mol-1 (用含a,b的代数式表示)。
②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
由表中数据判断催化剂X_______ (填“优于”或“劣于”)催化剂Y。
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应: (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)
 (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
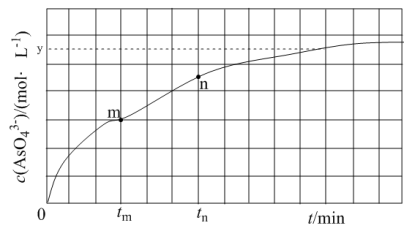
①下列可说明反应达到平衡的是_______ (填标号)。
a.v(I- ) =2v( )
)
b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c( )/c(
)/c( )不再发生变化
)不再发生变化
e.c(Na+) =5xmol· L-1
②tm min时,v正( )
)_______ (填“大于”“小于”或“等于”)v逆(  )。
)。
③tm min时,v逆( )
) _______ (填“大于”“小于”或“等于”)tn时v逆(  ),理由是
),理由是___________________ 。
(1)As在元素周期表中的位置是
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为

(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s)
 2As(g) +3CO(g)
2As(g) +3CO(g) 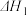 =a kJ· mol-1
=a kJ· mol-1反应 II.As2O3(g) +3C(s)

 As4(g) +3CO(g)
As4(g) +3CO(g) 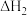 =b kJ ·mol-1
=b kJ ·mol-1反应III.As4(g)
 4As(g)
4As(g) 
①
 =
=②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
| 反应II | 反应III | ||
| 活化能/ (kJ ·mol -1 ) | 催化剂X | 56 | 75 |
| 催化剂Y | 37 | 97 | |
由表中数据判断催化剂X
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应:
 (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)
 (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可说明反应达到平衡的是
a.v(I- ) =2v(
 )
) b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c(
 )/c(
)/c( )不再发生变化
)不再发生变化e.c(Na+) =5xmol· L-1
②tm min时,v正(
 )
) )。
)。③tm min时,v逆(
 )
)  ),理由是
),理由是
您最近一年使用:0次
名校
解题方法
3 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
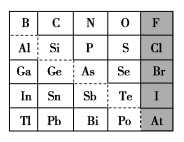
(1)元素 在元素周期表中的位置为第
在元素周期表中的位置为第______ 周期第______ 族。
(2) 的最高化合价为
的最高化合价为______ , 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为______ , 的最高价氧化物为
的最高价氧化物为______ 。
(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是______ 元素(填元素符号)。
②酸性:
______ (填“>”“<”或“=”,下同) 。
。
③氢化物的还原性:
______  。
。
④原子半径:
______  。
。
(4)可在图中分界线(虚线)附近寻找______ (填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较 、
、 的非金属性强弱:
的非金属性强弱:______ 。(可供选择的药品有 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)

(1)元素
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)
 的最高化合价为
的最高化合价为 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为 的最高价氧化物为
的最高价氧化物为(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是
②酸性:

 。
。③氢化物的还原性:

 。
。④原子半径:

 。
。(4)可在图中分界线(虚线)附近寻找
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较
 、
、 的非金属性强弱:
的非金属性强弱: 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)
您最近一年使用:0次
2020-09-08更新
|
1584次组卷
|
6卷引用:人教版(2019)高一必修第一册 全书综合训练(一)
4 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系,下图是元素周期表的一部分, 回答下列问题:
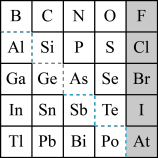
(1)元素Ga在元素周期表中的位置为:________ ;
(2)Sn的最高正价为_______ ,Cl的最高价氧化物对应水化物的化学式为______ ;
(3)根据元素周期律,推断:
①阴影部分元素形成的氢化物中热稳定性最高的是_____ ;(写化学式)
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4_______ H2SeO4 (填“>”、“<”、“=”或“无法比较”);
③氢化物的还原性:H2O_______ H2S (填“>”、“<”、“=”或“无法比较”);
④原子半径比较: N______ Si (填“>”、“<”、“=”或“无法比较”);
(4)可在图中分界线(虚线部分)附近寻找_______ (填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药

(1)元素Ga在元素周期表中的位置为:
(2)Sn的最高正价为
(3)根据元素周期律,推断:
①阴影部分元素形成的氢化物中热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4
③氢化物的还原性:H2O
④原子半径比较: N
(4)可在图中分界线(虚线部分)附近寻找
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
您最近一年使用:0次
解题方法
5 . 随原子序数的递增,五种短周期元素原子半径与原子序数的关系如图所示:
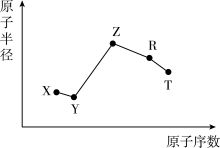
已知:TX2是现代光学及光纤制品的基本原料:ZY能破坏水的电离平衡:Z3RY6在工业上常用作助熔剂。下列说法不正确的是

已知:TX2是现代光学及光纤制品的基本原料:ZY能破坏水的电离平衡:Z3RY6在工业上常用作助熔剂。下列说法不正确的是
| A.R在元素周期表中的位置是第三周期第ⅢA族 |
B.上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的电子式为 或 或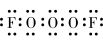 |
| C.工业上以Z3RY6作助熔剂的目的是降低氧化铝沸点,节约冶炼铝的原料 |
| D.已知11.5 g Z的单质在X2中完全燃烧,恢复至室温,放出Q kJ热量,该反应的热化学方程式为2Na(s)+O2(g)=Na2O2(s)△H=-4Q kJ/mol |
您最近一年使用:0次
名校
6 . A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大。A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一。请用化学用语回答下列问题:
(1)F在元素周期表中的位置为_________ 。
(2)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为______________ 。
(3)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色,H的电子式为_________ 。写出在空气中长期放置生成H的化学反应方程式为:____________ 。H的溶液与稀硫酸反应产生的现象为_________________ 。
(4)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol 熔融A4B4电离生成两种离子各1mol,则该物质熔融时的电离方程式为______________ 。
(5)B2A4 常用做火箭推进的燃料,写出负极的电极反应:_____________ 。
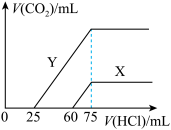
(6)向30mL某浓度由A、B、C、D中三种元素形成的一元强碱溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。则曲线Y表明M中的溶质为______ ;原NaOH溶液的物质的量浓度为____ ;由曲线X、Y可知,两次实验通入的CO2的体积比为______ 。
(1)F在元素周期表中的位置为
(2)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为
(3)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色,H的电子式为
(4)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol 熔融A4B4电离生成两种离子各1mol,则该物质熔融时的电离方程式为
(5)B2A4 常用做火箭推进的燃料,写出负极的电极反应:
(6)向30mL某浓度由A、B、C、D中三种元素形成的一元强碱溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。则曲线Y表明M中的溶质为

您最近一年使用:0次
7 . 下图为相关物质之间的转化关系,其中甲、乙为生活中常见的金属单质,丙、丁在常温下为气态非金属单质,A~F为化合物(水均已略去)。
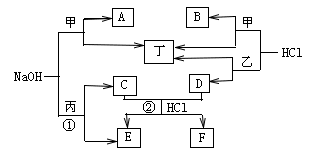
请回答:
(1)组成丙的元一素在元素周期表中的位置为____________ ;利用反应① ,工业上常制备__________ (填产品名称)。
(2)C的电子式为________________ ;反应②的离子方程式为________________ 。
(3)将A、B的水溶液混合,反应的离子方程式为________________ 。
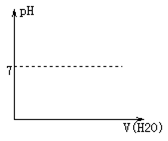
(4)将B 的稀溶液加水稀释,在下图中画出溶液pH 随加水体积的变化曲线____ .
(5)工业上冶炼金属甲的化学方程式为________________ 。
(6)将等物质的量的A和NaOH混合溶于水,该溶液中各离子的物质的量浓度由大到小的顺序为________________ 。
(7)检验F中阳离子的方法为________________ 。

请回答:
(1)组成丙的元一素在元素周期表中的位置为
(2)C的电子式为
(3)将A、B的水溶液混合,反应的离子方程式为
(4)将B 的稀溶液加水稀释,在下图中画出溶液pH 随加水体积的变化曲线

(5)工业上冶炼金属甲的化学方程式为
(6)将等物质的量的A和NaOH混合溶于水,该溶液中各离子的物质的量浓度由大到小的顺序为
(7)检验F中阳离子的方法为
您最近一年使用:0次
解题方法
8 . 1869年俄国化学家门捷列夫制出第一张元素周期表。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:
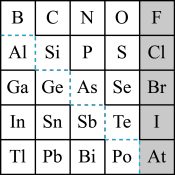
(1)Sn的最高正价为________ ,Cl的最高价氧化物对应水化物的化学式为________ ,Bi的最高价氧化物为________ 。
(2)元素Ga在元素周期表中的位置为:______________ 。
(3)根据元素周期律,推断:
①阴影部分元素的氢化物热稳定性最高的是________ (填化学式)。
②N、O、Al、Si,原子半径大小顺序:___________________
③H3AsO4、H2SeO4、H2SO4的酸性强弱顺序:______________
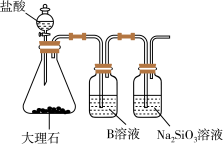
(4)为比较元素C和Si的非金属性强弱,用图所示装置进行实验。溶液B应该选用___________ 溶液,作用是___________________ ,能说明C和Si非金属性强弱的化学方程式是:________________________ 。

(1)Sn的最高正价为
(2)元素Ga在元素周期表中的位置为:
(3)根据元素周期律,推断:
①阴影部分元素的氢化物热稳定性最高的是
②N、O、Al、Si,原子半径大小顺序:
③H3AsO4、H2SeO4、H2SO4的酸性强弱顺序:

(4)为比较元素C和Si的非金属性强弱,用图所示装置进行实验。溶液B应该选用
您最近一年使用:0次
名校
解题方法
9 . A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层电子数是D原子最外层电子数的4倍,D的简单离子核外电子排布与C2-相同。
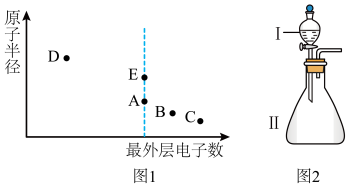
试回答:
(1)元素E在元素周期表中的位置是________ 。
(2)与元素D的简单离子所含电子数和质子数均相同的微粒是________ (用化学式作答,下同)。
(3)B和E的最高价氧化物对应的水化物,酸性较弱的为________ 。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ________ Ⅱ________ ,观察到的实验现象是____ 。
(4)由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:
①a含有的化学键有____________________________________ ;
②c的电子式为___________________ ;
③b与c反应的化学方程式为____________________________________ 。

试回答:
(1)元素E在元素周期表中的位置是
(2)与元素D的简单离子所含电子数和质子数均相同的微粒是
(3)B和E的最高价氧化物对应的水化物,酸性较弱的为
(4)由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A、C、D的盐 |
| b | C、D组成的化合物,且原子个数之比为1∶1 |
| c | 化学组成为AC2 |
①a含有的化学键有
②c的电子式为
③b与c反应的化学方程式为
您最近一年使用:0次
名校
10 . 聚合物H (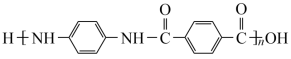 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
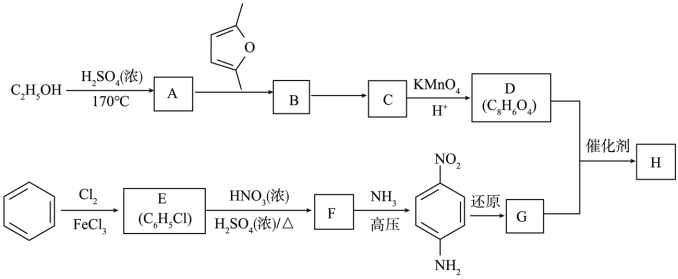
已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels﹣Alder反应: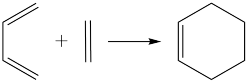 。
。
(1)生成A的反应类型是________ 。D的名称是______ 。F中所含官能团的名称是______ 。
(2)B的结构简式是______ ;“B→C”的反应中,除C外,另外一种产物是______ 。
(3)D+G→H的化学方程式是___________________________________________ 。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有_____ 种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为__________________________________ (任写一种)。
(5)已知:乙炔与1,3﹣丁二烯也能发生Diels﹣Alder反应。请以1,3﹣丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线
,写出合成路线_______________________ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
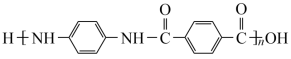 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels﹣Alder反应:
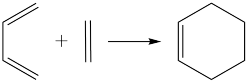 。
。(1)生成A的反应类型是
(2)B的结构简式是
(3)D+G→H的化学方程式是
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有
(5)已知:乙炔与1,3﹣丁二烯也能发生Diels﹣Alder反应。请以1,3﹣丁二烯和乙炔为原料,选用必要的无机试剂合成
 ,写出合成路线
,写出合成路线
您最近一年使用:0次
2020-04-28更新
|
332次组卷
|
19卷引用:内蒙古巴彦淖尔一中2019届高三上学期第二次月考理综化学试题
内蒙古巴彦淖尔一中2019届高三上学期第二次月考理综化学试题四川省宜宾市高2018届高三第三次诊断考试化学试题【全国百强校】湖北省荆州中学2018届高三全真模拟考试(二)理综化学试题辽宁省沈阳铁路实验中学2017-2018学年高二6月月考化学试题【全国校级联考】广东省中山一中、仲元中学等七校2019届高三第一次(8月)联考理综化学试题【全国百强校】宁夏回族自治区银川市第一中学2019届高三上学期第三次月考理科综合化学试题【全国百强校】甘肃省兰州市第一中学2019届高三上学期期中考试化学试题西藏自治区林芝二高2019届高三上学期第四次月考化学试题【市级联考】辽宁省抚顺市2019届高三下学期第一次模拟考试理科综合化学试题四川省泸州市泸县第一中学2019届高三下学期三诊模拟理科综合化学试题【全国百强校】河北省武邑中学2019届高三下学期第一次模拟考试化学试题【校级联考】湖北省宜昌市夷陵中学、襄阳五中、钟祥一中2019届高三5月模拟考试理科综合化学试题安徽省宿州市2020年高三年级理综模拟卷(四)化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(三)(已下线)考点19 有机合成与推断-2020年高考化学命题预测与模拟试题分类精编山东省青岛市平度市2020届高三3月高考模拟化学试卷云南民族大学附属中学2019-2020学年高二下学期期中考试化学试题山东省济南市大学城实验高级中学2021届高三1月阶段性考试化学试题海南省琼海市嘉积第三中学2021-2022学年高三下学期第三次月考化学科试题



