名校
1 . 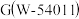 是
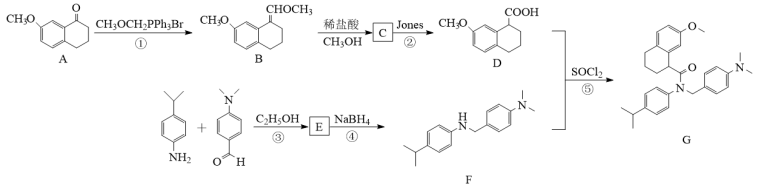
是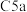 受体拮抗剂,以化合物A为原料制备G的合成路线如图所示。
受体拮抗剂,以化合物A为原料制备G的合成路线如图所示。
已知: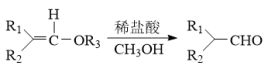 。
。
回答下列问题:
(1)有机物D中官能团名称为_____ 。
(2)下列关于化合物C的叙述正确的是_____(填字母)。
(3)Jones试剂又名琼斯试剂,是由 、硫酸与水配成的溶液,Jones试剂在反应②中所起的作用是
、硫酸与水配成的溶液,Jones试剂在反应②中所起的作用是_____ 。
(4)化合物E的分子式为 ,则E的结构简式为
,则E的结构简式为_____ 。
(5)写出反应⑤的化学方程式:_____ 。
(6)同时满足下列条件的D的同分异构体有_____ 种(不考虑立体异构);其中核磁共振氢谱有4组峰,且峰面积之比为 的结构简式为
的结构简式为_____ (任写一种)。
I.能与 ,溶液发生显色反应。
,溶液发生显色反应。
Ⅱ.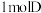 与足量银氨溶液反应能生成
与足量银氨溶液反应能生成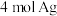 。
。
Ⅲ.苯环上连有4个取代基,且所有含氧官能团都直接与苯环相连。
Ⅳ.苯环上只有一种化学环境的氢原子。
(7)利用所学知识并参考上述合成路线,以甲苯和苯胺(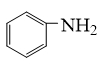 为原料(其他试剂任选),设计制备
为原料(其他试剂任选),设计制备 的合成路线:
的合成路线:_____ 。
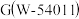 是
是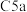 受体拮抗剂,以化合物A为原料制备G的合成路线如图所示。
受体拮抗剂,以化合物A为原料制备G的合成路线如图所示。
已知:
 。
。回答下列问题:
(1)有机物D中官能团名称为
(2)下列关于化合物C的叙述正确的是_____(填字母)。
| A.所有碳原子均可能处于同一平面上 |
| B.能发生取代反应和还原反应 |
C.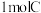 最多能消耗 最多能消耗 |
D.能与新制 悬浊液反应产生砖红色沉淀 悬浊液反应产生砖红色沉淀 |
 、硫酸与水配成的溶液,Jones试剂在反应②中所起的作用是
、硫酸与水配成的溶液,Jones试剂在反应②中所起的作用是(4)化合物E的分子式为
 ,则E的结构简式为
,则E的结构简式为(5)写出反应⑤的化学方程式:
(6)同时满足下列条件的D的同分异构体有
 的结构简式为
的结构简式为I.能与
 ,溶液发生显色反应。
,溶液发生显色反应。Ⅱ.
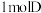 与足量银氨溶液反应能生成
与足量银氨溶液反应能生成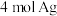 。
。Ⅲ.苯环上连有4个取代基,且所有含氧官能团都直接与苯环相连。
Ⅳ.苯环上只有一种化学环境的氢原子。
(7)利用所学知识并参考上述合成路线,以甲苯和苯胺(
 为原料(其他试剂任选),设计制备
为原料(其他试剂任选),设计制备 的合成路线:
的合成路线:
您最近一年使用:0次
名校
解题方法
2 . 化合物H是丁苯酞在体内代谢的一种产物,其保有丁苯酞的生物活性,具有增加缺血区的血流量、缩小脑梗塞面积以及修复神经功能性缺失症状的功能,其合成路线如下:

已知:①氯铬酸吡啶盐(Pyridinium Chlorochromate;PCC)是一种氧化剂。
②N-溴代丁二酰亚胺(NBS)是一种溴代试剂,有反应条件温和、操作方便、反应选择性高、副反应少的优点。
(1)A可由化合物 (I)在高温条件下发生分子内脱水形成,化合物I的化学名称为
(I)在高温条件下发生分子内脱水形成,化合物I的化学名称为___________ 。
(2)G中官能团的名称是___________ 。
(3)B→C的反应类型为___________ ,F→G的反应类型为___________ 。
(4)用*号标出化合物H中的手性碳原子___________ ,写出H与NaOH溶液反应的化学方程式:___________ 。
(5)化合物D的同分异构体中能同时满足以下条件的是___________ (写出其中一种的结构简式)。
I.能发生银镜反应;II.遇FeCl3溶液显紫色;III.在核磁共振氢谱中有6组峰,且峰面积相同。
(6)根据所学知识及题给信息,以丙酮为原料合成BrCH2CH=CH2(无机试剂和有机溶剂任选,合成路线示例见本题题干)___________ 。

已知:①氯铬酸吡啶盐(Pyridinium Chlorochromate;PCC)是一种氧化剂。
②N-溴代丁二酰亚胺(NBS)是一种溴代试剂,有反应条件温和、操作方便、反应选择性高、副反应少的优点。
(1)A可由化合物
 (I)在高温条件下发生分子内脱水形成,化合物I的化学名称为
(I)在高温条件下发生分子内脱水形成,化合物I的化学名称为(2)G中官能团的名称是
(3)B→C的反应类型为
(4)用*号标出化合物H中的手性碳原子
(5)化合物D的同分异构体中能同时满足以下条件的是
I.能发生银镜反应;II.遇FeCl3溶液显紫色;III.在核磁共振氢谱中有6组峰,且峰面积相同。
(6)根据所学知识及题给信息,以丙酮为原料合成BrCH2CH=CH2(无机试剂和有机溶剂任选,合成路线示例见本题题干)
您最近一年使用:0次
2021-05-11更新
|
236次组卷
|
2卷引用:山西省晋中市2021届高三下学期5月统一模拟考试(三模) 理综化学试题
名校
3 . 纳米氧化亚铜(Cu2O,颗粒直径1~100nm)具有特殊的光学、光电和催化性能,采用化学沉淀法制备晶型结构完整、粒度分布均匀的纳米Cu2O(在潮湿空气中会慢慢氧化生成CuO)的合成路线如图所示。下列说法正确的是
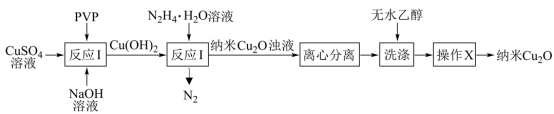

| A.反应Ⅰ为化合反应 |
| B.操作X为过滤 |
| C.反应Ⅱ中,每生成22.4L(标准状况)N2,转移4mol电子 |
| D.“洗涤”时,无水乙醇可用蒸馏水代替 |
您最近一年使用:0次
2021-10-09更新
|
414次组卷
|
3卷引用:山西省太原市第五中学2021-2022学年高三上学期11月化学月考试题
解题方法
4 . 药物异博定(盐酸维拉帕米)能有效控制血压升高、促进血液循环,其合成路线中有如下转化过程:

下列说法正确的是

下列说法正确的是
A.X的沸点高于其同分异构体 |
| B.X分子中所有的C原子不可能共面 |
| C.1mol Y与NaOH溶液反应,消耗NaOH为1mol |
| D.Z分子与Br2按物质的量之比为1∶1加成时,所得产物有3种 |
您最近一年使用:0次
2021-05-06更新
|
181次组卷
|
4卷引用:山西省朔州市怀仁市2020-2021学年高二下学期期末考试化学试题
5 . “一碳化学”的研究对象为含有一个碳原子的物质,如CO、CO2、CH4等,“一碳化学”在消除二氧化碳排放、有效降低全球变暖风险中具有十分广泛的应用。请完成下列各题:。
(1)CH4与CO2反应可获得应用广泛的合成气(CO和H2):CH4+CO2=2CO+2H2。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-820kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH3=-566kJ·mol-1
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=_______ kJ·mol-1。其正反应的活化能为EakJ·mol-1,则逆反应的活化能为_______ kJ·mol-1。该反应自发进行的条件是_______ (填“高温”“低温”或“任意条件”)。
(2)一定条件下,将CO2与H2的混合气体通过催化剂可实现将CO2转变为二甲醚(CH3OCH3)(g),同时有H2O(g)生成。在某压强下,在不同温度、不同投料比时,CO2与H2反应生成二甲醚的反应中,CO2的平衡转化率如图甲所示:
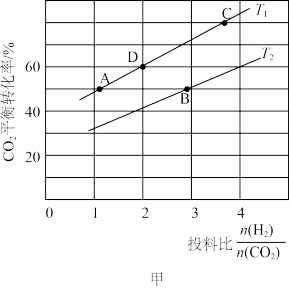
①写出该反应的化学方程式:_______ 。
②T1温度下,在2L密闭容器中充入18mol原料气,5min后反应达到D点,则0~5min内的平均反应速率v(CH3OCH3)=_______ 。
③若T1<T2,则反应的ΔH_______ (填“<”“>”或“=”)0;T1温度下D点所对应反应的平衡常数为_______ (保留两位小数);KA、KB、KC三者之间的大小关系为_______ 。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图乙所示:
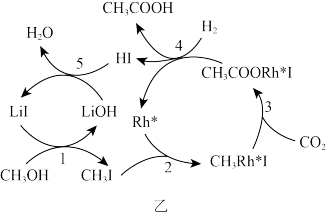
①根据图示,写出总反应的化学方程式:_______ 。
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式:_______ 。
(1)CH4与CO2反应可获得应用广泛的合成气(CO和H2):CH4+CO2=2CO+2H2。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-820kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH3=-566kJ·mol-1
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=
(2)一定条件下,将CO2与H2的混合气体通过催化剂可实现将CO2转变为二甲醚(CH3OCH3)(g),同时有H2O(g)生成。在某压强下,在不同温度、不同投料比时,CO2与H2反应生成二甲醚的反应中,CO2的平衡转化率如图甲所示:

①写出该反应的化学方程式:
②T1温度下,在2L密闭容器中充入18mol原料气,5min后反应达到D点,则0~5min内的平均反应速率v(CH3OCH3)=
③若T1<T2,则反应的ΔH
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图乙所示:

①根据图示,写出总反应的化学方程式:
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式:
您最近一年使用:0次
名校
6 . 以沼气(CH4)为原料制H2和CO合成气,再进一步合成甲醇等燃料,具有广阔的应用前景。在一定条件下,沼气的转化原理为:
水蒸气重整:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH1
水煤气变换:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2
甲烷二氧化碳重整:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH3。
对应的平衡常数分别为Kp1、Kp2、Kp3。请回答:
(1)甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
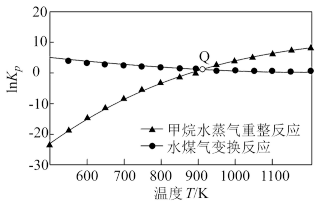
①甲烷水蒸气重整反应能够自发进行的条件是___________ (填“低温”、“高温”或“任何温度”),ΔH1___________ ΔH3(填“小于”、“大于”或“等于”);图中Q点时,Kp3=___________ 。
②通过计算机模拟甲烷水蒸气重整反应实验测得,在操作压强为0.1Mpa、水碳比n(H2O)/n(CH4)为1.0,温度为900℃,反应达到平衡时,H2的物质的量分数为0.6。已知该反应的速率方程υ=kp(CH4)/p(H2),式中k为速率常数,p为气体分压,气体分压=总压×气体物质的量分数,则此时该反应速率υ=______ (用含k的式子表示)。
(2)通过计算机模拟操作压强为0.1Mpa、温度为900℃时的甲烷水蒸气重整反应实验,已知起始水碳比n(H2O)/n(CH4)为1.0,测得反应达到平衡时,H2的物质的量分数为0.5。已知该反应的速率方程υ=kp(CH4)/p(H2)(式中k为速率常数,p为气体分压,气体分压=总压×气体物质的量分数),则此时该反应的速率υ=_______ (用含k的式子表示);900℃时,该反应的压强平衡常数Kp1=________ 。
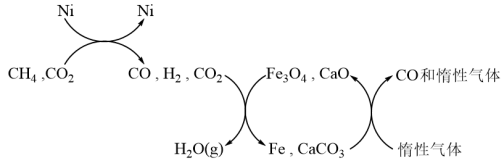
(3)甲烷二氧化碳重整反应催化转化原理如图所示,假设各步反应均转化完全,若投料比n(CO2)/n(CH4)=1.0,可导致催化剂CaO失效,原因是___________ 。
(4)CO和H2可做燃料电池的燃料。一种熔融碳酸盐燃料电池的工作原理如图所示。电极A上H2参与的电极反应为___________ 。假设催化炉产生的CO与H2物质的量之比为1︰2。电极A处产生的CO2有部分参与循环利用,其利用率为___________ %。

水蒸气重整:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH1
水煤气变换:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2
甲烷二氧化碳重整:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH3。
对应的平衡常数分别为Kp1、Kp2、Kp3。请回答:
(1)甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:

①甲烷水蒸气重整反应能够自发进行的条件是
②通过计算机模拟甲烷水蒸气重整反应实验测得,在操作压强为0.1Mpa、水碳比n(H2O)/n(CH4)为1.0,温度为900℃,反应达到平衡时,H2的物质的量分数为0.6。已知该反应的速率方程υ=kp(CH4)/p(H2),式中k为速率常数,p为气体分压,气体分压=总压×气体物质的量分数,则此时该反应速率υ=
(2)通过计算机模拟操作压强为0.1Mpa、温度为900℃时的甲烷水蒸气重整反应实验,已知起始水碳比n(H2O)/n(CH4)为1.0,测得反应达到平衡时,H2的物质的量分数为0.5。已知该反应的速率方程υ=kp(CH4)/p(H2)(式中k为速率常数,p为气体分压,气体分压=总压×气体物质的量分数),则此时该反应的速率υ=
(3)甲烷二氧化碳重整反应催化转化原理如图所示,假设各步反应均转化完全,若投料比n(CO2)/n(CH4)=1.0,可导致催化剂CaO失效,原因是

(4)CO和H2可做燃料电池的燃料。一种熔融碳酸盐燃料电池的工作原理如图所示。电极A上H2参与的电极反应为

您最近一年使用:0次
7 . 尿素[CO(NH2)2]对于我国经济和社会的可持续发展具有重要意义,工业上以NH3和CO2为原料合成: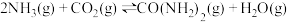 。回答下列问题:
。回答下列问题:
(1)已知上述反应的平衡常数K和温度T的关系如下表所示:
①该反应的△H_______ 0(填“>”或“<”,下同);该反应中反应物的总能量________ 生成物的总能量。
②该反应的平衡常数K的表达式为___________ 。
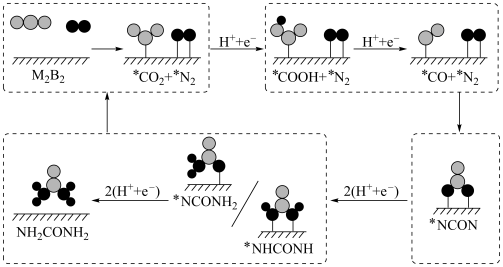
(2)传统的尿素生产工艺耗能较高,且产率较低。最近我国科学家发现TiO2纳米片负载的Pd-Cu合金纳米颗粒电催化剂可以将水溶液中的CO2和N2直接转化为尿素(反应机理如图所示,*表示催化剂活性中心原子)。
①根据以上反应机理,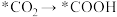 的过程发生
的过程发生_______ (填“氧化反应”或“还原反应”);断裂的是____ (填“极性键”或“非极性键”,下同),形成的是_________ 。
②与传统生产工艺相比,这种新方法的优点是___________ 。
(3)在2L的密闭容器中充入NH3和CO2模拟尿素的工业生产,测得一定温度和压强下,CO2的平衡转化率( )与氨碳比x(即NH3和CO2的物质的量之比)的关系如图所示。
)与氨碳比x(即NH3和CO2的物质的量之比)的关系如图所示。

①计算图中B点处NH3的平衡转化率为________ 。
②CO2平衡转化率随氨碳比增大而增大的原因是_________ 。
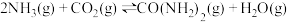 。回答下列问题:
。回答下列问题:(1)已知上述反应的平衡常数K和温度T的关系如下表所示:
| T/℃ | 165 | 175 | 185 |
| K | 111.9 | 74.1 | 50.6 |
②该反应的平衡常数K的表达式为
(2)传统的尿素生产工艺耗能较高,且产率较低。最近我国科学家发现TiO2纳米片负载的Pd-Cu合金纳米颗粒电催化剂可以将水溶液中的CO2和N2直接转化为尿素(反应机理如图所示,*表示催化剂活性中心原子)。

①根据以上反应机理,
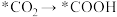 的过程发生
的过程发生②与传统生产工艺相比,这种新方法的优点是
(3)在2L的密闭容器中充入NH3和CO2模拟尿素的工业生产,测得一定温度和压强下,CO2的平衡转化率(
 )与氨碳比x(即NH3和CO2的物质的量之比)的关系如图所示。
)与氨碳比x(即NH3和CO2的物质的量之比)的关系如图所示。
①计算图中B点处NH3的平衡转化率为
②CO2平衡转化率随氨碳比增大而增大的原因是
您最近一年使用:0次



