解题方法
1 .  是一种黄色油状液体,熔点
是一种黄色油状液体,熔点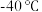 ,沸点
,沸点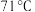 ,不溶于冷水,常温下密度为
,不溶于冷水,常温下密度为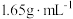 。
。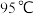 以上爆炸,弱酸性环境稳定,中性水中易发生水解。常用于面粉的漂白和杀菌。实验室可用
以上爆炸,弱酸性环境稳定,中性水中易发生水解。常用于面粉的漂白和杀菌。实验室可用 和
和 溶液在常温下反应制取,所用装置如下:
溶液在常温下反应制取,所用装置如下:
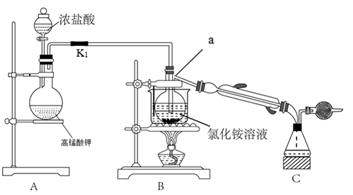
回答下列问题:
(1) 的分子构型为
的分子构型为___________ 。
(2)仪器a的名称为___________ ;实验室利用装置A还可以制备下列哪些物质___________ (填字母)。
a、乙炔b、硝基苯c、溴苯d、乙酸乙酯
(3)打开活塞 ,将浓盐酸滴入圆底烧瓶中,仪器a中制备
,将浓盐酸滴入圆底烧瓶中,仪器a中制备 的化学反应方程式为
的化学反应方程式为___________ ,待反应至仪器a中有大量油状液体生成,关闭活塞 。将产物分离并用无水
。将产物分离并用无水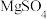 干燥后,利用B、C装置将
干燥后,利用B、C装置将 提纯,提纯过程中水浴温度应控制在
提纯,提纯过程中水浴温度应控制在___________ 。
(4)将提纯后的 滴入含有紫色石蕊试剂的水中,溶液先变蓝后褪色,产生该现象的原因是
滴入含有紫色石蕊试剂的水中,溶液先变蓝后褪色,产生该现象的原因是___________ (使用化学用语结合文字解释)。
(5)液氯储罐中常混有 。为测定氯气中的
。为测定氯气中的 含量,将一定量样品先通入足量含有氧化汞的浓盐酸溶液中(反应为:
含量,将一定量样品先通入足量含有氧化汞的浓盐酸溶液中(反应为: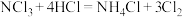 ),产生的气体通过饱和食盐水后再用足量
),产生的气体通过饱和食盐水后再用足量 溶液吸收,测得吸收后
溶液吸收,测得吸收后 溶液增重
溶液增重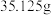 。经测定
。经测定 吸收管内
吸收管内 质量为
质量为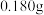 。该样品中
。该样品中 的质量分数为
的质量分数为___________ %(保留三位有效数字);若产生的气体未通过饱和食盐水,则测定结果___________ (填“偏高”“偏低”或“无影响”)。
 是一种黄色油状液体,熔点
是一种黄色油状液体,熔点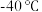 ,沸点
,沸点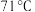 ,不溶于冷水,常温下密度为
,不溶于冷水,常温下密度为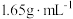 。
。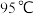 以上爆炸,弱酸性环境稳定,中性水中易发生水解。常用于面粉的漂白和杀菌。实验室可用
以上爆炸,弱酸性环境稳定,中性水中易发生水解。常用于面粉的漂白和杀菌。实验室可用 和
和 溶液在常温下反应制取,所用装置如下:
溶液在常温下反应制取,所用装置如下:
回答下列问题:
(1)
 的分子构型为
的分子构型为(2)仪器a的名称为
a、乙炔b、硝基苯c、溴苯d、乙酸乙酯
(3)打开活塞
 ,将浓盐酸滴入圆底烧瓶中,仪器a中制备
,将浓盐酸滴入圆底烧瓶中,仪器a中制备 的化学反应方程式为
的化学反应方程式为 。将产物分离并用无水
。将产物分离并用无水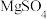 干燥后,利用B、C装置将
干燥后,利用B、C装置将 提纯,提纯过程中水浴温度应控制在
提纯,提纯过程中水浴温度应控制在(4)将提纯后的
 滴入含有紫色石蕊试剂的水中,溶液先变蓝后褪色,产生该现象的原因是
滴入含有紫色石蕊试剂的水中,溶液先变蓝后褪色,产生该现象的原因是(5)液氯储罐中常混有
 。为测定氯气中的
。为测定氯气中的 含量,将一定量样品先通入足量含有氧化汞的浓盐酸溶液中(反应为:
含量,将一定量样品先通入足量含有氧化汞的浓盐酸溶液中(反应为: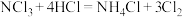 ),产生的气体通过饱和食盐水后再用足量
),产生的气体通过饱和食盐水后再用足量 溶液吸收,测得吸收后
溶液吸收,测得吸收后 溶液增重
溶液增重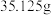 。经测定
。经测定 吸收管内
吸收管内 质量为
质量为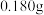 。该样品中
。该样品中 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 过氧化钙(CaO2)广泛应用于水产养殖、污水处理,是优良的供氧剂。
为了测定CaO2的含量,具体的操作:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图:

(1)在流程中过氧化钙(CaO2)与水反应的离子反应方程式_______ 。
(2)滴加的Na2CO3溶液要过量的原因是_______ 。
(3)检验沉淀已经洗涤干净的方法是:_______ 。
(4)若供氧剂的质量m=5g,碳酸钙质量n=6g,请通过计算得出供氧剂中的过氧化钙含量的质量分数为_______ %。
(5)若CaCO3沉淀过滤后不洗涤,则过氧化钙的含量将_______ (填“偏大”、“偏小”或“无影响”)。
为了测定CaO2的含量,具体的操作:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图:

(1)在流程中过氧化钙(CaO2)与水反应的离子反应方程式
(2)滴加的Na2CO3溶液要过量的原因是
(3)检验沉淀已经洗涤干净的方法是:
(4)若供氧剂的质量m=5g,碳酸钙质量n=6g,请通过计算得出供氧剂中的过氧化钙含量的质量分数为
(5)若CaCO3沉淀过滤后不洗涤,则过氧化钙的含量将
您最近一年使用:0次
名校
3 . 某实验小组为了分析补血剂 中铁元素的质量分数,用
中铁元素的质量分数,用 标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是
标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是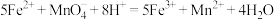 。
。
(1)滴定过程中 标准溶液放在
标准溶液放在__________ (仪器名称)。
(2)达到滴定终点的现象是__________ 。
(3)下列操作能使结果偏大的是______。
(4)该实验小组称取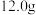 补血剂在容量瓶中配成
补血剂在容量瓶中配成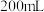 溶液,量取
溶液,量取 试样溶液,用
试样溶液,用 标准溶液滴定。达到滴定终点时,消耗标准溶液
标准溶液滴定。达到滴定终点时,消耗标准溶液 ,则所测补血剂中铁元素的质量分数是
,则所测补血剂中铁元素的质量分数是__________ (结果精确到0.1%)。
(5)若该小组配制溶液和滴定操作时引起的误差忽略,最终所测补血剂中铁元素含量仍偏小,其可能的原因是__________ 。
 中铁元素的质量分数,用
中铁元素的质量分数,用 标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是
标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是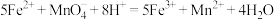 。
。(1)滴定过程中
 标准溶液放在
标准溶液放在(2)达到滴定终点的现象是
(3)下列操作能使结果偏大的是______。
| A.滴定管未润洗即装入标准溶液 |
| B.滴定过程中开始仰视,后来俯视度数 |
| C.滴定开始时滴定管尖嘴处有气泡,滴定后气泡消失 |
| D.滴定过程中锥形瓶中不慎有液体溅出 |
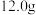 补血剂在容量瓶中配成
补血剂在容量瓶中配成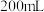 溶液,量取
溶液,量取 试样溶液,用
试样溶液,用 标准溶液滴定。达到滴定终点时,消耗标准溶液
标准溶液滴定。达到滴定终点时,消耗标准溶液 ,则所测补血剂中铁元素的质量分数是
,则所测补血剂中铁元素的质量分数是(5)若该小组配制溶液和滴定操作时引起的误差忽略,最终所测补血剂中铁元素含量仍偏小,其可能的原因是
您最近一年使用:0次
名校
解题方法
4 . 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
氯化铁:熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。氯化亚铁:熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁(铁粉足量)。请回答下列问题:
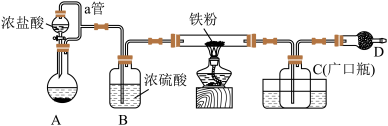
(1)在装置A中,用 与浓盐酸反应制取氯气,写出反应的离子方程式
与浓盐酸反应制取氯气,写出反应的离子方程式_______ 。
(2)B装置的作用_______ 。
(3)D中装的药品是_______ ,其作用是吸收未反应的 ,防止污染环境;同时防止空气中的水进入装置C,使
,防止污染环境;同时防止空气中的水进入装置C,使 潮解。
潮解。
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有 ,可用下列试剂中的
,可用下列试剂中的_______ (只能选取一种试剂,填序号)进行检测。
① 溶液 ②酸性
溶液 ②酸性 溶液 ③
溶液 ③ 溶液 ④
溶液 ④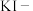 淀粉溶液
淀粉溶液
(5)定量分析。取装置C中的产物,按以下步骤进行测定:
①称取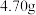 产品溶于过量的稀盐酸中;
产品溶于过量的稀盐酸中;
②加入足量 溶液;
溶液;
③再加入足量 溶液;
溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为 。
。
则该样品中铁元素的质量分数为_______ %(结果精确到小数点后两位)。
(6)由(5)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量_______ (填“相等”“偏高”或“偏低”),说明含有 杂质。
杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_______ 。
氯化铁:熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。氯化亚铁:熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁(铁粉足量)。请回答下列问题:

(1)在装置A中,用
 与浓盐酸反应制取氯气,写出反应的离子方程式
与浓盐酸反应制取氯气,写出反应的离子方程式(2)B装置的作用
(3)D中装的药品是
 ,防止污染环境;同时防止空气中的水进入装置C,使
,防止污染环境;同时防止空气中的水进入装置C,使 潮解。
潮解。(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有
 ,可用下列试剂中的
,可用下列试剂中的①
 溶液 ②酸性
溶液 ②酸性 溶液 ③
溶液 ③ 溶液 ④
溶液 ④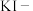 淀粉溶液
淀粉溶液(5)定量分析。取装置C中的产物,按以下步骤进行测定:
①称取
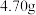 产品溶于过量的稀盐酸中;
产品溶于过量的稀盐酸中;②加入足量
 溶液;
溶液;③再加入足量
 溶液;
溶液;④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为
 。
。则该样品中铁元素的质量分数为
(6)由(5)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量
 杂质。
杂质。②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是
您最近一年使用:0次
5 . 硫酸肼(N2H4·H2SO4)又名硫酸联氨,在医药、染料、农业上用途广泛。
已知:①Cl2与NaOH溶液的反应为放热反应,Cl2与热的NaOH溶液反应会生成NaClO3
②利用尿素法生产水合肼的原理:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl
③硫酸肼的制备原理:N2H4·H2O+H2SO4=N2H4·H2SO4+H2O
回答下列问题:
Ⅰ.制备NaClO溶液
实验制备装置如图甲所示:
(1)欲配制220mL6mol/L的盐酸,则需要密度为1.2g/mL,质量分数为36.5%的浓盐酸体积为____ mL,此过程所需玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管和____ 。
(2)甲图装置C试管内发生主要化学反应的离子方程式为____ 。
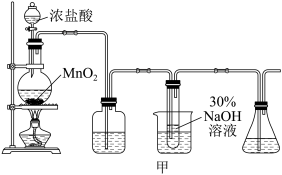
Ⅱ.乙图是尿素法生产水合肼的装置
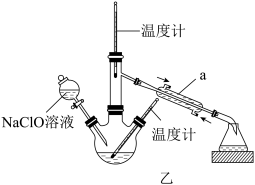
(3)把Ⅰ制得的NaClO溶液注入到图乙装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液,应采用____ 的方式降温,并控制低温(低于20℃)进行反应。温度高时水合肼会被氧化成无色无味的气体,该气体在标准状况下的密度为1.25g·L-1,其反应的化学方程式为_____ 。反应结束后,收集108~1149℃馏分。
(4)测定馏分中水合肼的含量。称取馏分5.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。实验测得消耗I2溶液体积的平均值为20.00mL,则馏分中水合肼(N2H4H2O)的质量分数为____ 。(保留两位有效数字)
Ⅲ.硫酸肼的性质、制备
已知:硫酸肼(又可以表示为:N2H6SO4)是一种重要的化工原料,硫酸肼属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似。
(5)将水合肼转移到烧杯中,滴加一定量浓硫酸,控制温度,得硫酸肼沉淀。洗涤硫酸肼时用无水乙醇而不用水洗涤的原因是____ 。
(6)①写出硫酸肼第二步水解反应的离子方程式:____ 。
②硫酸肼水溶液中离子浓度关系表达正确的是____ (填英文字母)。
A.c(SO )=c(N2H
)=c(N2H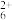 )+c(N2H
)+c(N2H )+c(N2H4·H2O)
)+c(N2H4·H2O)
B.c(SO )>c([N2H5·H2O]+)>c(H+)>c(OH-)
)>c([N2H5·H2O]+)>c(H+)>c(OH-)
C.2c(N2H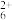 )+c([N2H5·H2O]+)=c(H+)+c(OH-)
)+c([N2H5·H2O]+)=c(H+)+c(OH-)
D.c(SO )>c(N2H
)>c(N2H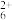 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
已知:①Cl2与NaOH溶液的反应为放热反应,Cl2与热的NaOH溶液反应会生成NaClO3
②利用尿素法生产水合肼的原理:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl
③硫酸肼的制备原理:N2H4·H2O+H2SO4=N2H4·H2SO4+H2O
回答下列问题:
Ⅰ.制备NaClO溶液
实验制备装置如图甲所示:
(1)欲配制220mL6mol/L的盐酸,则需要密度为1.2g/mL,质量分数为36.5%的浓盐酸体积为
(2)甲图装置C试管内发生主要化学反应的离子方程式为

Ⅱ.乙图是尿素法生产水合肼的装置

(3)把Ⅰ制得的NaClO溶液注入到图乙装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液,应采用
(4)测定馏分中水合肼的含量。称取馏分5.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。实验测得消耗I2溶液体积的平均值为20.00mL,则馏分中水合肼(N2H4H2O)的质量分数为
Ⅲ.硫酸肼的性质、制备
已知:硫酸肼(又可以表示为:N2H6SO4)是一种重要的化工原料,硫酸肼属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似。
(5)将水合肼转移到烧杯中,滴加一定量浓硫酸,控制温度,得硫酸肼沉淀。洗涤硫酸肼时用无水乙醇而不用水洗涤的原因是
(6)①写出硫酸肼第二步水解反应的离子方程式:
②硫酸肼水溶液中离子浓度关系表达正确的是
A.c(SO
 )=c(N2H
)=c(N2H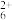 )+c(N2H
)+c(N2H )+c(N2H4·H2O)
)+c(N2H4·H2O)B.c(SO
 )>c([N2H5·H2O]+)>c(H+)>c(OH-)
)>c([N2H5·H2O]+)>c(H+)>c(OH-)C.2c(N2H
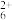 )+c([N2H5·H2O]+)=c(H+)+c(OH-)
)+c([N2H5·H2O]+)=c(H+)+c(OH-)D.c(SO
 )>c(N2H
)>c(N2H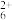 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
您最近一年使用:0次
名校
6 . 由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。欲测定某样品中NaNO2的含量,某同学设计如下实验:①称取样品a g,加水溶解,配制成100 mL溶液。②取25.00 mL溶液于锥形瓶中,用0.0200 mol/L KMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液V mL。
(1)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外还有_______ 。
(2)在进行滴定操作时,KMnO4溶液盛装在_______ (填“酸式”或“碱式”)滴定管中。当滴入最后半滴KMnO4溶液,_______ 时达到滴定终点。
(3)滴定过程中发生反应的离子方程式是____ ;测得该样品中NaNO2的质量分数为____ 。
(4)以下操作造成测定结果偏高的是_______ 。
A.滴定管未用KMnO4标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
(5)大量的碘富集在海藻中,用水浸取后浓缩。浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中
_______ 。(结果保留两位有效数字)(已知 ,
,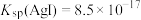 )
)
(1)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外还有
(2)在进行滴定操作时,KMnO4溶液盛装在
(3)滴定过程中发生反应的离子方程式是
(4)以下操作造成测定结果偏高的是
A.滴定管未用KMnO4标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
(5)大量的碘富集在海藻中,用水浸取后浓缩。浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中

 ,
,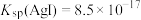 )
)
您最近一年使用:0次
7 . 某实验小组为了分析补血剂FeSO4·7H2O中铁元素的质量分数,用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是5Fe2++ +8H+=5Fe3++Mn2++4H2O。
+8H+=5Fe3++Mn2++4H2O。
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液490 mL,配制时需要用的仪器除天平、药匙、玻璃棒、烧杯、胶头滴管外,还需_______ 。
(2)滴定前是否需要滴加指示剂?_______ (填“是”或“否”),理由是_______ 。
(3)某同学设计的下列滴定方式中,最合理的是_______ (填字母)。

(4)该实验小组称取12.0 g补血剂在容量瓶中配成200 mL溶液,量取25.00 mL试样溶液,用0.100 mol/L KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则所测补血剂中铁元素的质量分数是_______ (结果精确到0.1%)。
(5)下列操作能使结果偏大的是
(6)若该小组配制溶液和滴定操作时引起的误差忽略,最终所测补血剂中铁元素含量仍偏小,其可能的原因是_______ 。
 +8H+=5Fe3++Mn2++4H2O。
+8H+=5Fe3++Mn2++4H2O。(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液490 mL,配制时需要用的仪器除天平、药匙、玻璃棒、烧杯、胶头滴管外,还需
(2)滴定前是否需要滴加指示剂?
(3)某同学设计的下列滴定方式中,最合理的是

(4)该实验小组称取12.0 g补血剂在容量瓶中配成200 mL溶液,量取25.00 mL试样溶液,用0.100 mol/L KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则所测补血剂中铁元素的质量分数是
(5)下列操作能使结果偏大的是
| A.滴定管未润洗即装入标准溶液 |
| B.滴定过程中开始仰视,后来俯视度数 |
| C.滴定过程中锥形瓶中不慎有液体溅出 |
| D.滴定开始时滴定管尖嘴处有气泡,滴定后气泡消失 |
您最近一年使用:0次
名校
解题方法
8 . 绿矾(FeSO4·7H2O)外观为半透明蓝绿色单斜结晶或颗粒,无气味。受热能分解,且在空气中易被氧化。
I.医学上绿矾可用于补血剂甘氨酸亚铁[(NH2CH2COO)2Fe]颗粒的制备,有关物质性质如下:
(1)向绿矾溶液中,缓慢加入NH4HCO3溶液,边加边搅拌,反应结束后生成沉淀FeCO3。该反应的离子方程式为_______ 。
(2)制备(NH2CH2COO)2Fe:往FeCO3中加入甘氨酸(NH2CH2COOH)的水溶液,滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
①加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是__ 。
②洗涤操作,选用的最佳洗涤试剂是_______ (填序号)。
A.热水 B.乙醇 C.柠檬酸
II.绿矾晶体受热分解的反应为2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
(1)加热前通入氮气的目的是_______ 。
(2)实验中观察到装置B现象为_______ 。
(3)C装置和D装置能否调换_______ (填“能”或“否”)。
(4)样品完全分解后,残留物全部为红棕色固体,检验装置A中的残留物含有Fe2O3的方法是_______ 。
(5)该装置有个明显缺陷是_______ 。
III.测定绿矾样品中铁元素的含量。
称取m g绿矾样品于锥形瓶中溶解后加稀H2SO4酸化,用 c mol·L−1 KMnO4溶液滴定至终点。耗KMnO4溶液体积如图II所示,(滴定时发生反应的离子方程式为:5Fe2++MnO4−+8H+=5Fe3++Mn2++4H2O),该晶体中铁元素的质量分数为_______ (用含m、c的式子表示)。
I.医学上绿矾可用于补血剂甘氨酸亚铁[(NH2CH2COO)2Fe]颗粒的制备,有关物质性质如下:
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
(2)制备(NH2CH2COO)2Fe:往FeCO3中加入甘氨酸(NH2CH2COOH)的水溶液,滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
①加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是
②洗涤操作,选用的最佳洗涤试剂是
A.热水 B.乙醇 C.柠檬酸
II.绿矾晶体受热分解的反应为2FeSO4·7H2O
 Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:

(1)加热前通入氮气的目的是
(2)实验中观察到装置B现象为
(3)C装置和D装置能否调换
(4)样品完全分解后,残留物全部为红棕色固体,检验装置A中的残留物含有Fe2O3的方法是
(5)该装置有个明显缺陷是
III.测定绿矾样品中铁元素的含量。
称取m g绿矾样品于锥形瓶中溶解后加稀H2SO4酸化,用 c mol·L−1 KMnO4溶液滴定至终点。耗KMnO4溶液体积如图II所示,(滴定时发生反应的离子方程式为:5Fe2++MnO4−+8H+=5Fe3++Mn2++4H2O),该晶体中铁元素的质量分数为
您最近一年使用:0次
2020-02-08更新
|
604次组卷
|
4卷引用:吉林省四平市2021-2022学年高三下学期最后冲刺化学试题
吉林省四平市2021-2022学年高三下学期最后冲刺化学试题福建省南平市2020届高三第一次综合质量检测理科综合化学试题天津市河西区2020芦台一中高三模拟测试(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测
名校
解题方法
9 . 有三种有机化合物,用李比希法测得这三种有机物所含氢和碳的质量分数都分别为7.7%和92.3%。用质谱仪测得三种有机物具有相同的最大分子离子峰。将1molA在氧气中充分燃烧产生179.2L二氧化碳(标准状况)。A含有苯环,所有碳原子均为sp2杂化;B是链状无支链化合物,有三种不同杂化方式的碳原子,且为非极性分子;C分子中碳原子的化学环境完全相同且碳原子的杂化方式都为sp3杂化。
(1)李比希法使用的氧化剂是_____ ,A的分子式为_____ 。
(2)B和C的结构简式为_____ 、_____ 。
(3)化合物A与溴水反应可生成化合物D。
①反应的方程式为_____ ;反应类型为_____ 。
②与D互为同分异构体且苯环上的一取代物只有一种的化合物共有_____ 种,其中核磁共振氢谱有两组峰,峰面积比为1∶1的有机物结构简式为_____ 。
(4)B的一种同分异构体B′是与其具有相同官能团、有两个支链的链状非极性分子。B和B′在下列仪器中显示的信号(或数据)完全相同,该仪器是_____ 。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪 e.X-射线晶体衍射仪
(5)化合物C的六氯代物有_____ 种。
(1)李比希法使用的氧化剂是
(2)B和C的结构简式为
(3)化合物A与溴水反应可生成化合物D。
①反应的方程式为
②与D互为同分异构体且苯环上的一取代物只有一种的化合物共有
(4)B的一种同分异构体B′是与其具有相同官能团、有两个支链的链状非极性分子。B和B′在下列仪器中显示的信号(或数据)完全相同,该仪器是
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪 e.X-射线晶体衍射仪
(5)化合物C的六氯代物有
您最近一年使用:0次
2023-04-04更新
|
415次组卷
|
2卷引用:吉林省东北师范大学附属中学2021-2022学年高二下学期期中考试化学试题
名校
10 . 下列说法不正确的是
| A.C6H12表示的物质可能存在顺反异构体,也可能存在手性异构体 |
| B.C8H11N的同分异构体中含苯环且苯环上有两个取代基的结构有6种 |
| C.含有两个碳碳三键的脂肪烃C6H6,分子中6个碳原子不都在同一直线上的共有4种 |
| D.由环己烷、乙醇、乙醚(CH3CH2OCH2CH3)组成的混和物,经测定其中碳的质量分数为72%,则氧的质量分数约为14.2% |
您最近一年使用:0次
2023-04-04更新
|
1143次组卷
|
4卷引用:吉林省东北师范大学附属中学2021-2022学年高二下学期期中考试化学试题



