名校
1 . 南高实验学习小组经查阅资料发现:K2FeO4(Mr=198)为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。现将他们制备高铁酸钾(K2FeO4),测定其纯度并探究其性质的过程展示如下。
(1)制备K2FeO4(夹持装置略)
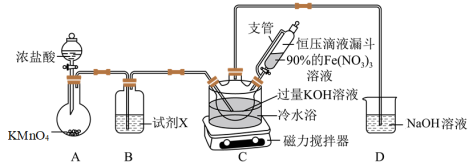
①A为氯气发生装置,盛KMnO4固体的仪器名称是___________ 。
②装置B中所用的试剂X为___________ 。
③装置C中首先制备KClO,然后在快速搅拌下将90%的Fe(NO3)3溶液分批加入装置C中,充分反应得K2FeO4固体,写出该反应的化学方程式___________ 。
(2)K2FeO4的纯度测定
向3mLCrCl3溶液中加入20mL饱和KOH溶液(Cr3++4OH-=CrO +2H2O),再加入5mL蒸馏水,冷却至室温,准确称取1.98g样品,加入上述溶液中使其溶解,充分反应(FeO
+2H2O),再加入5mL蒸馏水,冷却至室温,准确称取1.98g样品,加入上述溶液中使其溶解,充分反应(FeO +CrO
+CrO +2H2O=CrO
+2H2O=CrO +Fe(OH)3↓+OH-),过滤后加入稀硫酸酸化(2CrO
+Fe(OH)3↓+OH-),过滤后加入稀硫酸酸化(2CrO +2H+=Cr2O
+2H+=Cr2O +H2O),并加入1mL苯二胺磺酸钠作指示剂,用1.00mol/L的标准硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定(Cr2O
+H2O),并加入1mL苯二胺磺酸钠作指示剂,用1.00mol/L的标准硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定(Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O),至终点时,消耗(NH4)2Fe(SO4)2溶液的体积为27.00mL。则K2FeO4的质量分数为
+6Fe2++14H+=2Cr3++6Fe3++7H2O),至终点时,消耗(NH4)2Fe(SO4)2溶液的体积为27.00mL。则K2FeO4的质量分数为___________ (过程中杂质不参与反应)。
(3)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
Ⅰ.方案Ⅰ中溶液变红可知a中含有___________ 离子,但该离子的产生不能判断一定是K2FeO4被Cl-还原得到,还可能由___________ 产生(用离子反应方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-,用KOH溶液洗涤的目的是___________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2___________ FeO (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,盛KMnO4固体的仪器名称是
②装置B中所用的试剂X为
③装置C中首先制备KClO,然后在快速搅拌下将90%的Fe(NO3)3溶液分批加入装置C中,充分反应得K2FeO4固体,写出该反应的化学方程式
(2)K2FeO4的纯度测定
向3mLCrCl3溶液中加入20mL饱和KOH溶液(Cr3++4OH-=CrO
 +2H2O),再加入5mL蒸馏水,冷却至室温,准确称取1.98g样品,加入上述溶液中使其溶解,充分反应(FeO
+2H2O),再加入5mL蒸馏水,冷却至室温,准确称取1.98g样品,加入上述溶液中使其溶解,充分反应(FeO +CrO
+CrO +2H2O=CrO
+2H2O=CrO +Fe(OH)3↓+OH-),过滤后加入稀硫酸酸化(2CrO
+Fe(OH)3↓+OH-),过滤后加入稀硫酸酸化(2CrO +2H+=Cr2O
+2H+=Cr2O +H2O),并加入1mL苯二胺磺酸钠作指示剂,用1.00mol/L的标准硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定(Cr2O
+H2O),并加入1mL苯二胺磺酸钠作指示剂,用1.00mol/L的标准硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定(Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O),至终点时,消耗(NH4)2Fe(SO4)2溶液的体积为27.00mL。则K2FeO4的质量分数为
+6Fe2++14H+=2Cr3++6Fe3++7H2O),至终点时,消耗(NH4)2Fe(SO4)2溶液的体积为27.00mL。则K2FeO4的质量分数为(3)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,有Cl2产生。 |
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-,用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
2 . 某实验小组用下列装置制备高铁酸钾( K2FeO4 )并探究其性质,制备原理为:3Cl2+2Fe(OH)3+ 10KOH=2K2FeO4+6KCl+8H2O。(夹持装置略)
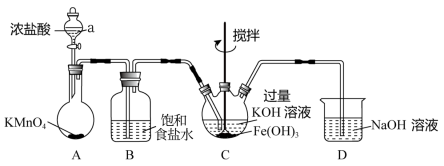
查阅资料:①K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2。②ClO-能将盐酸氧化成氯气。
I. K2FeO4的制备
(1)仪器a的名称为___________ ,D中的NaOH溶液可以用___________ 代替(填入对应字母)。
A.蒸馏水 B.澄清石灰水 C.石灰乳 D.饱和食盐水
(2)检验气体发生装置A气密性的方法是___________ ; 该装置中生成黄绿色气体的化学反应方程式为___________ 。
(3)制备K2FeO4需要在___________ (填“酸性”“碱性”或“中性”)环境中进行,根据上述K2FeO4的制备实验得出:氧化性Cl2___________ FeO (填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式
(填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式___________ 。
II.探究K2FeO4的性质
(4)实验方案:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液。取少量该溶液于试管中,滴加过量盐酸后发现有Cl2产生。
①为确保氧化Cl-的物质只能是FeO ,则用KOH溶液洗涤的目的是
,则用KOH溶液洗涤的目的是___________ 。
②由(4)的实验得出Cl2和FeO 的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是
的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是___________ 。

查阅资料:①K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2。②ClO-能将盐酸氧化成氯气。
I. K2FeO4的制备
(1)仪器a的名称为
A.蒸馏水 B.澄清石灰水 C.石灰乳 D.饱和食盐水
(2)检验气体发生装置A气密性的方法是
(3)制备K2FeO4需要在
 (填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式
(填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式II.探究K2FeO4的性质
(4)实验方案:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液。取少量该溶液于试管中,滴加过量盐酸后发现有Cl2产生。
①为确保氧化Cl-的物质只能是FeO
 ,则用KOH溶液洗涤的目的是
,则用KOH溶液洗涤的目的是②由(4)的实验得出Cl2和FeO
 的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是
的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是
您最近一年使用:0次
2022-01-15更新
|
332次组卷
|
2卷引用:四川省资阳市2021-2022学年高一上学期期末考试化学试题
解题方法
3 . 某种常见补铁药物的主要成分为琥珀酸亚铁。该药品不溶于水但能溶于常见稀酸。某学习小组同学分别设计实验检验药片中Fe2+的存在并测定Fe2+的含量(假设杂质不参与反应)。回答下列问题:
(1)甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是_______ (填编号)。
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为_______ 。
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为_______ 。
②步骤三中,加入H2O2溶液发生反应的离子方程式为_______ ,灼烧后 所得固体的颜色为 _______ ,灼烧时需要使用下列仪器中的 _______ (填编号)。
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是_______ 。
④由实验数据计算,每片药片中约含Fe2+_______ mg。
(3)医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的_______ (选填“氧化性”、“ 还原性”或“碱性”。)
(1)甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为
②步骤三中,加入H2O2溶液发生反应的离子方程式为
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是
④由实验数据计算,每片药片中约含Fe2+
(3)医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的
您最近一年使用:0次
名校
解题方法
4 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
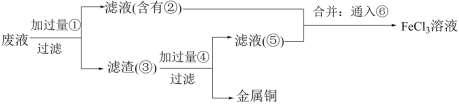
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
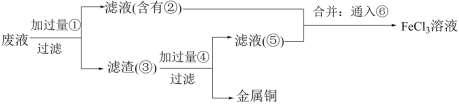
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
409次组卷
|
2卷引用:四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷
名校
解题方法
5 . 氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式:_______ 。
(2)苹果汁是人们喜欢的饮料。由于此饮料中含有 ,现榨的会由淡绿色(含
,现榨的会由淡绿色(含 )变为棕黄色(含
)变为棕黄色(含 )。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。
)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。
(3)焊接铜器时,可用 除去表面的
除去表面的 再进行焊接,该反应是:
再进行焊接,该反应是: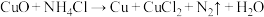
①配平该反应方程式_______ 。
②该反应的氧化产物是_______ 。氧化剂和还原剂的个数比是_______ 。
(4)一定条件下,分别以 、
、 、
、 为原料制取
为原料制取 ,当制得相同质量的
,当制得相同质量的 时,三个反应中转移的电子数目之比为
时,三个反应中转移的电子数目之比为_______ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式:
(2)苹果汁是人们喜欢的饮料。由于此饮料中含有
 ,现榨的会由淡绿色(含
,现榨的会由淡绿色(含 )变为棕黄色(含
)变为棕黄色(含 )。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。
)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
 除去表面的
除去表面的 再进行焊接,该反应是:
再进行焊接,该反应是: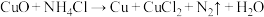
①配平该反应方程式
②该反应的氧化产物是
(4)一定条件下,分别以
 、
、 、
、 为原料制取
为原料制取 ,当制得相同质量的
,当制得相同质量的 时,三个反应中转移的电子数目之比为
时,三个反应中转移的电子数目之比为
您最近一年使用:0次
6 . 氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式:_______ 。
(2)苹果汁是人们喜欢的饮料。由于此饮料中含有Fe2+,现榨的会由淡绿色(含Fe2+)变为棕黄色(含Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。
(3)锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一、早在远古时代,人们便发现并使用锡了。在我国的一些古墓中,便常发掘到一些锡壶、锡烛台之类锡器。工业上冶炼锡的第一步反应原理为2SnO2+3C 2Sn+aM↑+CO2↑,a的数值为
2Sn+aM↑+CO2↑,a的数值为_______ ,发生还原反应的元素是_______ 。
(4)焊接铜器时,可用NH4Cl除去表面的CuO再进行焊接,该反应是: CuO+NH4Cl→ Cu+CuCl2+N2↑+H2O
①配平该反应方程式____CuO+ ___NH4Cl=___Cu+____CuCl2+_____N2↑+____H2O___
②该反应的氧化剂是_______ ,氧化产物是_______ 。氧化剂和还原剂的个数比是____ 。
(5)一定条件下,分别以KMnO4、KClO3、H2O2为原料制取O2,当制得相同质量的O2时,三个反应中转移的电子数目之比为_______ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式:
(2)苹果汁是人们喜欢的饮料。由于此饮料中含有Fe2+,现榨的会由淡绿色(含Fe2+)变为棕黄色(含Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
 2Sn+aM↑+CO2↑,a的数值为
2Sn+aM↑+CO2↑,a的数值为(4)焊接铜器时,可用NH4Cl除去表面的CuO再进行焊接,该反应是: CuO+NH4Cl→ Cu+CuCl2+N2↑+H2O
①配平该反应方程式____CuO+ ___NH4Cl=___Cu+____CuCl2+_____N2↑+____H2O
②该反应的氧化剂是
(5)一定条件下,分别以KMnO4、KClO3、H2O2为原料制取O2,当制得相同质量的O2时,三个反应中转移的电子数目之比为
您最近一年使用:0次
名校
解题方法
7 . 下列结论正确的是
①离子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦碱性:NaOH>KOH>RbOH>CsOH
①离子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦碱性:NaOH>KOH>RbOH>CsOH
| A.②④⑥ | B.②⑥⑦ | C.②④⑤⑥⑦ | D.②⑤⑦ |
您最近一年使用:0次
2022-04-03更新
|
205次组卷
|
3卷引用:四川省成都外国语学校2021-2022学年高一下学期3月月考化学试题
8 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
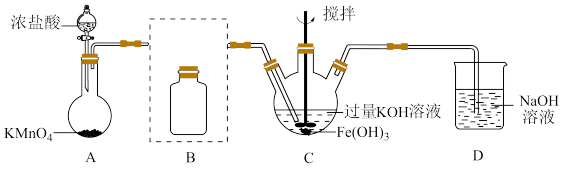
①A为氯气发生装置。A中反应方程式是________________ (锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。_______
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有________________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________ 产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2________  (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是________________ 。
③资料表明,酸性溶液中的氧化性 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:________________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是
②将除杂装置B补充完整并标明所用试剂。
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH
 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性
 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次
2018-06-09更新
|
9685次组卷
|
31卷引用:四川省遂宁市射洪中学2021-2022学年高一下学期第一次月考化学试题(强基班)
四川省遂宁市射洪中学2021-2022学年高一下学期第一次月考化学试题(强基班)(已下线)第07讲 铁及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第28讲 定性、定量实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)天津市耀华中学2023届高三第一次统练化学试题云南省玉溪市华宁县第二中学2021-2022年高一下学期开学考试化学试题2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题16 化学实验综合题(已下线)高考母题题源18 化学实验设计与探究(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)(已下线)2019年高考总复习巅峰冲刺-专题03 氧化还原反应 离子反应应试策略(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精讲)——2021年高考化学一轮复习讲练测高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 高考帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 高考帮河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题(已下线)易错22 气体实验装置的设计-备战2021年高考化学一轮复习易错题(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第7讲 铁及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向14 物质制备探究-备战2022年高考化学一轮复习考点微专题第三章 金属及其化合物 第14讲 铁及其化合物的转化关系(已下线)第一部分 化学综合实验 热点6 物质性质探究实验北京一零一中学2023-2024学年高一上学期11月统练三化学试卷河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题
9 . 学习小组在实验室中利用如图所示装置制备 并进行相关性质的探究。
并进行相关性质的探究。
Ⅰ.制备实验: 和NaClO溶液反应制取
和NaClO溶液反应制取 。
。

(1)装有 的装置名称
的装置名称_______
(2)③中分液漏斗盛放的试剂为_______ (填化学式)
(3)制备 的离子方程式为
的离子方程式为_______
Ⅱ.探究实验:探究 的还原性和碱性。将制得的分离提纯后,进行如图实验:
的还原性和碱性。将制得的分离提纯后,进行如图实验:

[查阅资料]AgOH在溶液中不稳定易分解生成黑色的 ,
, 可溶于氨水。
可溶于氨水。
[提出假设]黑色固体可能是Ag、 中的一种或两种。
中的一种或两种。
[实验验证]设计如下方案,进行实验,
(4)请完成下表中的空白部分、
(5)实验表明,黑色固体主要是Ag,还有少量的 ,请解释产生
,请解释产生 的原因
的原因_______
(6)在制备实验中,需要先打开⑤的酒精灯,待得到饱和氨水后,再打开分液漏斗滴加少量溶液。请结合物质性质说明该操作的目的_______
 并进行相关性质的探究。
并进行相关性质的探究。Ⅰ.制备实验:
 和NaClO溶液反应制取
和NaClO溶液反应制取 。
。
(1)装有
 的装置名称
的装置名称(2)③中分液漏斗盛放的试剂为
(3)制备
 的离子方程式为
的离子方程式为Ⅱ.探究实验:探究
 的还原性和碱性。将制得的分离提纯后,进行如图实验:
的还原性和碱性。将制得的分离提纯后,进行如图实验:
[查阅资料]AgOH在溶液中不稳定易分解生成黑色的
 ,
, 可溶于氨水。
可溶于氨水。[提出假设]黑色固体可能是Ag、
 中的一种或两种。
中的一种或两种。[实验验证]设计如下方案,进行实验,
(4)请完成下表中的空白部分、
| 实验编号 | 操作 | 现象 | 实验结论 |
| 1 | 取少量黑色固体于试管,① | 黑色固体不溶解 | 黑色固体是Ag |
| 2 | 操作步骤同实验1 | 黑色固体完全溶解 | 黑色固体是 |
| 3 | i取少量黑色固体于试管中,加入适量氨水,振荡,静置,取上层清液于洁净试管中,加入几滴乙醛,水浴加热;ii取少量黑色固体于试管中,加入足量稀硝酸,振荡。 | i试管内壁有银镜生成ii② | 黑色固体是Ag和 |
 ,请解释产生
,请解释产生 的原因
的原因(6)在制备实验中,需要先打开⑤的酒精灯,待得到饱和氨水后,再打开分液漏斗滴加少量溶液。请结合物质性质说明该操作的目的
您最近一年使用:0次
2022-05-07更新
|
158次组卷
|
2卷引用:四川省内江市第六中学2021-2022学年高二下学期第一次月考化学试题
名校
10 . 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
Ⅰ.制备N2H4
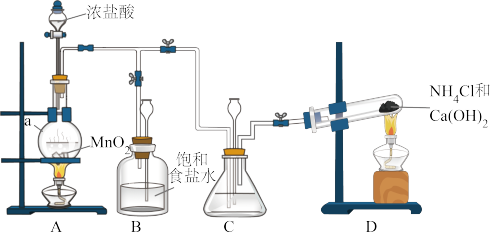
(1)仪器a的名称是___________ 。
(2)装置C中盛放的试剂是___________ 。装置B的作用是___________ 。
(3)制备N2H4的离子方程式为___________ 。
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
(4)称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
①滴定到达终点的现象是___________ 。
②实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合腓的质量分数为___________ 。
Ⅲ.探究的还原性与碱性。将制得的耕分离提纯后,进行如图实验。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
(5)请完成表中的空白部分:①___________ ;②___________ 。
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:___________ 。
Ⅰ.制备N2H4

(1)仪器a的名称是
(2)装置C中盛放的试剂是
(3)制备N2H4的离子方程式为
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
(4)称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
①滴定到达终点的现象是
②实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合腓的质量分数为
Ⅲ.探究的还原性与碱性。将制得的耕分离提纯后,进行如图实验。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
| 操作 | 现象 | 实验结论 |
| i.取少量黑色固体于试管中,加入适量①_________ | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii.取少量黑色固体于试管中加入足量稀硝酸,振荡 | ②_________ | 黑色固体是Ag和Ag2O |
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:
您最近一年使用:0次
2022-03-29更新
|
833次组卷
|
6卷引用:四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题
四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题山西省太原市2022届高三下学期模拟考试(一模)理科综合化学试题(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16化学实验综合题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)四川省绵阳市高中2022-2023学年高二下学期理科突击班6月月考化学试题



