名校
解题方法
1 . 甘氨酸亚铁[ (H2NCH2COO)2Fe]是一种补血剂,工业上用赤铁矿(含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
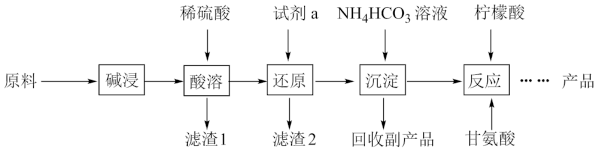
已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
回答下列问题:
(1)“碱浸”去除的元素是_________ , “滤渣1”是_________ (填化学式)
(2)“'还原”时的还原产物是_________ 。
(3)“沉淀”的离子方程式_________ ,“副产品”是_________ (写名称)
(4)柠檬酸的作用防止Fe2+氧化,“反应”的化学方程式为_________ 。
(5)FeSO4·7H2O也是一种常用的补血剂, 在空气中易变质,检验其是否变质的试剂是_________ ,某同学通过如下实验测定该补血剂中Fe2+的含量:
①配制:用分析天平称取1. 4000gFeSO4·7H2O样品,再用煮沸并冷却的蒸馏水配制100mL溶液。配制时还需要的定量仪器是_________ 。
②滴定:用酸化的KMnO4溶液滴定
用移液管移取25. 00mLFeSO4溶液于锥形瓶中,用0. 0100mol·L-1的KMnO4,溶液滴定,平行滴定3次,KMnO4溶液的平均用量为24. 00mL,则样品Fe2+的含量为________ % (保留2位小数) 。

已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
回答下列问题:
(1)“碱浸”去除的元素是
(2)“'还原”时的还原产物是
(3)“沉淀”的离子方程式
(4)柠檬酸的作用防止Fe2+氧化,“反应”的化学方程式为
(5)FeSO4·7H2O也是一种常用的补血剂, 在空气中易变质,检验其是否变质的试剂是
①配制:用分析天平称取1. 4000gFeSO4·7H2O样品,再用煮沸并冷却的蒸馏水配制100mL溶液。配制时还需要的定量仪器是
②滴定:用酸化的KMnO4溶液滴定
用移液管移取25. 00mLFeSO4溶液于锥形瓶中,用0. 0100mol·L-1的KMnO4,溶液滴定,平行滴定3次,KMnO4溶液的平均用量为24. 00mL,则样品Fe2+的含量为
您最近一年使用:0次
2022-08-08更新
|
993次组卷
|
7卷引用:四川省达州市普通高中2022届高三第一次诊断性测试理综化学试题
四川省达州市普通高中2022届高三第一次诊断性测试理综化学试题四川省资中县球溪高级中学2022-2023学年高三上学期10月月考化学试题四川省达州市2021-2022学年高三上学期第一次诊断考试理科综合化学试题(已下线)专题讲座(八) 无机化工流程题的解题策略(讲)-2023年高考化学一轮复习讲练测(全国通用)内蒙古自治区霍林郭勒市第一中学2022-203学年高三上学期9月月考化学试题(已下线)易错点06 铁及其化合物-备战2023年高考化学考试易错题宁夏回族自治区中卫市中宁县第一中学2022-2023学年高三上学期10月月考化学试题
2 . 下列实验方案中,能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 比较CH3COOH和HClO的酸性 | 用pH试纸测定同浓度的两溶液的pH值 |
| B | 检验Fe(NO3)2晶体是否变质 | 将样品溶于稀硫酸,滴入几滴KSCN溶液 |
| C | 除去乙酸乙酯中的少量乙酸 | 加入过量饱和Na2CO3溶液洗涤后分液 |
| D | 除去乙烯中少量的二氧化硫 | 将混合气体通过足量酸性KMnO4溶液洗气 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其中结论正确的是
| A.若滴加KSCN溶液,溶液变红,说明铁粉变质 |
| B.若滴加KSCN溶液,溶液未变红,说明铁粉未变质 |
| C.若依次滴加氯水,KSCN溶液,溶液变红,说明铁粉全部变质 |
| D.若滴加KSCN溶液,溶液未变红;再滴加氯水,溶液变红,说明铁粉全部变质 |
您最近一年使用:0次
2022-02-27更新
|
1449次组卷
|
24卷引用:四川省绵阳南山中学2022-2023学年高一上学期期末模拟化学试题
四川省绵阳南山中学2022-2023学年高一上学期期末模拟化学试题第一节 铁及其化合物 第2课时 铁盐、亚铁盐内蒙古包头市2021-2022学年高一上学期期末考试化学试题辽宁省沈阳市2021-2022学年高一上学期期末质量监测化学试题2广东省化州市第一中学2020-2021学年高一上学期期末考试化学试题北京市北京师范大学第二附属中学2022-2023学年高一上学期12月月考化学试题天津市南开中学2022-2023学年高一上学期期末考试化学试题广东省东莞市南城开心实验学校2022-2023学年高一上学期12月半月考化学试题四川省宜宾市第四中学校2023-2024学年高一上学期1月期末化学试题四川省江油市太白中学2023-2024学年高一上学期第三次月考化学试题天津市红桥区2020-2021学年高三上学期期中考试化学试题湖南省株洲世纪星高级中学2022-2023学年高一上学期期末考试化学试题广东省广州中学2022-2023学年高一上学期期末考试化学试题吉林市田家炳高级中学2022-2023学年高一上学期期末考试化学试题内蒙古赤峰市红山区2022-2023学年高一上学期期末质量检测化学试题内蒙古包头市2022-2023学年高一上学期期末考试化学试题内蒙古呼伦贝尔市满洲里市第一中学2022-2023学年高一下学期第一次月考化学试题湖南省长沙市珺琟高级中学2023-2024学年高一上学期第二次月考化学试题 云南省昆明市五华区2023-2024学年高一上学期1月期末化学试题天津市静海区第一中学2023-2024学年高一上学期12月月考化学试题浙江省丽水市三校联考2023-2024学年高一上学期12月月考化学试题湖南省常德石门一中2023-2024年上学期高一年级化学期末考试卷(适用湖南地区))湖南省长沙市长郡中学2023-2024学年高一下学期选科适应性检测化学试卷河南省开封市联考2023-2024学年高一上学期1月期末化学试题
4 . I.用下图装置制取SO2并验证SO2的某些性质。回答下列问题:
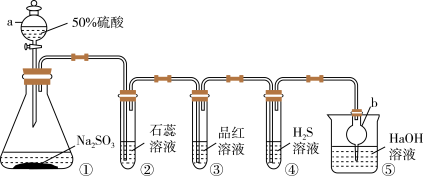
(1)仪器a的名称是___________ ,仪器b的作用是___________ ;
(2)装置②中的实验现象是___________ 。反应结束后,对装置③的试管加热可观察到的现象是___________ ;
(3)装置④中发生反应的化学方程式为___________ ,在该反应中氧化产物与还原产物物质的量之比为___________ ;
(4)SO2可用于杀菌、消毒。葡萄酒里含有微量SO2,起保鲜、杀菌和抗氧化作用,其中抗氧化作用是利用了SO2的___________ 性。氯水和SO2都有漂白性,有人为增强漂白效果,将Cl2和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:___________ 。
Ⅱ.完成下列问题
(5)实验室需配制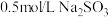 溶液230mL,现需要用托盘天平称取
溶液230mL,现需要用托盘天平称取 晶体
晶体___________ g,配制溶液所用到的玻璃仪器有:玻璃棒、烧杯、量筒和___________ 。
(6)配置过程中所用蒸馏水需煮沸、冷却后才能使用,煮沸蒸馏水的目的是___________ 。
(7)下列操作会使所配溶液浓度偏高的是___________。
(8) 放在空气中容易被氧化变质。检验
放在空气中容易被氧化变质。检验 溶液是否变质的方法是
溶液是否变质的方法是___________ 。

(1)仪器a的名称是
(2)装置②中的实验现象是
(3)装置④中发生反应的化学方程式为
(4)SO2可用于杀菌、消毒。葡萄酒里含有微量SO2,起保鲜、杀菌和抗氧化作用,其中抗氧化作用是利用了SO2的
Ⅱ.完成下列问题
(5)实验室需配制
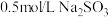 溶液230mL,现需要用托盘天平称取
溶液230mL,现需要用托盘天平称取 晶体
晶体(6)配置过程中所用蒸馏水需煮沸、冷却后才能使用,煮沸蒸馏水的目的是
(7)下列操作会使所配溶液浓度偏高的是___________。
| A.所选用的溶质已经失去部分结晶水 |
| B.转移溶液时玻璃棒靠在刻度线上方 |
| C.定容时俯视容量瓶的刻度线 |
| D.摇匀后溶液低于刻度线,再加入蒸馏水使液面最低点与刻度线相切 |
 放在空气中容易被氧化变质。检验
放在空气中容易被氧化变质。检验 溶液是否变质的方法是
溶液是否变质的方法是
您最近一年使用:0次
名校
5 . 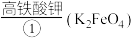 是一种高效多功能的新型绿色消毒剂。制备高铁酸钾的方法如下:将
是一种高效多功能的新型绿色消毒剂。制备高铁酸钾的方法如下:将 通入
通入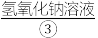 中生成饱和
中生成饱和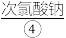 浓碱溶液,缓慢加入
浓碱溶液,缓慢加入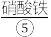 反应生成
反应生成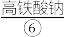 ,用
,用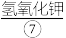 其转化成高铁酸钾,过滤得粗品,再用氢氧化钾溶液溶解,蒸发浓缩,冷却结晶。再用
其转化成高铁酸钾,过滤得粗品,再用氢氧化钾溶液溶解,蒸发浓缩,冷却结晶。再用 和
和 进行脱碱、
进行脱碱、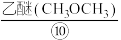 洗涤,干燥制得高铁酸钾。可用如图表示
洗涤,干燥制得高铁酸钾。可用如图表示 的制备过程:
的制备过程:
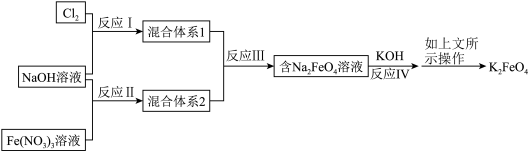
请回答下列问题:
(1)写出 的电离方程式:
的电离方程式:___________ 。
(2)配平反应Ⅲ的离子方程式:______________ 。
____ ____
____ _____□
_____□ ____
____ _____
_____ ______
______
充分反应后,含 的溶液中一定还含有的盐
的溶液中一定还含有的盐___________ 。(填化学式)
(3)对于高铁酸钾制备流程的描述,下列分析正确的是___________。(填序号)
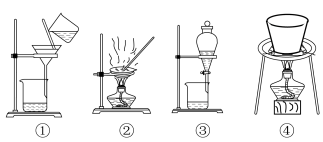
(4)实验室模拟制备 时,一定要用到的下列装置有
时,一定要用到的下列装置有___________ 。(填序号)
(5)作为新型绿色消毒剂,高铁酸钾在水中能够大量释放活性氧有效灭菌,同时生成的还原产物可以吸附水中的悬浮性杂质而聚沉。为了测定高铁酸钾产品纯度,进行如下实验:
步骤1:取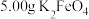 样品溶于足量稀硫酸中,溶液呈黄色,发生反应如下
样品溶于足量稀硫酸中,溶液呈黄色,发生反应如下___________ (离子反应方程式)。
步骤2:向反应后的溶液加足量的 溶液,发生反应:
溶液,发生反应: ;
;
步骤3:生成的 共消耗
共消耗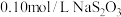 标准溶液
标准溶液 :发生反应:
:发生反应: 。则该高铁酸钾产品的纯度为
。则该高铁酸钾产品的纯度为___________ 。(计算结果保留小数点后一位)
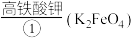 是一种高效多功能的新型绿色消毒剂。制备高铁酸钾的方法如下:将
是一种高效多功能的新型绿色消毒剂。制备高铁酸钾的方法如下:将 通入
通入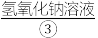 中生成饱和
中生成饱和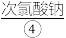 浓碱溶液,缓慢加入
浓碱溶液,缓慢加入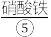 反应生成
反应生成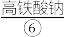 ,用
,用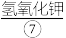 其转化成高铁酸钾,过滤得粗品,再用氢氧化钾溶液溶解,蒸发浓缩,冷却结晶。再用
其转化成高铁酸钾,过滤得粗品,再用氢氧化钾溶液溶解,蒸发浓缩,冷却结晶。再用 和
和 进行脱碱、
进行脱碱、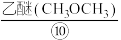 洗涤,干燥制得高铁酸钾。可用如图表示
洗涤,干燥制得高铁酸钾。可用如图表示 的制备过程:
的制备过程:
请回答下列问题:
(1)写出
 的电离方程式:
的电离方程式:(2)配平反应Ⅲ的离子方程式:
____
 ____
____ _____□
_____□ ____
____ _____
_____ ______
______充分反应后,含
 的溶液中一定还含有的盐
的溶液中一定还含有的盐(3)对于高铁酸钾制备流程的描述,下列分析正确的是___________。(填序号)
| A.物质①~⑩中,③和⑨为一类,理由是它们属于混合物 |
| B.物质①~⑩中,②、⑧和①属于非电解质 |
| C.反应Ⅱ和反应Ⅳ属于不同的基本反应类型 |
| D.相同温度下,高铁酸钾的溶解度比高铁酸钠小 |
(4)实验室模拟制备
 时,一定要用到的下列装置有
时,一定要用到的下列装置有
(5)作为新型绿色消毒剂,高铁酸钾在水中能够大量释放活性氧有效灭菌,同时生成的还原产物可以吸附水中的悬浮性杂质而聚沉。为了测定高铁酸钾产品纯度,进行如下实验:
步骤1:取
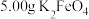 样品溶于足量稀硫酸中,溶液呈黄色,发生反应如下
样品溶于足量稀硫酸中,溶液呈黄色,发生反应如下步骤2:向反应后的溶液加足量的
 溶液,发生反应:
溶液,发生反应: ;
;步骤3:生成的
 共消耗
共消耗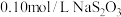 标准溶液
标准溶液 :发生反应:
:发生反应: 。则该高铁酸钾产品的纯度为
。则该高铁酸钾产品的纯度为
您最近一年使用:0次
名校
解题方法
6 . 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
氯化铁:熔点为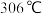 ,沸点为
,沸点为 ;易吸收空气中的水分而潮解。工业上采用向
;易吸收空气中的水分而潮解。工业上采用向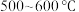 的铁粉中通入氯气来生产无水氯化铁。
的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点为 ,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)在装置A中,用 与浓盐酸反应制取氯气,写出反应的化学方程式并用双线桥法来表示出电子转移的方向和数目
与浓盐酸反应制取氯气,写出反应的化学方程式并用双线桥法来表示出电子转移的方向和数目__________ ,当生成 氯气,做还原剂的
氯气,做还原剂的 的物质的量为
的物质的量为__________  。
。
(2)C放置在盛冷水的水槽中,水浴的作用是____________________ 。
(3)仪器D的名称是__________ ,D中装的药品可以是__________ (填序号)
A. B.碱石灰 C.
B.碱石灰 C. D.
D.
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有 ,可用下列试剂中的__________进行检测。(填序号,试剂不组合使用)
,可用下列试剂中的__________进行检测。(填序号,试剂不组合使用)
(5)定量分析。取装置C中的产物,按以下步骤进行测定:①称取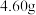 产品溶于过量的稀盐酸中;②加入足量
产品溶于过量的稀盐酸中;②加入足量 溶液;③再加入足量
溶液;③再加入足量 溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为
溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为 。写出加入足量
。写出加入足量 溶液中发生反应的离子方程式
溶液中发生反应的离子方程式__________ 计算该样品中铁元素的质量分数为__________ %(结果精确到小数点后两位)。
(6)由(5)定量分析数据得出结论,并提出改进措施。
①对比氯化铁中铁元素的质量分数为34.46%,说明含有 杂质。
杂质。
②若要得到较纯净的无水氯化铁,实验装置可进行的改进措施是__________ 。
氯化铁:熔点为
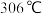 ,沸点为
,沸点为 ;易吸收空气中的水分而潮解。工业上采用向
;易吸收空气中的水分而潮解。工业上采用向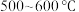 的铁粉中通入氯气来生产无水氯化铁。
的铁粉中通入氯气来生产无水氯化铁。氯化亚铁:熔点为
 ,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)在装置A中,用
 与浓盐酸反应制取氯气,写出反应的化学方程式并用双线桥法来表示出电子转移的方向和数目
与浓盐酸反应制取氯气,写出反应的化学方程式并用双线桥法来表示出电子转移的方向和数目 氯气,做还原剂的
氯气,做还原剂的 的物质的量为
的物质的量为 。
。(2)C放置在盛冷水的水槽中,水浴的作用是
(3)仪器D的名称是
A.
 B.碱石灰 C.
B.碱石灰 C. D.
D.
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有
 ,可用下列试剂中的__________进行检测。(填序号,试剂不组合使用)
,可用下列试剂中的__________进行检测。(填序号,试剂不组合使用)A. 溶液 溶液 | B.酸性 溶液 溶液 | C. 溶液 溶液 | D. 淀粉溶液 淀粉溶液 |
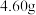 产品溶于过量的稀盐酸中;②加入足量
产品溶于过量的稀盐酸中;②加入足量 溶液;③再加入足量
溶液;③再加入足量 溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为
溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为 。写出加入足量
。写出加入足量 溶液中发生反应的离子方程式
溶液中发生反应的离子方程式(6)由(5)定量分析数据得出结论,并提出改进措施。
①对比氯化铁中铁元素的质量分数为34.46%,说明含有
 杂质。
杂质。②若要得到较纯净的无水氯化铁,实验装置可进行的改进措施是
您最近一年使用:0次
2023-01-10更新
|
357次组卷
|
3卷引用:四川省成都市第七中学2022-2023学年高一上学期12月月考化学试题
名校
解题方法
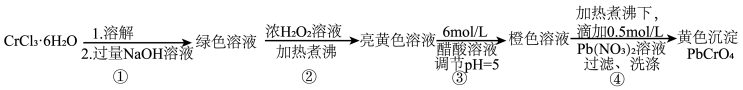
7 . 铅铬黄是一种颜料,主要成分是铬酸铅 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
回答下列问题:
(1)已知 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是_______ 。
(2)第②步生成了 ,写出该步骤的离子方程式
,写出该步骤的离子方程式_______ 。为了使 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是_______ (填序号)。
A.首先加热绿色溶液,然后将一定量 浓溶液滴入其中
浓溶液滴入其中
B.首先加热 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中
C.首先将一定量 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸
(3)第③步调节pH=5的目的是为了将 转化为
转化为_______ (填写离子符号),并且防止在碱性条件下_______ 形成沉淀。
(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:_______ 。
(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为 ,再用
,再用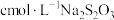 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=_______ (用含c、m和V的式子表示)。
 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
回答下列问题:
(1)已知
 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是(2)第②步生成了
 ,写出该步骤的离子方程式
,写出该步骤的离子方程式 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是A.首先加热绿色溶液,然后将一定量
 浓溶液滴入其中
浓溶液滴入其中B.首先加热
 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中C.首先将一定量
 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸(3)第③步调节pH=5的目的是为了将
 转化为
转化为(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加
 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为
 ,再用
,再用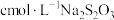 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
您最近一年使用:0次
2022-08-30更新
|
242次组卷
|
2卷引用:四川省成都市第七中学2023届高三上学期入学考试化学试题
解题方法
8 . A~F六种物质的转化关系如图所示(部分反应物、产物和反应条件未写出),其中A为单质,B常用来作为潜水艇和呼吸面具中氧气来源,物质A到F的焰色试验均呈黄色。回答下列问题:
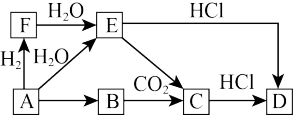
(1)该转化过程中A→B可以在热坩埚中进行,其现象为_______ ,化学反应方程式为_______ 。
(2)写出A→E的化学方程式并用单线桥标出电子转移的方向和数目_______ 。
(3)C的化学式为_______ ,向C的饱和溶液中通入足量 ,可观察到的现象是
,可观察到的现象是_______ 。
(4)F→E的化学方程式为_______ ,其中氧化剂是_______ (填化学式)。
(5)下列关于焰色试验说法错误的是_______(填标号)

(1)该转化过程中A→B可以在热坩埚中进行,其现象为
(2)写出A→E的化学方程式并用单线桥标出电子转移的方向和数目
(3)C的化学式为
 ,可观察到的现象是
,可观察到的现象是(4)F→E的化学方程式为
(5)下列关于焰色试验说法错误的是_______(填标号)
| A.焰色试验时可以用洁净的铜丝来代替铂丝进行实验 |
| B.某样品做焰色试验时,直接观察到火焰呈黄色,可以确定该样品中不含钾元素 |
| C.节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽的色彩 |
| D.焰色试验是元素的一种物理性质,属于物理变化 |
您最近一年使用:0次
2022-11-03更新
|
346次组卷
|
3卷引用:四川省成都市四县区(金堂、大邑、蒲江、新津)2022-2023学年高一上学期期中联考化学试题
名校
解题方法
9 . 现使用酸碱中和滴定法测定市售白醋的总酸量 [g/100mL]。
(1)用_______ (填仪器名称,下同)量取 食用白醋,在烧杯中用水稀释后转移到
食用白醋,在烧杯中用水稀释后转移到 容量瓶中定容,摇匀即得待测白醋溶液。
容量瓶中定容,摇匀即得待测白醋溶液。
(2)取待测白醋溶液 于锥形瓶中,向其中滴加2滴
于锥形瓶中,向其中滴加2滴_______ 作指示剂。
(3)读取盛装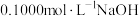 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为
溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为_______  。
。

(4)滴定。当_______ 时,停止滴定,并记录 溶液的终读数。重复滴定3次。
溶液的终读数。重复滴定3次。
(5)该市售白醋的总酸量_______ 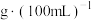 。
。
(6)在本实验的滴定过程中,下列操作会使实验结果偏小的是_______。
(7)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将 血液用蒸馏水稀释后,向其中加入足量草酸铵
血液用蒸馏水稀释后,向其中加入足量草酸铵 晶体,反应生成
晶体,反应生成 沉淀,将沉淀用稀硫酸处理得
沉淀,将沉淀用稀硫酸处理得 溶液。
溶液。
②将①得到的 溶液,再用酸性
溶液,再用酸性 溶液滴定,氧化产物为
溶液滴定,氧化产物为 ,还原产物为
,还原产物为 。
。
③终点时用去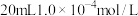 的
的 溶液。
溶液。
通过计算可知,血液中含钙离子的浓度为_______  。
。
(1)用
 食用白醋,在烧杯中用水稀释后转移到
食用白醋,在烧杯中用水稀释后转移到 容量瓶中定容,摇匀即得待测白醋溶液。
容量瓶中定容,摇匀即得待测白醋溶液。(2)取待测白醋溶液
 于锥形瓶中,向其中滴加2滴
于锥形瓶中,向其中滴加2滴(3)读取盛装
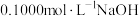 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为
溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为 。
。
(4)滴定。当
 溶液的终读数。重复滴定3次。
溶液的终读数。重复滴定3次。| 滴定次数 | 1 | 2 | 3 | 4 |
| V样品(mL) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)消耗 (mL) | 15.95 | 15.00 | 15.05 | 14.95 |
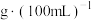 。
。(6)在本实验的滴定过程中,下列操作会使实验结果偏小的是_______。
A.碱式滴定管在滴定时用标准 溶液润洗 溶液润洗 |
| B.酸式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失 |
| C.锥形瓶中加入待测白醋溶液后,再加少量水 |
| D.锥形瓶在滴定时剧烈摇动,有少量液体溅出 |
①可将
 血液用蒸馏水稀释后,向其中加入足量草酸铵
血液用蒸馏水稀释后,向其中加入足量草酸铵 晶体,反应生成
晶体,反应生成 沉淀,将沉淀用稀硫酸处理得
沉淀,将沉淀用稀硫酸处理得 溶液。
溶液。②将①得到的
 溶液,再用酸性
溶液,再用酸性 溶液滴定,氧化产物为
溶液滴定,氧化产物为 ,还原产物为
,还原产物为 。
。③终点时用去
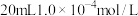 的
的 溶液。
溶液。通过计算可知,血液中含钙离子的浓度为
 。
。
您最近一年使用:0次
10 . 兰尼镍(Raney-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,常用作烯烃、炔烃等氢化反应催化剂,其高催化活性源自于镍本身的催化性质和其多孔结构对氢气的强吸附性。由镍矿渣(主要含Ni(OH)2、NiS,还含铁、铜、钙、镁化合物及其他不溶性杂质)制备兰尼镍的过程可表示如下:

已知:①Ksp(NiS)=1.07×10-21,Ksp(CuS)=1.27×10-26
②室温下,金属离子的沉淀pH范围如表:
(1)“酸溶”前将镍矿渣粉碎的目的是_______ 。
(2)“酸溶”过程中,NiS发生反应的离子方程式为_______ 。
(3)“除杂”过程分步进行,除铁时所调pH范围为_______ ,除铜时加入NiS发生的反应:NiS(s)+Cu2+(aq)=CuS(s)+Ni2+(aq),该反应的平衡常数K=_______ (保留三位有效数字)。
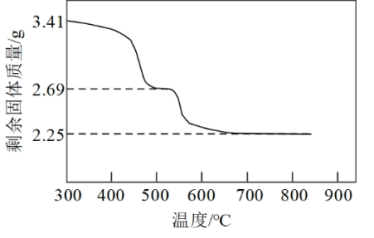
(4)“沉镍”所得沉淀有多种组成,可表示为xNiCO3•yNi(OH)2•zH2O。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(500℃~700℃条件下收集到的气体产物只有一种,700℃以上残留固体为NiO)。通过计算确定该样品的化学式为_______ 。
(5)“浸出”是制备兰尼镍的关键步骤,NaOH溶液在“浸出”过程中的作用是_______ 。
(6)使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应,原因是_____ 。

已知:①Ksp(NiS)=1.07×10-21,Ksp(CuS)=1.27×10-26
②室温下,金属离子的沉淀pH范围如表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 7.5 | 9.0 |
| Fe3+ | 2.2 | 3.2 |
| Ni2+ | 7.2 | 8.7 |
| Cu2+ | 5.6 | 6.7 |
| Mg2+ | 9.4 | 12.4 |
(2)“酸溶”过程中,NiS发生反应的离子方程式为
(3)“除杂”过程分步进行,除铁时所调pH范围为
(4)“沉镍”所得沉淀有多种组成,可表示为xNiCO3•yNi(OH)2•zH2O。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(500℃~700℃条件下收集到的气体产物只有一种,700℃以上残留固体为NiO)。通过计算确定该样品的化学式为

(5)“浸出”是制备兰尼镍的关键步骤,NaOH溶液在“浸出”过程中的作用是
(6)使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应,原因是
您最近一年使用:0次



