名校
1 . 某兴趣小组为探究浓硫酸与铜的反应,设计了如下装置。_______ 。
(2)为验证品红被 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象_______ 。
(3)浸NaOH溶液的棉团作用是_______ 。
(4)为进一步探究 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)
①查阅资料 不同浓度的 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的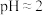 。
。
②提出猜想 猜想1: 被
被 氧化
氧化
猜想2: 在酸性条件下被
在酸性条件下被 氧化
氧化
猜想3:_______
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、 和
和 固体
固体
④交流讨论 小组同学认为,综合上述两个实验不足以证明猜想3成立。
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:_______ (只需提供设计思路,不需要写出具体操作步骤)。

(2)为验证品红被
 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象(3)浸NaOH溶液的棉团作用是
(4)为进一步探究
 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)①查阅资料 不同浓度的
 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的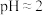 。
。②提出猜想 猜想1:
 被
被 氧化
氧化猜想2:
 在酸性条件下被
在酸性条件下被 氧化
氧化猜想3:
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、
 和
和 固体
固体| 实验步骤 | 实验现象和结论 |
| 实验1:取少量反应后的上层清液于试管中,滴入少量 | 出现 与 与 发生的离子方程式为 发生的离子方程式为 |
实验2:往图中的装置中加入100mL 固体,再通入过量 固体,再通入过量 。 。 | 出现白色沉淀,说明猜想2成立。 |
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:
您最近一年使用:0次
2022-04-29更新
|
1052次组卷
|
7卷引用:四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题
四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题热点1实验方案设计(已下线)化学-2023年高考押题预测卷03(广东卷)(含考试版、全解全析、参考答案、答题卡)2024届四川省攀枝花市第十五中学校高三上学期12月第7次半月考理科综合试题-高中化学广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题
解题方法
2 . 84消毒液是一种常见的含氯消海剂。如图为某品牌84消毒液的说明书中的部分内容。
(1)常温将氯气通入氢氧化钠溶液可制得84消毒液的主要成分,写出相应离子方程式______________ 。
(2)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化-还原性,ORP值越大,氧化性越强。
Ⅰ.向2 mL 84消毒液中加入2 mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。
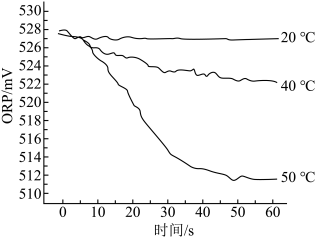
①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是_______________________ 。
②实验Ⅲ不同温度时ORP值不同的原因可能是____________________ 。
(3)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生O2的促进藻类快速生长。写出该反应的化学方程式_________________ 。
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生如下反应: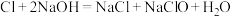 ;
;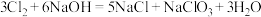 。经测定ClO-与
。经测定ClO-与 的数目之比为1∶3,则氯气与氢氧化钠溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为
的数目之比为1∶3,则氯气与氢氧化钠溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为___________ 。
| 产品特点: 本品是以次氯钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。 注意事项: 1.本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。 2.不得将本品与酸性产品(如洁厕类清洁产品)同时使用。 3.置于避光、阴凉处保存。 |
(1)常温将氯气通入氢氧化钠溶液可制得84消毒液的主要成分,写出相应离子方程式
(2)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化-还原性,ORP值越大,氧化性越强。
Ⅰ.向2 mL 84消毒液中加入2 mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。

①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是
②实验Ⅲ不同温度时ORP值不同的原因可能是
(3)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生O2的促进藻类快速生长。写出该反应的化学方程式
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生如下反应:
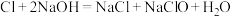 ;
;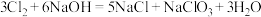 。经测定ClO-与
。经测定ClO-与 的数目之比为1∶3,则氯气与氢氧化钠溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为
的数目之比为1∶3,则氯气与氢氧化钠溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为
您最近一年使用:0次
3 . 某学习小组将酚酞试液滴入Na2O2与水反应后的溶液中,发现溶液先变红后迅速褪色,为探究原因,查阅资料后做了分析和实验。
【查阅资料】
①Na2O2与水反应先生成H2O2,然后H2O2分解;
②H2O2类似于二元弱酸,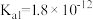 ,且具有强氧化性;
,且具有强氧化性;
③酚酞在 的溶液中变为无色。
的溶液中变为无色。
(1)探究一:褪色原因
【提出猜想】
假设一:反应产生的O2将酚酞氧化;
假设二:反应产生的H2O2将酚酞氧化;
假设三:NaOH溶液浓度过高导致酚酞试液褪色。
实验如下表,请填写空白:
【提出猜想】
(2)针对假设二,有同学提出还应补充实验才能证明Na2O2与水反应生成了 H2O2,则补充的实验操作为:________
(3)探究二:H2O2的性质及应用
①H2O2的酸性
用化学用语表示H2O2显酸性的原因______ 。
②H2O2的还原性
某实验用量筒量取浓H2O2溶液配制 溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有
溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有______ 。现用 酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:
酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:______ ,标定的H2O2溶液浓度为______  。
。
③若滴定时出现以下情况,将导致测定结果偏高的是______ 。
A.装入标准酸性KMnO4溶液时,未润洗滴定管
B.滴入最后半滴标准液出现颜色变化就立即停止滴定
C.滴定前盛标准液的滴定管尖嘴处有气泡,滴定后气泡消失
D.记录标准液体积时,滴定前仰视读数,滴定后俯视读数
【查阅资料】
①Na2O2与水反应先生成H2O2,然后H2O2分解;
②H2O2类似于二元弱酸,
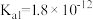 ,且具有强氧化性;
,且具有强氧化性;③酚酞在
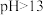 的溶液中变为无色。
的溶液中变为无色。
(1)探究一:褪色原因
【提出猜想】
假设一:反应产生的O2将酚酞氧化;
假设二:反应产生的H2O2将酚酞氧化;
假设三:NaOH溶液浓度过高导致酚酞试液褪色。
实验如下表,请填写空白:
| 实验编号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 在5mLpH=10的NaOH溶液中滴加5滴酚酞试液,再通入足量O2 | 溶液变红后不褪色 | 假设一: |
| ② | 在5mLpH=10的NaOH溶液中滴加5滴酚酞试液,再滴加1mL3%的H2O2溶液 | 假设二:成立 | |
| ③ | 在5mL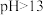 的NaOH溶液中滴加5滴酚酞试液 的NaOH溶液中滴加5滴酚酞试液 | 溶液先变红,后褪色 | 假设三:成立 |
【提出猜想】
(2)针对假设二,有同学提出还应补充实验才能证明Na2O2与水反应生成了 H2O2,则补充的实验操作为:
(3)探究二:H2O2的性质及应用
①H2O2的酸性
用化学用语表示H2O2显酸性的原因
②H2O2的还原性
某实验用量筒量取浓H2O2溶液配制
 溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有
溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有 酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:
酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为: 。
。③若滴定时出现以下情况,将导致测定结果偏高的是
A.装入标准酸性KMnO4溶液时,未润洗滴定管
B.滴入最后半滴标准液出现颜色变化就立即停止滴定
C.滴定前盛标准液的滴定管尖嘴处有气泡,滴定后气泡消失
D.记录标准液体积时,滴定前仰视读数,滴定后俯视读数
您最近一年使用:0次
4 . I.完成下列氧化还原反应相关问题。
(1)误食NaNO2会使人体血红蛋白中的Fe2+转化为Fe3+而导致中毒,该过程中NaNO2表现出___________ (填“氧化性”或“还原性”)。
(2)已知NaNO2可以与NH4Cl反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
Ⅱ.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物ClO2。其反应的化学方程式为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(3)该反应中的氧化产物为___________ (填化学式)。
(4)浓盐酸在该反应中显示出来的性质是___________ (填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(5)在碱性条件下加入NaClO3,可将NaCrO2转化为Na2CrO4,ClO 被还原为Cl−,其离子方程式为
被还原为Cl−,其离子方程式为___________ 。还原性:
___________ Cl−(填“>”“<”或“=”)。
(1)误食NaNO2会使人体血红蛋白中的Fe2+转化为Fe3+而导致中毒,该过程中NaNO2表现出
(2)已知NaNO2可以与NH4Cl反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:
Ⅱ.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物ClO2。其反应的化学方程式为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(3)该反应中的氧化产物为
(4)浓盐酸在该反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(5)在碱性条件下加入NaClO3,可将NaCrO2转化为Na2CrO4,ClO
 被还原为Cl−,其离子方程式为
被还原为Cl−,其离子方程式为
您最近一年使用:0次
名校
5 . 回答下列问题:
(一).KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
(1)请用“双线桥”表示上述反应电子转移的方向和数目_______ 。
(2)请将上述反应改写成离子方程式_______ 。
(3)浓盐酸在反应中体现出来的性质有_______ (填序号)。
①还原性 ②酸性 ③氧化性 ④碱性
(4)若反应生成21.3g氯气,则消耗还原剂的质量为_______ g。
(二).高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是_______ 。(填化学式)
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:_______ 。
②每生成1mol FeO 转移
转移_______ 个电子。
(一).KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)请将上述反应改写成离子方程式
(3)浓盐酸在反应中体现出来的性质有
①还原性 ②酸性 ③氧化性 ④碱性
(4)若反应生成21.3g氯气,则消耗还原剂的质量为
(二).高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1mol FeO
 转移
转移
您最近一年使用:0次
名校
解题方法
6 . 化学创造美好生活,下列说法有关物质的性质与用途错误的是
| A.电子跃迁到激发态过程中释放能量产生紫色光—钾盐可用作紫色烟花的原料 |
| B.高铁酸钾(K2FeO4)具有强氧化性—可用作饮用水消毒剂 |
| C.SO2具有较强的还原性—可以在葡萄酒中添加SO2作为抗氧化剂食品保鲜 |
| D.Ca(OH)2具有碱性—理科突击班化学社团用熟石灰处理实验后的酸性废水 |
您最近一年使用:0次
2023-08-21更新
|
506次组卷
|
2卷引用:四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题
解题方法
7 . 某同学用下列各装置设计一个实验,验证氯气的性质。
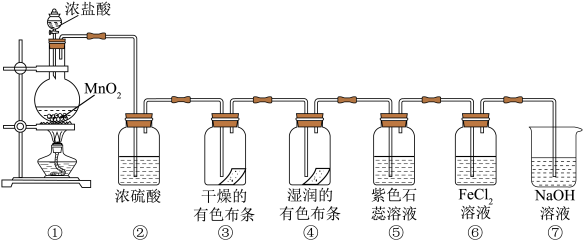
请回答:
(1)盛浓盐酸的仪器名称为___________ 。
(2)①中的化学方程式为___________ ;浓盐酸在反应中显示出来的性质是___________ 。(用字母填空)
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②中浓硫酸的作用是___________ 。
(3)③中的实验现象是___________ ;④中的实验现象是___________ ;上述实验现象说明起漂白作用的是___________ (填分子式)。
(4)⑤中的现象是___________
(5)⑥中发生反应的离子方程式是___________
(6)⑦中NaOH溶液的作用是___________ ,试写出反应的离子方程式:___________ 。

请回答:
(1)盛浓盐酸的仪器名称为
(2)①中的化学方程式为
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②中浓硫酸的作用是
(3)③中的实验现象是
(4)⑤中的现象是
(5)⑥中发生反应的离子方程式是
(6)⑦中NaOH溶液的作用是
您最近一年使用:0次
名校
解题方法
8 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为_______ (填序号)。
① ②酸性
②酸性 ③酸性
③酸性
(2)已知 与
与 不能共存,由此推测下列能大量共存的离子组是
不能共存,由此推测下列能大量共存的离子组是_______ 。
a. b.
b. c.
c.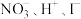 d.
d.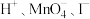
(3)向等浓度的 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为_______ 。
(4)已知常温下 遇淀粉变蓝。现往淀粉
遇淀粉变蓝。现往淀粉 溶液中逐滴加入氯水(含
溶液中逐滴加入氯水(含 ),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_______;猜想2:
),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_______;猜想2: 被
被 继续氧化(为
继续氧化(为 )。
)。
①猜想1为_______ ,实验1所用试剂 为
为_______ 。
②试剂b是一种可溶性含碘化合物,该反应的离子方程式为_______ 。
(5)已知下列四种氧化剂(均可氧化 )对应的还原产物情况如下:
)对应的还原产物情况如下:
请判断,等数量的四种氧化剂微粒分别与足量 作用,得到
作用,得到 最多的是
最多的是_______ 。
(6)结合上述信息思考:对于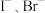 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入_______ ;②加入_______ 。
(7) 具有很强的氧化性(还原产物为
具有很强的氧化性(还原产物为 ),常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是
),常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是 的
的_______ 倍(保留两位有效数字)。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 |  |  (酸化) (酸化) |  (酸化) (酸化) |  |  |  |
| 浓度 | 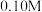 (M为物质的量浓度的单位) (M为物质的量浓度的单位) | |||||
电位值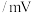 | 171 | 1130 | 603 | 662 | 116 | 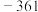 |
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为
①
 ②酸性
②酸性 ③酸性
③酸性
(2)已知
 与
与 不能共存,由此推测下列能大量共存的离子组是
不能共存,由此推测下列能大量共存的离子组是a.
 b.
b. c.
c.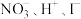 d.
d.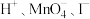
(3)向等浓度的
 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为(4)已知常温下
 遇淀粉变蓝。现往淀粉
遇淀粉变蓝。现往淀粉 溶液中逐滴加入氯水(含
溶液中逐滴加入氯水(含 ),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_______;猜想2:
),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_______;猜想2: 被
被 继续氧化(为
继续氧化(为 )。
)。| 序号 | 实验操作 | 试剂 | 观察实验现象 | 结论 |
| 1 | 分别取少量褪色后溶液于三支试管中,并加入对应试剂 | a | 溶液变蓝 | 猜想1不正确 |
| 2 | 淀粉溶液 | 溶液不变蓝 | 猜想2正确 | |
| 3 | 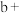 稀 稀 | 溶液变蓝 |
 为
为②试剂b是一种可溶性含碘化合物,该反应的离子方程式为
(5)已知下列四种氧化剂(均可氧化
 )对应的还原产物情况如下:
)对应的还原产物情况如下:| 氧化剂 |  |  |  |  |
| 还原产物 |  |  |  |  |
 作用,得到
作用,得到 最多的是
最多的是(6)结合上述信息思考:对于
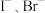 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入(7)
 具有很强的氧化性(还原产物为
具有很强的氧化性(还原产物为 ),常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是
),常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是 的
的
您最近一年使用:0次
9 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱:数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如下表所示:(注意:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为___________ (填序号)。
① ②酸性
②酸性 ③酸性
③酸性
(2)已知 与
与 不能共存,由此推测下列能大量共存的离子组是
不能共存,由此推测下列能大量共存的离子组是___________ 。
a. b.
b. c.
c.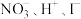 d.
d.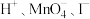
(3)向等浓度的 和FeCl2混合溶液滴加少量酸性
和FeCl2混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为___________ 。
(4)已知常温下 遇淀粉变蓝。现往淀粉
遇淀粉变蓝。现往淀粉 溶液中逐滴加入氯水(含
溶液中逐滴加入氯水(含 ),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:
),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1: 将淀粉氧化; 猜想2:
将淀粉氧化; 猜想2: 被
被 继续氧化(为
继续氧化(为 )。
)。
①实验1所用试剂a为___________ 。
②试剂b是一种可溶性含碘化合物,该反应的离子方程式为___________ 。
结合上述信息思考:对于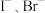 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出合理的氧化方案:加入
,请提出合理的氧化方案:加入___________ 。(合理即给分)
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱:数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如下表所示:(注意:实验中进行酸化时均用稀硫酸)
| 物质 | FeCl3 | KMnO4(酸化) | NaNO3(酸化) | Br2 | I2 | Na2S |
| 浓度 | 0.10M(M为物质的量浓度的单位) | |||||
| 电位值/mV | 171 | 1130 | 603 | 662 | 116 | -361 |
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为
①
 ②酸性
②酸性 ③酸性
③酸性
(2)已知
 与
与 不能共存,由此推测下列能大量共存的离子组是
不能共存,由此推测下列能大量共存的离子组是a.
 b.
b. c.
c.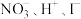 d.
d.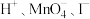
(3)向等浓度的
 和FeCl2混合溶液滴加少量酸性
和FeCl2混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为(4)已知常温下
 遇淀粉变蓝。现往淀粉
遇淀粉变蓝。现往淀粉 溶液中逐滴加入氯水(含
溶液中逐滴加入氯水(含 ),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:
),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1: 将淀粉氧化; 猜想2:
将淀粉氧化; 猜想2: 被
被 继续氧化(为
继续氧化(为 )。
)。| 序号 | 实验操作 | 试剂 | 观察实验现象 | 结论 |
| 1 | 分别取少量褪色后溶液于三支试管中,并加入对应试剂 | a | 溶液变蓝 | 猜想1不正确 |
| 2 | 淀粉溶液 | 溶液不变蓝 | 猜想2正确 | |
| 3 | b+稀H2SO4 | 溶液变蓝 |
②试剂b是一种可溶性含碘化合物,该反应的离子方程式为
结合上述信息思考:对于
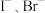 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出合理的氧化方案:加入
,请提出合理的氧化方案:加入
您最近一年使用:0次
名校
解题方法
10 . 苹果汁中含有 ,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生,这说明维生素C有
,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生,这说明维生素C有
 ,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生,这说明维生素C有
,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生,这说明维生素C有| A.碱性 | B.氧化性 | C.还原性 | D.酸性 |
您最近一年使用:0次
2022-11-07更新
|
656次组卷
|
20卷引用:四川省南充市阆中东风中学校2023-2024学年高一上学期第二次段考化学试题
四川省南充市阆中东风中学校2023-2024学年高一上学期第二次段考化学试题新疆哈密市第八中学2022-2023学年高一上学期期末考试化学试题河北省邯郸市永年区第二中学2022-2023学年高一上学期期末考试化学试题广东省广州市真光中学2023-2024学年高一上学期期中考试化学试题宁夏吴忠市吴忠中学2023-2024学年高一上学期11月期中考试化学试题陕西省西咸新区2023-2024学年高一上学期11月期中考试化学试题江苏省江阴市华士高级中学2023-2024学年高一上学期10月学情调研化学试题广东省江门市江海区外海中学2023-2024学年高一上学期期中考试化学试题宁夏银川市永宁县永宁中学2023-2024学年高一上学期第一次月考化学试卷河北省邯郸市魏县第五中学2023-2024学年高一上学期12月月考化学试题重庆市杨家坪中学2022-2023学年高一上学期第一次月考化学试题天津市民族中学2022~2023学年高一上学期期中考试化学试题新疆巴音郭楞蒙古自治州第二中学2022-2023学年高一上学期期中考试化学(B卷)试题广东省清远市四校2022-2023学年高一上学期期中考试化学试题浙江省金华市曙光学校2022-2023学年高一上学期第一次阶段考试(10月)化学试题吉林省永吉县第四中学2022-2023学年高一上学期期末考试化学试题河北省石家庄北华中学2022-2023学年高一上学期期末考试(线上)化学试题广西南宁市第五十六中学2022-2023学年高一上学期期中考试化学试题广东省东莞实验中学2022-2023学年高一上学期期中考试化学试题安徽省马鞍山市第二十二中学2022-2023学年高一上学期11月期中考试化学试题



