名校
1 . 下列叙述正确的是
| A.水晶、玻璃、水泥都是硅酸盐材料 |
| B.纤维素、维生素C、聚乳酸都是高分子化合物 |
| C.二氧化硫是导致酸雨、光化学烟雾的有害气体之一 |
| D.赤铁矿、磁铁矿、黄铁矿都是铁矿石 |
您最近一年使用:0次
2023-04-01更新
|
344次组卷
|
2卷引用:甘肃省华亭市第一中学2021-2022学年高一下学期期末考试化学试题
名校
解题方法
2 . 下列说法正确的是
| A.通过焰色试验,观察到火焰呈黄色,则溶液中一定有Na+,可能有K+ |
| B.焰色试验前将铂丝用稀硫酸清洗,并灼烧至火焰与原来颜色相同 |
| C.向久置的FeCl2溶液中滴加酸性KMnO4溶液,紫色褪去,说明FeCl2未完全变质 |
| D.向溶液中先通入Cl2,再加入KSCN溶液,溶液变红,说明溶液中存在Fe2+ |
您最近一年使用:0次
2023-02-11更新
|
171次组卷
|
2卷引用:甘肃省兰州第一中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
3 . I.室温时,向100mL 0.1 HCl溶液中滴加0.1
HCl溶液中滴加0.1 氨水,得到溶液pH与氨水体积的关系曲线如图所示:
氨水,得到溶液pH与氨水体积的关系曲线如图所示:
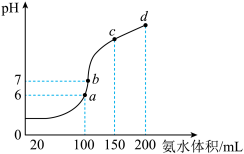
(1)试分析图中a、b、c、d四个点,水的电离程度最大的是______________ ;
(2)在b点,溶液中各离子浓度由大到小的排列顺序是_____________________________ ;
(3)写出a点混合溶液中下列算式的精确结果(不能近似计算):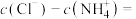
_______________ ;
(4)25℃时,同浓度的下列溶液:①HCl;② ;③
;③ ;④
;④ ,其中pH由大到小的顺序是
,其中pH由大到小的顺序是_________________ 。
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg/L。处理镉废水可采用化学沉淀法。
(5)一定温度下, 的
的 ,
, 的
的 ,该温度下
,该温度下______________ [填“ ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。
(6)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到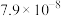 mol/L时,废水中
mol/L时,废水中 的浓度为
的浓度为___________________ mol/L[已知: ,此时
,此时______________ (填“符合”或“不符合”)《生活饮用水卫生标准》。
 HCl溶液中滴加0.1
HCl溶液中滴加0.1 氨水,得到溶液pH与氨水体积的关系曲线如图所示:
氨水,得到溶液pH与氨水体积的关系曲线如图所示:
(1)试分析图中a、b、c、d四个点,水的电离程度最大的是
(2)在b点,溶液中各离子浓度由大到小的排列顺序是
(3)写出a点混合溶液中下列算式的精确结果(不能近似计算):
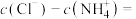
(4)25℃时,同浓度的下列溶液:①HCl;②
 ;③
;③ ;④
;④ ,其中pH由大到小的顺序是
,其中pH由大到小的顺序是II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg/L。处理镉废水可采用化学沉淀法。
(5)一定温度下,
 的
的 ,
, 的
的 ,该温度下
,该温度下 ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。(6)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到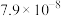 mol/L时,废水中
mol/L时,废水中 的浓度为
的浓度为 ,此时
,此时
您最近一年使用:0次
名校
4 . 某课外小组设计如图1所示装置为电源对粗铜(含有Cu,少量Fe、Zn、Ag、Au等)进行精炼。(已知:装置I中发生的副反应为Fe电极直接与 溶液反应)
溶液反应)
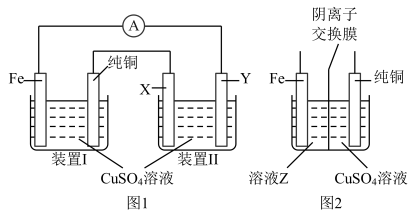
(1)装置I中Fe电极上发生反应的电极反应式为_______ 。
(2)当反应一段时间后,经测量发现,Fe电极质量减少0.80 g,纯铜电极质量增重0.96 g,则实际经过电流表的电子的物质的量为_______ mol,装置I的能量转化率为_______ 。(已知:装置I中 足量)
足量)
(3)有同学提议,为避免副反应的发生,应将装置I改为如图2所示装置,则溶液Z中溶质的化学式为_______ 。
(4)装置II中X电极材料的名称为_______ ,Y电极上的电极反应式为_______ ,一段时间后,装置II溶液中阳离子主要为 和
和_______ 。
 溶液反应)
溶液反应)
(1)装置I中Fe电极上发生反应的电极反应式为
(2)当反应一段时间后,经测量发现,Fe电极质量减少0.80 g,纯铜电极质量增重0.96 g,则实际经过电流表的电子的物质的量为
 足量)
足量)(3)有同学提议,为避免副反应的发生,应将装置I改为如图2所示装置,则溶液Z中溶质的化学式为
(4)装置II中X电极材料的名称为
 和
和
您最近一年使用:0次
2023-01-11更新
|
70次组卷
|
2卷引用:甘肃省庆阳市2022-2023学年高二上学期期末考试化学试题
5 . 煤是地球上含量最多、分布最广泛的化石燃料,通过对煤的深加工可以获得更多的化工原料。回答下列问题:
(1)已知:在一定温度下,
 ;
;
 ;
;
 ;
;
则
_______ (填含 、
、 的表达式)。
的表达式)。
(2)200℃恒温条件下,在容积为2 L的恒容容器中进行反应
 ,反应过程中测得部分数据如表:
,反应过程中测得部分数据如表:
①
_______ ,
_______ 。
②20 min时,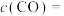
_______  ;10~30 min内,用
;10~30 min内,用 )表示的化学反应速率
)表示的化学反应速率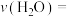
_______  。
。
③200℃时,该反应的化学平衡常数
_______ (用分数表示)。
(3)若上述反应在300℃下进行,某时刻测得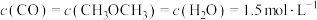 、
、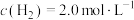 ,则此时
,则此时
_______ (填“<”“>”或“=”) 。
。
(1)已知:在一定温度下,

 ;
;
 ;
;
 ;
;则

 、
、 的表达式)。
的表达式)。(2)200℃恒温条件下,在容积为2 L的恒容容器中进行反应

 ,反应过程中测得部分数据如表:
,反应过程中测得部分数据如表:| 物质的量 反应时间 | n(CO)/mol | 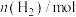 | 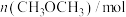 |  |
| 0 min | 3 | 8 | 0 | 0 |
| 10 min | a | b | 0.5 | 0.5 |
| 20 min | c | 4.4 | d | d |
| 30 min | 1.0 | e | f | f |
| 40 min | g | h | 1.0 | 1.0 |
①


②20 min时,
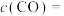
 ;10~30 min内,用
;10~30 min内,用 )表示的化学反应速率
)表示的化学反应速率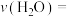
 。
。③200℃时,该反应的化学平衡常数

(3)若上述反应在300℃下进行,某时刻测得
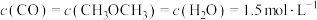 、
、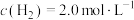 ,则此时
,则此时
 。
。
您最近一年使用:0次
名校
6 . 氨是重要的化工原料,已知 在纯氧中燃烧的能量变化如图。
在纯氧中燃烧的能量变化如图。
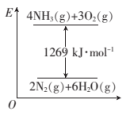
(1)已知:
 ,则
,则 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为_______ 。
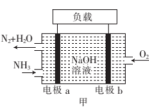
(2) 的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极b为
的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极b为_______ (填“正极”或“负极”);电极a上的电极反应为_______ 。当共消耗1.568 L(标准状况)气体时,通过负载的电子的物质的量为_______ mol。
(3)一种肼( )燃料电池的工作原理如图乙所示。
)燃料电池的工作原理如图乙所示。
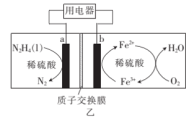
①a极的电极反应式为_______ ;电池中 的离子方程式为
的离子方程式为_______ 。
②若利用该电池给铅酸蓄电池充电,当消耗3.2 g 时,
时, 电极质量
电极质量_______ (填“增加”或“减少”)_______ g。
 在纯氧中燃烧的能量变化如图。
在纯氧中燃烧的能量变化如图。
(1)已知:

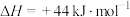 ,则
,则 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(2)
 的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极b为
的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极b为
(3)一种肼(
 )燃料电池的工作原理如图乙所示。
)燃料电池的工作原理如图乙所示。
①a极的电极反应式为
 的离子方程式为
的离子方程式为②若利用该电池给铅酸蓄电池充电,当消耗3.2 g
 时,
时, 电极质量
电极质量
您最近一年使用:0次
2023-01-11更新
|
364次组卷
|
2卷引用:甘肃省庆阳市2022-2023学年高二上学期期末考试化学试题
解题方法
7 . 下列物质中:①醋酸溶液 ②氨水 ③熔融的NaOH ④稀盐酸 ⑤ 固体⑥
固体⑥ 固体 ⑦
固体 ⑦ 溶液 ⑧
溶液 ⑧ 固体
固体
(1)上述物质中属于强电解质的是_______ (填序号)。
(2)写出⑥分别在水溶液和熔融状态下的电离方程式:水溶液中:_______ ;熔融状态下:_______ 。
(3)25℃时,将⑤的溶液和⑥的溶液等浓度、等体积混合,混合溶液中:
_______ (填“>”、“<”或“=”) 。25℃时,将
。25℃时,将
 ②加入
②加入
 ④中,当
④中,当 时,混合溶液中离子浓度大小顺序为
时,混合溶液中离子浓度大小顺序为_______ (填离子符号)。
(4)25℃时, 的⑤的溶液、⑥的溶液、③的溶液和⑦四种溶液的pH由大到小的排列顺序:
的⑤的溶液、⑥的溶液、③的溶液和⑦四种溶液的pH由大到小的排列顺序:_______ 。(填标号,下同)
(5)25℃时,将等pH、V L的②和③的溶液分别稀释至2V L,则稀释后溶液的pH大小关系为_______ 。
 固体⑥
固体⑥ 固体 ⑦
固体 ⑦ 溶液 ⑧
溶液 ⑧ 固体
固体(1)上述物质中属于强电解质的是
(2)写出⑥分别在水溶液和熔融状态下的电离方程式:水溶液中:
(3)25℃时,将⑤的溶液和⑥的溶液等浓度、等体积混合,混合溶液中:

 。25℃时,将
。25℃时,将
 ②加入
②加入
 ④中,当
④中,当 时,混合溶液中离子浓度大小顺序为
时,混合溶液中离子浓度大小顺序为(4)25℃时,
 的⑤的溶液、⑥的溶液、③的溶液和⑦四种溶液的pH由大到小的排列顺序:
的⑤的溶液、⑥的溶液、③的溶液和⑦四种溶液的pH由大到小的排列顺序:(5)25℃时,将等pH、V L的②和③的溶液分别稀释至2V L,则稀释后溶液的pH大小关系为
您最近一年使用:0次
8 . 下列实验相关叙述正确的是
| A.用湿润的pH试纸测电解质稀溶液的pH,一定存在实验误差 |
| B.将钢铁闸门连接电源负极的保护方法称为牺牲阳极保护法 |
| C.中和滴定实验过程中,眼睛应注视锥形瓶中溶液颜色的变化 |
D. 固体溶于水后溶液温度降低,说明盐类的水解都是吸热过程 固体溶于水后溶液温度降低,说明盐类的水解都是吸热过程 |
您最近一年使用:0次
名校
9 . HCl气体被氧气氧化的能量关系如图,下列叙述正确的是


A.该反应 、 、 |
B.该反应的浓度平衡常数 |
C.用E表示键能,则该反应 |
D.反应 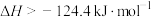 |
您最近一年使用:0次
2023-01-11更新
|
329次组卷
|
3卷引用:甘肃省庆阳市2022-2023学年高二上学期期末考试化学试题
名校
10 . 科研人员设想用如图原电池装置生产硫酸(设通入的气体完全参与反应)。下列说法错误的是
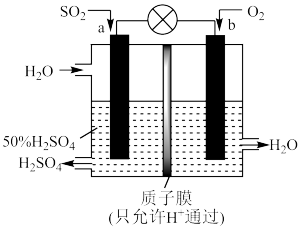

| A.导线中电子移动方向为a→导线→b |
| B.溶液中质子移动方向为b→电解质溶液→a |
C.负极发生的电极反应为 |
D.通过调节通入的 和水的质量比可保持装置内硫酸溶液的浓度不变 和水的质量比可保持装置内硫酸溶液的浓度不变 |
您最近一年使用:0次
2023-01-11更新
|
254次组卷
|
3卷引用:甘肃省庆阳市2022-2023学年高二上学期期末考试化学试题



