解题方法
1 . 工业上常以铝土矿为原料来冶炼金属铝。已知:铝土矿的主要成分是 (其中含有
(其中含有 、
、 等杂质)。为检测某铝土矿样品中
等杂质)。为检测某铝土矿样品中 的含量,进行如下实验过程:
的含量,进行如下实验过程:
①取矿样10.0g加入过量稀盐酸溶解,过滤弃去不溶残渣。
②将滤液稀释并在250mL容量瓶中定容后,取25.0mL逐滴加入 的NaOH溶液。得到如右图所示的变化关系。
的NaOH溶液。得到如右图所示的变化关系。___________ 。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为___________ ,其物质的量为___________ 。
(3)该铝土矿样中 的质量分数为
的质量分数为___________ 。
 (其中含有
(其中含有 、
、 等杂质)。为检测某铝土矿样品中
等杂质)。为检测某铝土矿样品中 的含量,进行如下实验过程:
的含量,进行如下实验过程:①取矿样10.0g加入过量稀盐酸溶解,过滤弃去不溶残渣。
②将滤液稀释并在250mL容量瓶中定容后,取25.0mL逐滴加入
 的NaOH溶液。得到如右图所示的变化关系。
的NaOH溶液。得到如右图所示的变化关系。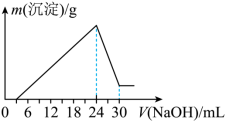
(2)最后所得不溶于NaOH溶液的沉淀的化学式为
(3)该铝土矿样中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
2 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。根据所学知识,回答下列问题:
① 时检验,溶液变红,写出反应的离子方程式
时检验,溶液变红,写出反应的离子方程式___________ 。
② 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因___________ 。
③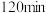 时检验,溶液复又变红,用离子方程式说明原因
时检验,溶液复又变红,用离子方程式说明原因___________ 。
(2)操作①的名称是___________ ,路线I中,加H2O2溶液的目的是(用离子方程式说明)___________ 。
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是___________
(4)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ:称取 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。
Ⅱ:取出 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入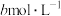 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液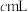 。
。
①计算硫酸亚铁晶体样品中 的质量分数
的质量分数___________ 。
②若配置硫酸亚铁溶液出现黄色,则测定结果___________ (填:偏高、偏低、不变)
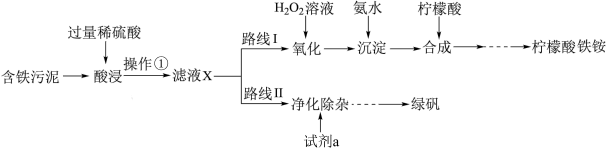
| 酸浸时间 |  |  |  |
| 用KSCN溶液检验 | 变红 | 未变红 | 变红 |
 时检验,溶液变红,写出反应的离子方程式
时检验,溶液变红,写出反应的离子方程式②
 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因③
 时检验,溶液复又变红,用离子方程式说明原因
时检验,溶液复又变红,用离子方程式说明原因(2)操作①的名称是
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是
(4)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ:称取
 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。Ⅱ:取出
 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入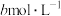 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液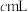 。
。①计算硫酸亚铁晶体样品中
 的质量分数
的质量分数②若配置硫酸亚铁溶液出现黄色,则测定结果
您最近一年使用:0次
名校
解题方法
3 . 某实验小组以BaS溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:
可选用试剂:NaCl晶体、BaS溶液、浓 、稀
、稀 、
、 溶液、蒸馏水
溶液、蒸馏水
步骤1: 的制备
的制备
按如图所示装置进行实验,得到 溶液,经一系列步骤获得
溶液,经一系列步骤获得 产品。
产品。 的含量测定
的含量测定
①称取产品0.5000g,用100mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的0.100mol/L 溶液;
溶液;
③沉淀完全后,60℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量所得白色固体,质量为0.4660g。
回答下列问题:
(1)Ⅰ是制取______ 气体的装置,Ⅱ中b仪器的作用是________ ;Ⅲ中的试剂应选用_______ 。
(2)Ⅱ中发生主要反应的化学方程式为_________ 。
(3)在沉淀过程中,某同学在加入一定量的热 溶液后,认为沉淀已经完全,判断沉淀已经完全的方法是
溶液后,认为沉淀已经完全,判断沉淀已经完全的方法是_________ 。
(4)沉淀过程中需加入过量的 溶液,原因是
溶液,原因是_________ 。
(5)在过滤操作中,下列仪器不需要用到的是_______ (填名称)。 的质量分数为
的质量分数为________ (保留三位有效数字)。
 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:可选用试剂:NaCl晶体、BaS溶液、浓
 、稀
、稀 、
、 溶液、蒸馏水
溶液、蒸馏水步骤1:
 的制备
的制备按如图所示装置进行实验,得到
 溶液,经一系列步骤获得
溶液,经一系列步骤获得 产品。
产品。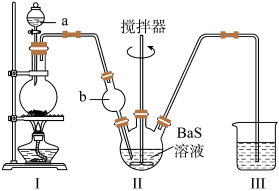
 的含量测定
的含量测定①称取产品0.5000g,用100mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的0.100mol/L
 溶液;
溶液;③沉淀完全后,60℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量所得白色固体,质量为0.4660g。
回答下列问题:
(1)Ⅰ是制取
(2)Ⅱ中发生主要反应的化学方程式为
(3)在沉淀过程中,某同学在加入一定量的热
 溶液后,认为沉淀已经完全,判断沉淀已经完全的方法是
溶液后,认为沉淀已经完全,判断沉淀已经完全的方法是(4)沉淀过程中需加入过量的
 溶液,原因是
溶液,原因是(5)在过滤操作中,下列仪器不需要用到的是

 的质量分数为
的质量分数为
您最近一年使用:0次
4 . 重铬酸钾( )是实验室常用的氧化剂。某实验小组以铬铁矿(主要成分为
)是实验室常用的氧化剂。某实验小组以铬铁矿(主要成分为 ,含
,含 、
、 等杂质)为原料制备重铬酸钾,并进行性质验证实验。
等杂质)为原料制备重铬酸钾,并进行性质验证实验。
已知:相关物质在不同温度时的溶解度/g如下表:
实验一:重铬酸钾的制备
步骤Ⅰ:将一定量NaOH和 的固体置于铁坩埚内,加热至熔融,再加铬铁矿粉与
的固体置于铁坩埚内,加热至熔融,再加铬铁矿粉与 继续加热50分钟,发生反应:
继续加热50分钟,发生反应: ,自然冷却。
,自然冷却。
步骤Ⅱ:取出坩埚中的熔块,置于烧杯中,加水并加热煮沸15分钟,冷却后抽滤,弃去含铁固体物质。
步骤Ⅲ:用冰醋酸调节上述滤液pH为7到8,产生浑浊,加热后过滤除去 和
和 ,将滤液转移至蒸发皿中,加冰醋酸调节pH为5。
,将滤液转移至蒸发皿中,加冰醋酸调节pH为5。
步骤Ⅳ:向上述溶液中加KCl,出现少量晶体再次调pH并进行结晶操作,有大量橙色晶体析出,抽滤,用少量冷水洗涤晶体,干燥得 晶体。
晶体。
回答下列问题:
(1)步骤Ⅰ中下列仪器不需要的是_____ (填仪器名称)。

(2)步骤Ⅲ中调节滤液pH用冰醋酸,不用强酸的原因是_______ ,过滤前先加热的目的是________ 。
(3)步骤Ⅳ中的结晶方法是_______ (填“蒸发结晶”或“冷却结晶”),有同学制得的重铬酸钾晶体颜色偏黄,可能的原因是_______ 。
实验二:用重铬酸钾测定 固体试样中铁的含量
固体试样中铁的含量
已知:二苯胺磺酸钠还原态为无色,氧化态为紫红色。
(4)取重铬酸钾晶体配制成0.02mol/L的标准液。称取2.00g 固体试样于锥形瓶中,加15.00mL混合酸,再加水配成100mL溶液,取10.00mL
固体试样于锥形瓶中,加15.00mL混合酸,再加水配成100mL溶液,取10.00mL 溶液于锥形瓶,加入几滴二苯胺磺酸钠作指示剂,用重铬酸钾标准液滴定至由绿色变为紫红色,消耗标准液8.00mL。
溶液于锥形瓶,加入几滴二苯胺磺酸钠作指示剂,用重铬酸钾标准液滴定至由绿色变为紫红色,消耗标准液8.00mL。
①写出滴定时重铬酸钾和硫酸亚铁反应的离子方程式________ 。
②测定 固体试样中铁的质量分数为
固体试样中铁的质量分数为_____ (保留两位小数)。
③测定结果偏大的可能原因是_______ 。
 )是实验室常用的氧化剂。某实验小组以铬铁矿(主要成分为
)是实验室常用的氧化剂。某实验小组以铬铁矿(主要成分为 ,含
,含 、
、 等杂质)为原料制备重铬酸钾,并进行性质验证实验。
等杂质)为原料制备重铬酸钾,并进行性质验证实验。已知:相关物质在不同温度时的溶解度/g如下表:
| 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
| 重铬酸钾 | 4.7 | 12.3 | 26.3 | 45.6 | 73 |
| 重铬酸钠 | 163 | 183 | 215 | 269 | 76 |
步骤Ⅰ:将一定量NaOH和
 的固体置于铁坩埚内,加热至熔融,再加铬铁矿粉与
的固体置于铁坩埚内,加热至熔融,再加铬铁矿粉与 继续加热50分钟,发生反应:
继续加热50分钟,发生反应: ,自然冷却。
,自然冷却。步骤Ⅱ:取出坩埚中的熔块,置于烧杯中,加水并加热煮沸15分钟,冷却后抽滤,弃去含铁固体物质。
步骤Ⅲ:用冰醋酸调节上述滤液pH为7到8,产生浑浊,加热后过滤除去
 和
和 ,将滤液转移至蒸发皿中,加冰醋酸调节pH为5。
,将滤液转移至蒸发皿中,加冰醋酸调节pH为5。步骤Ⅳ:向上述溶液中加KCl,出现少量晶体再次调pH并进行结晶操作,有大量橙色晶体析出,抽滤,用少量冷水洗涤晶体,干燥得
 晶体。
晶体。回答下列问题:
(1)步骤Ⅰ中下列仪器不需要的是

(2)步骤Ⅲ中调节滤液pH用冰醋酸,不用强酸的原因是
(3)步骤Ⅳ中的结晶方法是
实验二:用重铬酸钾测定
 固体试样中铁的含量
固体试样中铁的含量已知:二苯胺磺酸钠还原态为无色,氧化态为紫红色。
(4)取重铬酸钾晶体配制成0.02mol/L的标准液。称取2.00g
 固体试样于锥形瓶中,加15.00mL混合酸,再加水配成100mL溶液,取10.00mL
固体试样于锥形瓶中,加15.00mL混合酸,再加水配成100mL溶液,取10.00mL 溶液于锥形瓶,加入几滴二苯胺磺酸钠作指示剂,用重铬酸钾标准液滴定至由绿色变为紫红色,消耗标准液8.00mL。
溶液于锥形瓶,加入几滴二苯胺磺酸钠作指示剂,用重铬酸钾标准液滴定至由绿色变为紫红色,消耗标准液8.00mL。①写出滴定时重铬酸钾和硫酸亚铁反应的离子方程式
②测定
 固体试样中铁的质量分数为
固体试样中铁的质量分数为③测定结果偏大的可能原因是
您最近一年使用:0次
5 . 微量元素体检报告单显示,某儿童体内铁元素含量偏低。
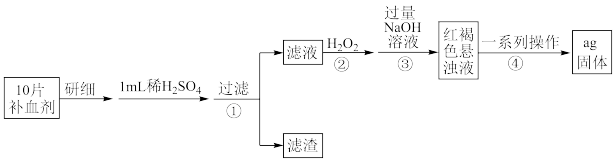
(1)硫酸亚铁晶体( )在医药上用作补血剂。某课外小组设计实验测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
)在医药上用作补血剂。某课外小组设计实验测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
请回答下列问题:
①取步骤①的滤液滴加 溶液后变为红色,说明滤液中含有
溶液后变为红色,说明滤液中含有 ,写出反应的离子方程式
,写出反应的离子方程式_____ ,加入 粉后红色褪去,写出加入铁粉时反应的离子方程式:
粉后红色褪去,写出加入铁粉时反应的离子方程式:_____ 。
②步骤②加入过量 的目的是
的目的是_____ 。
③假设实验中的损耗忽略不计,若1片补血剂的质量为bg,则补血剂中铁元素的质量分数为_____ 。
(2)纳米级的 是一种非常重要的磁性材料。
是一种非常重要的磁性材料。
① 溶于稀盐酸的离子方程式为
溶于稀盐酸的离子方程式为_____ 。
②铁在氧气中燃烧生成 ,反应中每生成1
,反应中每生成1
 转移
转移_____  电子。
电子。
(1)硫酸亚铁晶体(
 )在医药上用作补血剂。某课外小组设计实验测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
)在医药上用作补血剂。某课外小组设计实验测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
请回答下列问题:
①取步骤①的滤液滴加
 溶液后变为红色,说明滤液中含有
溶液后变为红色,说明滤液中含有 ,写出反应的离子方程式
,写出反应的离子方程式 粉后红色褪去,写出加入铁粉时反应的离子方程式:
粉后红色褪去,写出加入铁粉时反应的离子方程式:②步骤②加入过量
 的目的是
的目的是③假设实验中的损耗忽略不计,若1片补血剂的质量为bg,则补血剂中铁元素的质量分数为
(2)纳米级的
 是一种非常重要的磁性材料。
是一种非常重要的磁性材料。①
 溶于稀盐酸的离子方程式为
溶于稀盐酸的离子方程式为②铁在氧气中燃烧生成
 ,反应中每生成1
,反应中每生成1
 转移
转移 电子。
电子。
您最近一年使用:0次
解题方法
6 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备 和
和 的部分实验步骤如下:
的部分实验步骤如下: ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是___________ 。(任写一种方法)。
(2)从“滤液 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为___________ 、过滤、冰水洗涤、低温干燥,其中冰水洗涤晶体的目的是___________ 。
(3)在“溶解 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为___________ 。
(4)为测定产品中 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。
已知: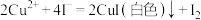 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数___________ (写出计算过程,结果保留2位小数)。
 和
和 的部分实验步骤如下:
的部分实验步骤如下: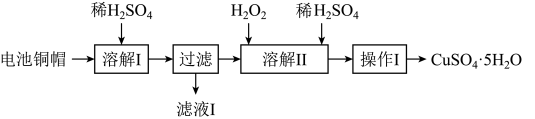
 ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是(2)从“滤液
 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为(3)在“溶解
 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为(4)为测定产品中
 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。已知:
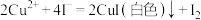 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数
您最近一年使用:0次
7 . 为测定某样品中 含量,取
含量,取 配成
配成 溶液(杂质不溶解),再用该溶液滴定
溶液(杂质不溶解),再用该溶液滴定
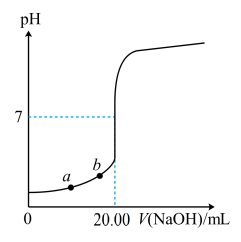
 盐酸,并用酚酞作为指示剂。下图是该滴定过程的滴定曲线。下列说法错误的是
盐酸,并用酚酞作为指示剂。下图是该滴定过程的滴定曲线。下列说法错误的是
 含量,取
含量,取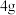 配成
配成 溶液(杂质不溶解),再用该溶液滴定
溶液(杂质不溶解),再用该溶液滴定
 盐酸,并用酚酞作为指示剂。下图是该滴定过程的滴定曲线。下列说法错误的是
盐酸,并用酚酞作为指示剂。下图是该滴定过程的滴定曲线。下列说法错误的是
| A.该反应还可以用甲基橙做指示剂 |
| B.溶液由无色变为浅红色且一段时间不褪色时为滴定终点 |
C.碱式滴定管用蒸馏水洗净后未润洗,则c( )偏大 )偏大 |
| D.NaOH的质量分数为62.5% |
您最近一年使用:0次
解题方法
8 . 铁是人体必需的微量元素,铁摄入不足可能引起缺铁性贫血。日常生活中可通过食物摄入铁元素,例如黑木耳中就含有比较丰富的铁元素。某研究性学习小组为测定某地黑木耳中铁的含量,开展了如下研究与实践活动。
【研究与实践活动一】
研究黑木耳中含铁物质的水溶性:称取 黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
【研究与实践活动二】
研究黑木耳中铁的含量:称取 黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。
黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。
(1)浸泡液中未能检测到铁元素,说明黑木耳中的含铁物质___________ (填“难”或“易”)溶于水。
(2)取少量滤液于试管中,滴入 溶液,溶液变红。则滤液中铁元素的存在形式有
溶液,溶液变红。则滤液中铁元素的存在形式有 、
、___________ (填离子符号)。
(3)滤液与Fe生成A的离子方程式为___________ 。
(4)由A转化为B可加入的试剂X可以是___________ (填标号)。
a.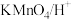 b.
b. c.
c.
(5)由C转化成D的现象:白色沉淀迅速变为灰绿色,最终变为___________ 。C转化成D的化学方程式为___________ 。
(6)将 黑木耳中的铁元素经流程A→C→D进行完全转化,将D经过一系列处理,得到
黑木耳中的铁元素经流程A→C→D进行完全转化,将D经过一系列处理,得到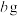 红棕色固体。若流程中加入的铁反应掉
红棕色固体。若流程中加入的铁反应掉 ,则该黑木耳中铁元素的质量分数为
,则该黑木耳中铁元素的质量分数为___________ (用含a、b、c的代数式表示)。
【研究与实践活动一】
研究黑木耳中含铁物质的水溶性:称取
 黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。【研究与实践活动二】
研究黑木耳中铁的含量:称取
 黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。
黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。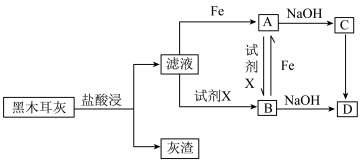
(1)浸泡液中未能检测到铁元素,说明黑木耳中的含铁物质
(2)取少量滤液于试管中,滴入
 溶液,溶液变红。则滤液中铁元素的存在形式有
溶液,溶液变红。则滤液中铁元素的存在形式有 、
、(3)滤液与Fe生成A的离子方程式为
(4)由A转化为B可加入的试剂X可以是
a.
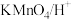 b.
b. c.
c.
(5)由C转化成D的现象:白色沉淀迅速变为灰绿色,最终变为
(6)将
 黑木耳中的铁元素经流程A→C→D进行完全转化,将D经过一系列处理,得到
黑木耳中的铁元素经流程A→C→D进行完全转化,将D经过一系列处理,得到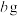 红棕色固体。若流程中加入的铁反应掉
红棕色固体。若流程中加入的铁反应掉 ,则该黑木耳中铁元素的质量分数为
,则该黑木耳中铁元素的质量分数为
您最近一年使用:0次
解题方法
9 . 铬酰氯( )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:
某小组设计如图装置利用 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。
(1)装浓盐酸的仪器名称是___________ ,B装置作用是___________ 。
(2)A中可能看到的现象是___________ ,利用浓硫酸的性质是___________ 。
(3)C中反应的化学方程式是___________ 。
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:___________ (填“是”或“否”),请解释原因:___________ 。
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用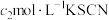 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。
该样品中氯元素质量分数为___________ 。如果滴定管没有润洗,测得结果会___________ (填“偏高”“偏低”或“无影响”)。
已知:常温下, ,
,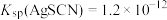 ,
,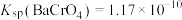 。
。
 )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:| 物理性质 | 化学性质 |
| 熔点:-96.5℃,沸点:117℃ | 放置在空气中会迅速挥发并水解 |
 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。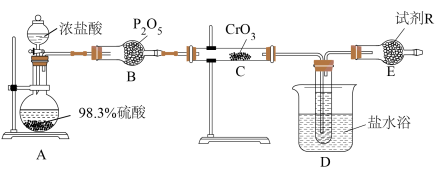
(1)装浓盐酸的仪器名称是
(2)A中可能看到的现象是
(3)C中反应的化学方程式是
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。
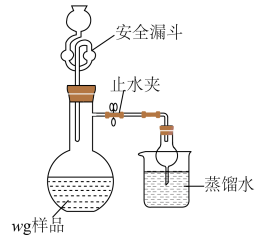
 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用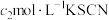 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。该样品中氯元素质量分数为
已知:常温下,
 ,
,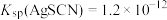 ,
,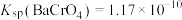 。
。
您最近一年使用:0次
解题方法
10 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnSO4·7H2O和CuSO4·5H2O的部分实验步骤如下:
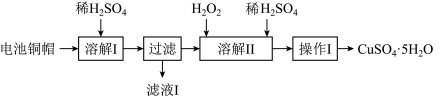
(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是_______ (任写一种方法)。
(2)从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为_______ 、_______ 、过滤、冰水洗涤、低温干燥。
(3)仔细分析流程,在“溶解II”步骤中,发生反应的化学方程式为_______ (用双线桥标出电子转移的方向和数目)。
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol/LNa2S2O3标准溶液至滴定终点,消耗Na2S2O3溶液25.00mL。
已知:2CuSO4+4KI=2CuI(白色)+I2+2K2SO4;2Na2S2O3+I2=2NaI+Na2S4O6
请依据实验数据计算样品中CuSO4·5H2O的质量分数_______ (写出计算过程,结果用百分数表示,小数点后保留1位有效数字)。

(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是
(2)从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为
(3)仔细分析流程,在“溶解II”步骤中,发生反应的化学方程式为
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol/LNa2S2O3标准溶液至滴定终点,消耗Na2S2O3溶液25.00mL。
已知:2CuSO4+4KI=2CuI(白色)+I2+2K2SO4;2Na2S2O3+I2=2NaI+Na2S4O6
请依据实验数据计算样品中CuSO4·5H2O的质量分数
您最近一年使用:0次



