名校
解题方法
1 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(4) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
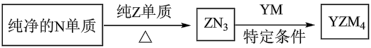
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(4)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
名校
解题方法
2 . 已知短周期元素M、N、X、Y、Z分布在三个周期。N、X最外层电子数相同,2原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是___________ ,写出YM的电子式:___________ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)镓( )的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是
)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是___________ (填字母)。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”,氮化镓可用于制作电子产品的充电器
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
(4) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
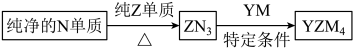
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
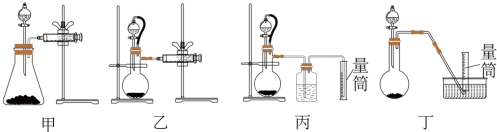
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则 样品纯度为
样品纯度为___________ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)镓(
 )的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是
)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”,氮化镓可用于制作电子产品的充电器
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

(4)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
名校
解题方法
3 . 乙二胺四乙酸铁钠可用于感光材料冲洗药品及漂白剂,化学式为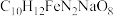 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下:
(1)基态氯原子的价层电子排布图为___________ 。
(2)下列氮原子能量最高的是___________(填标号)。
(3)EDTA的组成元素中C、N、O的第一电离能由大到小顺序为___________ (填元素符号)。碳原子的杂化轨道类型为___________ 。
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为___________ 。
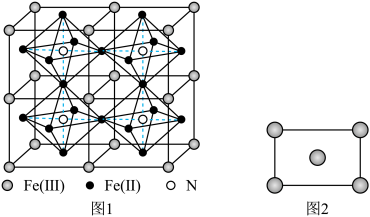
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为___________ 。___________ 区(填“s”“p”“d”或“ds”)。铁的某种晶胞沿面对角线的位置切下之后可以得到如图2所示的截面。假设铁的原子半径为a nm,则该铁晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
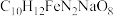 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下: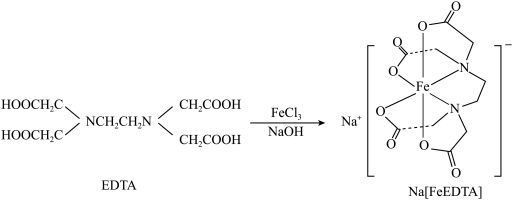
(1)基态氯原子的价层电子排布图为
(2)下列氮原子能量最高的是___________(填标号)。
A.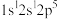 | B. | C. | D.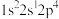 |
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为
 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2023-04-23更新
|
902次组卷
|
8卷引用:福建省百校联盟2023届高三第三次模拟考试化学试题
福建省百校联盟2023届高三第三次模拟考试化学试题福建省百校联盟2023届高三下学期第三次模拟考试化学试题(已下线)押题密卷 02-【热题狂飙】2023年高考化学样卷(全国卷专用)广西壮族自治区南宁市第二中学2023届高三下学期收网考理科综合化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)北京市第二中学2022-2023学年高二下学期期末考试化学试题2023届广西钦州市灵山县那隆中学高三下学期5月考前冲刺保温卷理综试卷-高中化学北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题
名校
解题方法
4 . 电石(主要成分为 )是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
)是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
(1)碳元素在元素周期表中的位置为_______ ; 的电子式为
的电子式为_______ 。
(2)①目前工业上合成电石主要采用氧热法。
已知: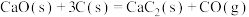
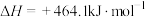 ;
;

 。
。
若不考虑热量耗散,物料转化率均为 ,最终炉中出来的气体只有
,最终炉中出来的气体只有 。则为了维持热平衡,每生产
。则为了维持热平衡,每生产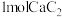 ,投料的量为
,投料的量为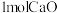 、
、_______ 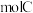 及
及_______ 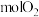 。
。
②制乙炔后的固体废渣主要成分为 ,可用于制取漂白粉,制取漂白粉的化学方程式为
,可用于制取漂白粉,制取漂白粉的化学方程式为_______ 。
(3)乙炔是二种重要的有机化工原料,乙炔在不同的反应条件下可以转化成下列化合物:
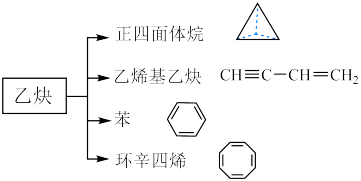
下列说法正确的是_______(填标号)。
(4)以乙炔为原料可制备维尼纶(PVAC),其合成路线如下:
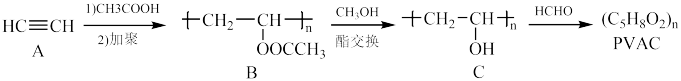
① 中官能团名称为
中官能团名称为_______ 。
② 经过两步反应,第二步为加聚反应,第一步反应类型为
经过两步反应,第二步为加聚反应,第一步反应类型为_______ 。
③ 的反应过程中另一种生成物的结构简式为
的反应过程中另一种生成物的结构简式为_______ 。
 )是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
)是重要的基本化工原料,主要用于生产乙炔。回答下列问题:(1)碳元素在元素周期表中的位置为
 的电子式为
的电子式为(2)①目前工业上合成电石主要采用氧热法。
已知:
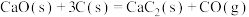
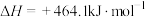 ;
;
 。
。若不考虑热量耗散,物料转化率均为
 ,最终炉中出来的气体只有
,最终炉中出来的气体只有 。则为了维持热平衡,每生产
。则为了维持热平衡,每生产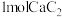 ,投料的量为
,投料的量为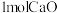 、
、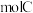 及
及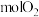 。
。②制乙炔后的固体废渣主要成分为
 ,可用于制取漂白粉,制取漂白粉的化学方程式为
,可用于制取漂白粉,制取漂白粉的化学方程式为(3)乙炔是二种重要的有机化工原料,乙炔在不同的反应条件下可以转化成下列化合物:

下列说法正确的是_______(填标号)。
| A.乙烯基乙炔分子中所有原子可以处于同一直线上 |
B.常温下, 苯中含碳碳双键数目约为 苯中含碳碳双键数目约为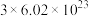 |
| C.环辛四烯与苯均能使酸性高锰酸钾溶液褪色 |
| D.正四面体烷与环辛四烯的一取代物均只有一种 |
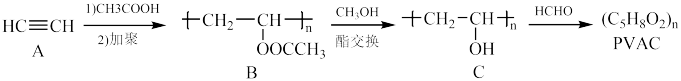
①
 中官能团名称为
中官能团名称为②
 经过两步反应,第二步为加聚反应,第一步反应类型为
经过两步反应,第二步为加聚反应,第一步反应类型为③
 的反应过程中另一种生成物的结构简式为
的反应过程中另一种生成物的结构简式为
您最近一年使用:0次
名校
5 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_____ ;N的简单离子的核外电子排布示意图为_____ 。
(2)用电子式表示化合物YN的形成过程:_____ 。
(3)在YZO2与YX的混合液中,通入足量CO2,是工业制取Y3ZX6的一种方法,写出该反应的化学方程式:_____ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_____ (填字母)。
a.Ga位于元素周期表第四周期IVA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出NO2气体,同时生成H3AsO4和Ga(NO3)3,写出该反应的化学方程式:_____ 。
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示。
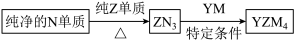
特定条件利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①YZM4遇水反应的化学方程式为_____ 。
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_____ (填编号)。
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则YZM4样品纯度为_____ (用代数式表示)。
(1)Y在周期表中的位置是
(2)用电子式表示化合物YN的形成过程:
(3)在YZO2与YX的混合液中,通入足量CO2,是工业制取Y3ZX6的一种方法,写出该反应的化学方程式:
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期IVA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出NO2气体,同时生成H3AsO4和Ga(NO3)3,写出该反应的化学方程式:
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示。

特定条件利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①YZM4遇水反应的化学方程式为
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则YZM4样品纯度为
您最近一年使用:0次
名校
解题方法
6 . 以下是用苯作为原料制备一系列化合物的转化关系图。
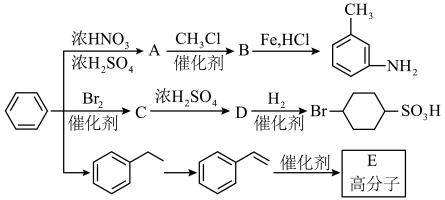
已知: 。
。
回答下列问题:
(1)C中所含官能团名称为_______ 。
(2)由D生成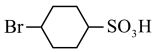 的反应类型为
的反应类型为_______ 。
(3)由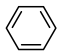 生成A的化学反应方程式为
生成A的化学反应方程式为_______ 。
(4)E具有优良的绝热、绝缘性能,可用作包装材料和建筑材料,写出以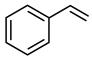 为原料合成E的化学反应方程式
为原料合成E的化学反应方程式_______ 。
(5) 分子中最多有
分子中最多有_______ 个原子共面。
(6)D分子中苯环上的任意两个氢原子被氯原子取代后,得到的二氯代物有_______ 种同分异构体。
(7)已知: (R表示烃基),苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯环为原料有以下合成路线,则F的结构简式为
(R表示烃基),苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯环为原料有以下合成路线,则F的结构简式为_______ 。

已知:
 。
。 回答下列问题:
(1)C中所含官能团名称为
(2)由D生成
 的反应类型为
的反应类型为(3)由
 生成A的化学反应方程式为
生成A的化学反应方程式为(4)E具有优良的绝热、绝缘性能,可用作包装材料和建筑材料,写出以
 为原料合成E的化学反应方程式
为原料合成E的化学反应方程式(5)
 分子中最多有
分子中最多有(6)D分子中苯环上的任意两个氢原子被氯原子取代后,得到的二氯代物有
(7)已知:
 (R表示烃基),苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯环为原料有以下合成路线,则F的结构简式为
(R表示烃基),苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯环为原料有以下合成路线,则F的结构简式为
您最近一年使用:0次
2023-04-13更新
|
335次组卷
|
2卷引用:湖南省多校联考2022-2023学年高二下学期期中考试化学试题
名校
解题方法
7 . 如图为元素周期表的一部分,请根据元素①~⑧在表中的位置,回答下列问题:

(1)请写出元素⑦在元素周期表中的位置___________ 。在上述元素的最高价氧化物对应的水化物中,酸性最强的是___________ (用化学式表示)。
(2)由元素①、④、⑤形成的化合物的电子式为___________ ,该物质属于___________ (填“离子”或“共价”)化合物。
(3)③、④、⑤、⑥的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(4)在发生地震后,地震灾区需要大量的“84消毒液”来消毒杀菌。84消毒液(主要成分为NaClO)和洁厕灵(主要成分为盐酸)混合使用会产生一种有毒气体,写出两者混合时发生反应的离子方程式:___________ 。
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
若A、B、C含同一金属元素,X为电解质溶液,可电离出 ,所有反应都在溶液中进行。B的化学式为
,所有反应都在溶液中进行。B的化学式为___________ ,X的化学式为___________ 。

(1)请写出元素⑦在元素周期表中的位置
(2)由元素①、④、⑤形成的化合物的电子式为
(3)③、④、⑤、⑥的简单离子半径由大到小的顺序是
(4)在发生地震后,地震灾区需要大量的“84消毒液”来消毒杀菌。84消毒液(主要成分为NaClO)和洁厕灵(主要成分为盐酸)混合使用会产生一种有毒气体,写出两者混合时发生反应的离子方程式:
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:

若A、B、C含同一金属元素,X为电解质溶液,可电离出
 ,所有反应都在溶液中进行。B的化学式为
,所有反应都在溶液中进行。B的化学式为
您最近一年使用:0次
8 . 短周期主族元素组成的中学化学常见物质,发生如图所示的转化关系(部分反应物、产物和反应条件已略去),常温下,A、E为气体单质,分别呈黄绿色、无色,C为两性氢氧化物,F为淡黄色固体,固态G可用于人工降雨,H为生活中最常见的无色无味液体。
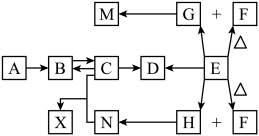
回答下列问题:
(1)组成物质A的元素,在元素周期表中的位置是_______ 。
(2)G的电子式为________ ,F中含有的化学键为______ (填“离子键”“极性键”或“非极性键”)。
(3)下列转化中属于氧化还原反应的是_______ (填标号)。
①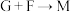 ②
②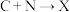 ③
③
(4)上述转化关系的方框中,属于盐类物质的有_________ (填化学式)。
(5)D和N溶液反应的化学方程式为_________ ;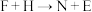 对应的离子方程式为
对应的离子方程式为_______ 。
(6)实验室中检验B溶液中阴离子的方法为_________ 。

回答下列问题:
(1)组成物质A的元素,在元素周期表中的位置是
(2)G的电子式为
(3)下列转化中属于氧化还原反应的是
①
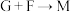 ②
②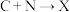 ③
③
(4)上述转化关系的方框中,属于盐类物质的有
(5)D和N溶液反应的化学方程式为
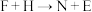 对应的离子方程式为
对应的离子方程式为(6)实验室中检验B溶液中阴离子的方法为
您最近一年使用:0次
名校
解题方法
9 . 六氟锑酸钠( )是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等。中南大学的杨天足教授提出了一种水溶液中由锑白(主要含
)是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等。中南大学的杨天足教授提出了一种水溶液中由锑白(主要含 、
、 和
和 、
、 、CuO等)合成六氟锑酸钠的工艺流程如图所示:
、CuO等)合成六氟锑酸钠的工艺流程如图所示:

已知:① 的性质与
的性质与 类似;②
类似;② 可溶于
可溶于 溶液;③
溶液;③ 晶体难溶于水。请回答下列问题:
晶体难溶于水。请回答下列问题:
(1)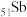 在元素周期表中的位置是
在元素周期表中的位置是___________ ,属于___________ 区元素。
(2)“碱浸、还原”时, 发生反应的离子方程式为
发生反应的离子方程式为___________ ;若 与
与 反应计量关系为
反应计量关系为 ,则氧化物为
,则氧化物为___________ 。
(3)“除杂”时,当溶液中出现蓝色沉淀,立即停止加入 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的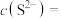
___________ [结果保留两位有效数字,常温下, ,
, ]。
]。
(4)“转化”时控温约80℃的原因是___________ 。
(5)“氟化”中发生的反应化学方程式为___________ 。
(6)氟锑酸化学式为 ,酸性比纯硫酸要强
,酸性比纯硫酸要强 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成
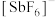 ,
, 离子的空间构型为
离子的空间构型为___________ 。
 )是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等。中南大学的杨天足教授提出了一种水溶液中由锑白(主要含
)是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等。中南大学的杨天足教授提出了一种水溶液中由锑白(主要含 、
、 和
和 、
、 、CuO等)合成六氟锑酸钠的工艺流程如图所示:
、CuO等)合成六氟锑酸钠的工艺流程如图所示:
已知:①
 的性质与
的性质与 类似;②
类似;② 可溶于
可溶于 溶液;③
溶液;③ 晶体难溶于水。请回答下列问题:
晶体难溶于水。请回答下列问题:(1)
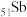 在元素周期表中的位置是
在元素周期表中的位置是(2)“碱浸、还原”时,
 发生反应的离子方程式为
发生反应的离子方程式为 与
与 反应计量关系为
反应计量关系为 ,则氧化物为
,则氧化物为(3)“除杂”时,当溶液中出现蓝色沉淀,立即停止加入
 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的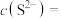
 ,
, ]。
]。(4)“转化”时控温约80℃的原因是
(5)“氟化”中发生的反应化学方程式为
(6)氟锑酸化学式为
 ,酸性比纯硫酸要强
,酸性比纯硫酸要强 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成
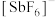 ,
, 离子的空间构型为
离子的空间构型为
您最近一年使用:0次
名校
解题方法
10 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
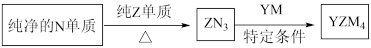
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次



