名校
1 . 酸性条件下,砷酸具有较强氧化性,能被正四价硫、碘离子等还原为正三价砷。某工厂以废渣(主要含 )制备砷的流程如下:
)制备砷的流程如下:
(1)砷的原子结构示意图为_______ 。 的结构简式为
的结构简式为 ,0.5mol
,0.5mol  所含有S-S键的物质的量为
所含有S-S键的物质的量为_______ mol。
(2)“碱浸”后溶液中含有 、
、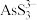 ,则该工序主反应的化学方程式为
,则该工序主反应的化学方程式为______________ 。
(3)“沉砷”时,加入试剂A的作用为_______ ;结合必要的化学用语说明为了提高 的产率,加石灰乳时控制温度45℃~85℃的目的是
的产率,加石灰乳时控制温度45℃~85℃的目的是_______ 。
(4)滤渣1含硫酸钙和沉淀a,实验室里,用_______ 试剂除去试管壁上的沉淀a。
(5)加热时“再还原”的化学方程式为_______ 。“还原”中,氧化产物与还原产物的物质的量之比为_______ 。
(6)该流程中可以循环使用的物质为_______ 。
(7)设计实验检验“还原”后的溶液中是否存在正五价砷元素_______ 。
 )制备砷的流程如下:
)制备砷的流程如下: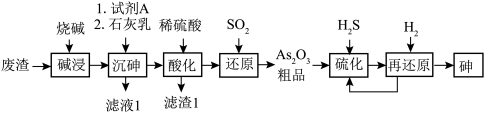
(1)砷的原子结构示意图为
 的结构简式为
的结构简式为 ,0.5mol
,0.5mol  所含有S-S键的物质的量为
所含有S-S键的物质的量为(2)“碱浸”后溶液中含有
 、
、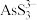 ,则该工序主反应的化学方程式为
,则该工序主反应的化学方程式为(3)“沉砷”时,加入试剂A的作用为
 的产率,加石灰乳时控制温度45℃~85℃的目的是
的产率,加石灰乳时控制温度45℃~85℃的目的是(4)滤渣1含硫酸钙和沉淀a,实验室里,用
(5)加热时“再还原”的化学方程式为
(6)该流程中可以循环使用的物质为
(7)设计实验检验“还原”后的溶液中是否存在正五价砷元素
您最近一年使用:0次
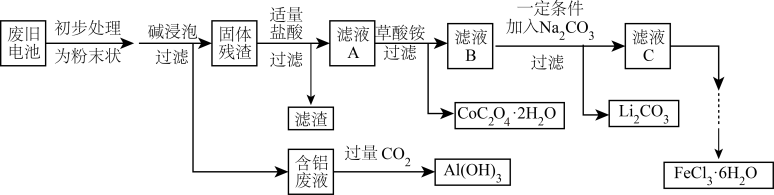
2 . 钴酸锂( )电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
已知:①还原性: ;
;
② 和
和 结合生成较稳定的
结合生成较稳定的 ,在强酸性条件下分解重新生成
,在强酸性条件下分解重新生成 。
。
(1)基态 的简化电子排布式为
的简化电子排布式为___________ 。
(2)碱浸泡时铝转化为[Al(OH)4]- 的离子方程式为___________ 。
(3) 和HCl反应时的物质的量之比为
和HCl反应时的物质的量之比为___________ 。滤液A中的溶质除HCl、LiCl外还有___________ (填化学式)。滤渣的主要成分为___________ (填化学式)。
(4)在空气中加热一定质量的 固体样品时,其固体失重率数据见下表(其中220~300℃不发生反应),请完成300~350℃时的化学方程式。已知:
固体样品时,其固体失重率数据见下表(其中220~300℃不发生反应),请完成300~350℃时的化学方程式。已知:
① 在空气中加热时的气体产物为
在空气中加热时的气体产物为 。
。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
③ 相对分子质量为183。
相对分子质量为183。
(5)已知常温下 的溶度积常数
的溶度积常数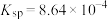 ,该温度下将浓度为0.021mol/L的
,该温度下将浓度为0.021mol/L的 和浓度为0.02mol/L的
和浓度为0.02mol/L的 溶液等体积混合,则溶液中的
溶液等体积混合,则溶液中的 浓度为
浓度为___________ mol/L。
 )电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
已知:①还原性:
 ;
;②
 和
和 结合生成较稳定的
结合生成较稳定的 ,在强酸性条件下分解重新生成
,在强酸性条件下分解重新生成 。
。(1)基态
 的简化电子排布式为
的简化电子排布式为(2)碱浸泡时铝转化为[Al(OH)4]- 的离子方程式为
(3)
 和HCl反应时的物质的量之比为
和HCl反应时的物质的量之比为(4)在空气中加热一定质量的
 固体样品时,其固体失重率数据见下表(其中220~300℃不发生反应),请完成300~350℃时的化学方程式。已知:
固体样品时,其固体失重率数据见下表(其中220~300℃不发生反应),请完成300~350℃时的化学方程式。已知:①
 在空气中加热时的气体产物为
在空气中加热时的气体产物为 。
。②固体失重率=对应温度下样品失重的质量/样品的初始质量。
③
 相对分子质量为183。
相对分子质量为183。| 序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
| I | 120~220 | 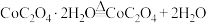 | 19.67% |
| II | 300~350 | 59.02% |
(5)已知常温下
 的溶度积常数
的溶度积常数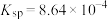 ,该温度下将浓度为0.021mol/L的
,该温度下将浓度为0.021mol/L的 和浓度为0.02mol/L的
和浓度为0.02mol/L的 溶液等体积混合,则溶液中的
溶液等体积混合,则溶液中的 浓度为
浓度为
您最近一年使用:0次
名校
3 . 1986年,化学家用化学法制氟,其原理如下:
① (未配平);
(未配平);
② ;
;
③ 。
。
下列说法正确的是
①
 (未配平);
(未配平);②
 ;
;③
 。
。下列说法正确的是
| A.①中氧化产物和还原产物的物质的量之比为2∶3 |
B. 能与 能与 溶液发生反应 溶液发生反应 |
C. 因为其具有强酸性而被用于刻蚀玻璃 因为其具有强酸性而被用于刻蚀玻璃 |
D.用上述方法制备1  ,理论上需要消耗30 ,理论上需要消耗30  |
您最近一年使用:0次
2024-03-27更新
|
169次组卷
|
5卷引用:江西省部分地区2023-2024学年高一下学期3月月考化学试题
名校
解题方法
4 . 某化学兴趣小组为培养同学们对科学探究的兴趣,设计图1所示实验来探究HS 与Cu2+的反应:
与Cu2+的反应:
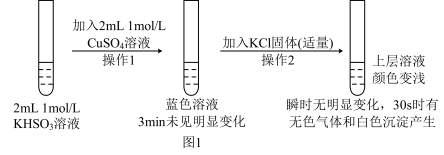
已知:氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水。
(1)将操作2后生成的无色气体通入氯化铁溶液中,___________ (填实验现象),说明该气体为SO2,发生的反应中,氧化剂与还原剂的物质的量之比为___________ 。
(2)操作2后生成的白色沉淀为___________ (填化学式),生成该沉淀和无色气体的反应的离子方程式为___________ 。
(3)根据氧化还原反应的规律,某同学推测操作2中涉及HS 与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于HS
与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于HS ,用图2所示装置(a、b均为石墨电极)进行实验验证。
,用图2所示装置(a、b均为石墨电极)进行实验验证。

①K闭合时,一段时间后指针几乎归零。
②向U形管右管添加___________ ,a电极为___________ 极,产生的现象证实了推测,现象是___________ 。
(4)基于(3)中实验,该同学进一步得出猜想:物质的氧化性和还原性与产物浓度有关,产物浓度越小,对应物质的氧化性或还原性越强。该同学用图2装置再次进行实验,以丰富验证该猜想。与(3)中实验对比,不同的操作是向U形管左管添加___________ 。
 与Cu2+的反应:
与Cu2+的反应:
已知:氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水。
(1)将操作2后生成的无色气体通入氯化铁溶液中,
(2)操作2后生成的白色沉淀为
(3)根据氧化还原反应的规律,某同学推测操作2中涉及HS
 与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于HS
与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于HS ,用图2所示装置(a、b均为石墨电极)进行实验验证。
,用图2所示装置(a、b均为石墨电极)进行实验验证。
①K闭合时,一段时间后指针几乎归零。
②向U形管右管添加
(4)基于(3)中实验,该同学进一步得出猜想:物质的氧化性和还原性与产物浓度有关,产物浓度越小,对应物质的氧化性或还原性越强。该同学用图2装置再次进行实验,以丰富验证该猜想。与(3)中实验对比,不同的操作是向U形管左管添加
您最近一年使用:0次
名校
解题方法
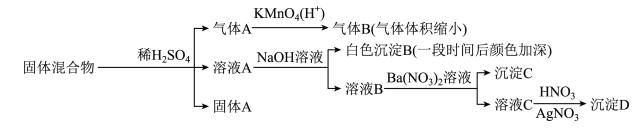
5 . 某固体混合物可能由 、
、 、FeS、
、FeS、 、
、 、
、 中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
 、
、 、FeS、
、FeS、 、
、 、
、 中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
A.气体A中一定含有 | B.固体A中一定含有S和 |
C.该固体混合物至少含 和FeS中的一种 和FeS中的一种 | D.该固体混合物中一定含有 、 、 、 、 |
您最近一年使用:0次
2023-09-27更新
|
680次组卷
|
5卷引用:江西省部分高中学校2024届高三上学期9月大联考化学试题
名校
解题方法
6 . 如图所示,实验室中利用洁净的铜片(0.3 mol)和浓硫酸进行反应,实验中无气体生成,Y型管左侧得到Cu2S和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。下列说法错误的是
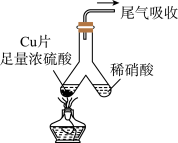

| A.白色固体为CuSO4 |
| B.NO为还原产物,b为氧化产物 |
| C.NO与b的物质的量之和可能为0.2 mol |
| D.参加反应的浓硫酸中,表现氧化性的占25% |
您最近一年使用:0次
2023-05-16更新
|
1207次组卷
|
3卷引用:江西省南昌市江西师范大学附属中学2023-2024学年高一下学期化学素养测试试题
名校
解题方法
7 . 探究硫及其化合物的性质,下列方案设计、现象和结论中有不正确的是
实验方案 | 现象 | 结论 | |
A | 在过硫化钠(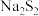 )中加入稀盐酸 )中加入稀盐酸 | 产生淡黄色沉淀和臭鸡蛋气味的气体。 | 发生歧化反应: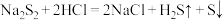 |
B | 已知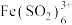 呈红棕色,将 呈红棕色,将 气体通入 气体通入 溶液中 溶液中 | 溶液先变为红棕色,过一段时间又变成浅绿色。 |  与 与 络合反应速率比氧化还原反应速率快,但氧化还原反应的平衡常数更大。 络合反应速率比氧化还原反应速率快,但氧化还原反应的平衡常数更大。 |
C | 燃着的镁条插入盛有 的集气瓶中。冷却后,往集气瓶中加入适量稀盐酸,静置,取少量上层清液于试管中,滴加少量 的集气瓶中。冷却后,往集气瓶中加入适量稀盐酸,静置,取少量上层清液于试管中,滴加少量 溶液。 溶液。 | 剧烈燃烧,集气瓶口有淡黄色固体附着,集气瓶底有白色固体生成。试管中没有产生黑色沉淀 | 镁能在 中燃烧: 中燃烧: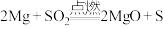 |
D | 探究电石与水的反应 | 将电石与饱和食盐水反应产生的气体通入酸性高锰酸钾溶液,观察现象 | 若酸性高锰酸钾溶液褪色,说明电石与水反应生成了乙炔 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-22更新
|
1845次组卷
|
6卷引用:江西省抚州市乐安县第二中学2023-2024学年高三上学期11月期中化学试题
江西省抚州市乐安县第二中学2023-2024学年高三上学期11月期中化学试题浙江省天域全国名校协作体2022-2023学年高三下学期4月阶段性联考化学试题重庆市万州第二高级中学2023-2024学年高三上学期7月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市第一中学2023-2024学年高三上学期月考卷(三)化学试题2024年山东省潍坊市高三下学期高考模拟训练调研试题(二)
8 . 将一定量的铁和铜组成的混合物加入稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3mol·L-1NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。下列叙述不正确的是
| A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100mL |
| B.当金属全部溶解时收集到NO气体的体积折算成标准状况为2.24L |
| C.参加反应的金属的总质量3.6g<m<9.6g |
| D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.3mol |
您最近一年使用:0次
名校
解题方法
9 . 对于反应: ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是| A.该反应中,有三种元素化合价发生改变 |
B.该反应的还原剂为 和 和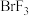 ,氧化产物为 ,氧化产物为 和 和 |
C.1.5mol 参加反应,被 参加反应,被 还原的 还原的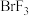 为0.4mol 为0.4mol |
D.1.5mol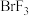 参加反应,有4mol 参加反应,有4mol 转移 转移 |
您最近一年使用:0次
2023-03-11更新
|
1216次组卷
|
4卷引用:江西省宜春市丰城市第九中学2023-2024学年高一下学期4月月考化学试题
江西省宜春市丰城市第九中学2023-2024学年高一下学期4月月考化学试题浙江省强基联盟2022-2023学年高三上学期选考仿真密卷化学试题(已下线)化学-2023年高考押题预测卷01(浙江卷)(含考试版、全解全析、参考答案、答题卡)湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题
名校
解题方法
10 . 将5.6g镁和铜的混合物加入到500mL1mol/L的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入2mol/LNaOH溶液至沉淀完全,生成沉淀的质量为10.7g,下列叙述错误的是
| A.当金属全部溶解时,电子转移的数目为0.3NA |
| B.混合物镁和铜的物质的量之比为1:2 |
| C.当金属全部溶解时,产生的NO气体的体积在标准状况下为2.24L |
| D.当生成的沉淀量达到最大时,消耗NaOH溶液的体积为200mL |
您最近一年使用:0次
2023-01-19更新
|
1611次组卷
|
3卷引用:江西省景德镇市2022-2023学年高一下学期4月期中考试化学试题



