1 . 从含钴余液(含 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下:
(1)在去除钙、镁时,选择适当加热条件的理由是___________ ;该步骤控制pH是影响除钙镁效果的重要因素,下图是不同pH条件下硫化钴含量和钴收率图,根据图中信息选择最适宜的pH为___________ ;___________ ;
(3)已知P507萃取剂 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大 的萃取率,原因是
的萃取率,原因是___________ ;
(4)反萃取时加入的试剂a应为___________(填代号);
(5)沉钴的离子方程式为___________ ;
(6)系列操作中如何检验 是否洗涤干净
是否洗涤干净___________ ;
(7)空气中煅烧 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下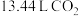 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为___________ 。
 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下: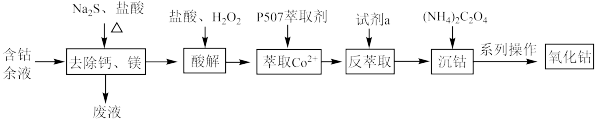
(1)在去除钙、镁时,选择适当加热条件的理由是

(3)已知P507萃取剂
 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大
 的萃取率,原因是
的萃取率,原因是(4)反萃取时加入的试剂a应为___________(填代号);
A. | B.HCl | C.NaOH | D. |
(5)沉钴的离子方程式为
(6)系列操作中如何检验
 是否洗涤干净
是否洗涤干净(7)空气中煅烧
 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下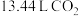 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为
您最近一年使用:0次
名校
解题方法
2 . 碳酸镍具有良好的催化性能,在化学和工业领域广泛应用。利用废镍催化剂(主要成分为 Ni及其氧化物、Al和 Fe的氧化物)获得碳酸镍的过程如下:
回答下列问题:
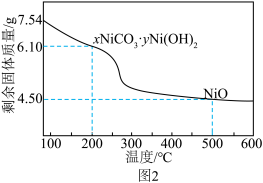
(1)“酸浸”时,稀硫酸比稀硝酸更合理,理由是_______ 。
(2)“除杂”时,先加入30% H2O2溶液,再用30% NaOH溶液调pH, 适当升温,反应2 h。
①若除杂后溶液中Ni2+浓度为0.10 mol/L,需控制溶液的pH范围是_______ 。
②加入30% H2O2的目的为_______ 。
③该过程还可用NaClO替代H2O2, 调节pH 为3.5,其反应的离子方程式为_______ 。
(3)“沉镍”后获得产品的一系列操作为_______ 。
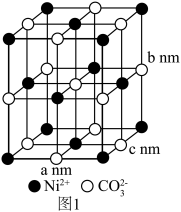
(4)碳酸镍的晶胞如图1所示,Ni2+的配位数为_______ ,晶胞密度为_______ g/cm³(列出计算式,阿伏加德罗常数的值为NA)。_______ 。
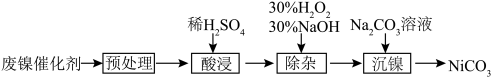
| 物质 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 2.2 | 3.7 | 7.2 | 7.5 |
| 完全沉淀pH | 3.2 | 4.7 | 8.7 | 9.0 |
(1)“酸浸”时,稀硫酸比稀硝酸更合理,理由是
(2)“除杂”时,先加入30% H2O2溶液,再用30% NaOH溶液调pH, 适当升温,反应2 h。
①若除杂后溶液中Ni2+浓度为0.10 mol/L,需控制溶液的pH范围是
②加入30% H2O2的目的为
③该过程还可用NaClO替代H2O2, 调节pH 为3.5,其反应的离子方程式为
(3)“沉镍”后获得产品的一系列操作为
(4)碳酸镍的晶胞如图1所示,Ni2+的配位数为
您最近一年使用:0次
2024-03-22更新
|
692次组卷
|
4卷引用:东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2023-2024学年高三下学期第一次联合模拟考化学试卷
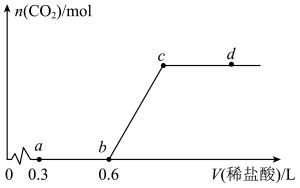
3 . 向 溶液中通入一定体积的
溶液中通入一定体积的 使其充分反应,再向所得溶液中逐滴滴加
使其充分反应,再向所得溶液中逐滴滴加 的稀盐酸,测得产生
的稀盐酸,测得产生 的物质的量随加入盐酸的体积变化如图所示(不考虑
的物质的量随加入盐酸的体积变化如图所示(不考虑 的溶解)。下列说法正确的是
的溶解)。下列说法正确的是
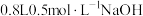 溶液中通入一定体积的
溶液中通入一定体积的 使其充分反应,再向所得溶液中逐滴滴加
使其充分反应,再向所得溶液中逐滴滴加 的稀盐酸,测得产生
的稀盐酸,测得产生 的物质的量随加入盐酸的体积变化如图所示(不考虑
的物质的量随加入盐酸的体积变化如图所示(不考虑 的溶解)。下列说法正确的是
的溶解)。下列说法正确的是
A.根据题中所给信息,可以求得图中的c点坐标为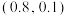 |
| B.由0到a的过程中,溶质的总物质的量持续增大 |
| C.由a到b的过程中,发生了1个化学反应 |
D.若减少初始 的通入量,则c点横纵坐标都将减小 的通入量,则c点横纵坐标都将减小 |
您最近一年使用:0次
名校
解题方法
4 . 某固体混合物可能由 、
、 、FeS、
、FeS、 、
、 、
、 中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
 、
、 、FeS、
、FeS、 、
、 、
、 中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
A.气体A中一定含有 | B.固体A中一定含有S和 |
C.该固体混合物至少含 和FeS中的一种 和FeS中的一种 | D.该固体混合物中一定含有 、 、 、 、 |
您最近一年使用:0次
2023-09-27更新
|
695次组卷
|
5卷引用:辽宁省朝阳地区2023-2024学年高三上学期期中考试化学试题
名校
解题方法
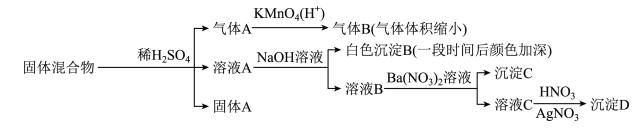
5 . 如图所示,实验室中利用洁净的铜片(0.3 mol)和浓硫酸进行反应,实验中无气体生成,Y型管左侧得到Cu2S和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。下列说法错误的是

| A.白色固体为CuSO4 |
| B.NO为还原产物,b为氧化产物 |
| C.NO与b的物质的量之和可能为0.2 mol |
| D.参加反应的浓硫酸中,表现氧化性的占25% |
您最近一年使用:0次
2023-05-16更新
|
1221次组卷
|
3卷引用:辽宁省实验中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
6 . 下列离子方程式正确的是
| A.少量SO2通入Ca(ClO)2溶液:Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+ |
B.FeI2溶于过量的硝酸溶液中:Fe2++4H++NO =Fe3++NO↑+2H2O =Fe3++NO↑+2H2O |
C.用热NaOH溶液洗涤试管内壁的硫黄:3S+6OH- SO SO +2S2-+3H2O +2S2-+3H2O |
D.Fe与稀硝酸反应,当n(Fe)﹕n(HNO3)=1﹕3时,3Fe+8H++2NO =3Fe2++2NO↑+4H2O =3Fe2++2NO↑+4H2O |
您最近一年使用:0次
2023-04-21更新
|
1416次组卷
|
5卷引用:辽宁省实验中学2023-2024学年高一下学期4月月考测试化学试卷
名校
解题方法
7 . 溶液X中含有下表离子中的某5种,且其浓度均为 (不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
 (不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是阳离子 | 阴离子 |
|
|
| A.X溶液中可能含3种阳离子、2种阴离子 | B.X溶液中不可能含有 或 或 |
C.生成的无色气体是 | D.根据电荷守恒,原溶液中一定含 |
您最近一年使用:0次
2023-04-20更新
|
1276次组卷
|
9卷引用:辽宁省大连市金普新区省示范性高中2022届高三上学期第一次联合考试化学试题
辽宁省大连市金普新区省示范性高中2022届高三上学期第一次联合考试化学试题辽宁省沈阳市铁路实验中学2022-2023学年高一下学期第一次月考化学试题(已下线)上海市华东师范大学第二附属中学2021-2022学年高一下学期3月阶段反馈化学试题上海市育才中学2022-2023学年高三上学期10月月考化学试题黑龙江省鹤岗市绥滨县第一中学2021-2022学年高三上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题河北省秦皇岛市昌黎第一中学2023届高三第一次调研考试化学试题河北省石家庄市第二中学2023-2024高一上学期第一次诊断测评化学试题
名校
解题方法
8 . 把NaOH、 、
、 三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如下图所示。下列说法错误的是
三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如下图所示。下列说法错误的是
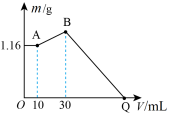
 、
、 三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如下图所示。下列说法错误的是
三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如下图所示。下列说法错误的是
| A.三种固体溶于足量水反应后有NaOH剩余 |
B.B点的沉淀物为 和 和 |
| C.原混合物中NaOH的质量是5.20g |
| D.Q点HCl溶液加入量是120mL |
您最近一年使用:0次
2023-01-04更新
|
1373次组卷
|
2卷引用:辽宁省沈阳市第一二0中学2022-2023学年高一上学期期末考试化学试题
解题方法
9 . 金属M与单质碘在无水醋酸中反应,得到化合物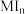 ,提纯干燥后测得其熔点为144.5℃。为确定
,提纯干燥后测得其熔点为144.5℃。为确定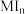 的组成,进行以下实验:称取0.6263g
的组成,进行以下实验:称取0.6263g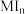 ,置于特制的梨形瓶中,加入50mL 6mol L-1的盐酸,同时加入适量
,置于特制的梨形瓶中,加入50mL 6mol L-1的盐酸,同时加入适量 ,用0.1000mol L-1的碘酸钾溶液进行滴定。随着碘酸钾溶液的加入,可观察到
,用0.1000mol L-1的碘酸钾溶液进行滴定。随着碘酸钾溶液的加入,可观察到 层呈紫色,后逐渐变浅,滴至紫色褪去为终点,此时
层呈紫色,后逐渐变浅,滴至紫色褪去为终点,此时 层呈淡黄色,滴定消耗碘酸钾溶液20.00mL。在
层呈淡黄色,滴定消耗碘酸钾溶液20.00mL。在 中显黄色的物质在历史上曾被误认为
中显黄色的物质在历史上曾被误认为 。
。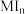 是
是
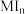 ,提纯干燥后测得其熔点为144.5℃。为确定
,提纯干燥后测得其熔点为144.5℃。为确定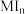 的组成,进行以下实验:称取0.6263g
的组成,进行以下实验:称取0.6263g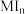 ,置于特制的梨形瓶中,加入50mL 6mol L-1的盐酸,同时加入适量
,置于特制的梨形瓶中,加入50mL 6mol L-1的盐酸,同时加入适量 ,用0.1000mol L-1的碘酸钾溶液进行滴定。随着碘酸钾溶液的加入,可观察到
,用0.1000mol L-1的碘酸钾溶液进行滴定。随着碘酸钾溶液的加入,可观察到 层呈紫色,后逐渐变浅,滴至紫色褪去为终点,此时
层呈紫色,后逐渐变浅,滴至紫色褪去为终点,此时 层呈淡黄色,滴定消耗碘酸钾溶液20.00mL。在
层呈淡黄色,滴定消耗碘酸钾溶液20.00mL。在 中显黄色的物质在历史上曾被误认为
中显黄色的物质在历史上曾被误认为 。
。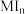 是
是A.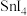 | B. | C.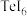 | D. |
您最近一年使用:0次
名校
解题方法
10 .  可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
 可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是| A.氧化产物与还原产物物质的量之比为3:2 |
B.反应中有4.48 L  被氧化 被氧化 |
C.转移电子数为1.2 |
D.原混合气体中NO、 物质的量之比为3:7或4:1 物质的量之比为3:7或4:1 |
您最近一年使用:0次
2022-12-07更新
|
1482次组卷
|
4卷引用:辽宁省六校协作体2023-2024学年高一上学期第三次考试化学试题

 、
、 、
、 、
、
 、
、 、
、 、
、


