解题方法
1 . 某实验小组对 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。
资料: 为白色固体,易溶于水。
为白色固体,易溶于水。
【实验1】
I.探究反应的产物
(1)经检验实验中的黑色固体均为 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为_________ 。
【实验2】
①证明实验1-2所得固体洗涤干净的实验操作及现象是_________ 。
②依据实验2,推测S与NaOH反应的离子方程式为_________ 。
③实验2中,加入硝酸的目的是_________ 。
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:_____ 。
□ □
□ □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
说明:本实验中,电压表的读数越大,氧化剂的氧化性(或还原剂的还原性)越强。
(4)资料表明,对于电极反应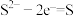 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是_________ 。
(5)小组同学用实验3装置补做实验3-5,排除了 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为_________ 。
(6)综合上述实验可以得到的结论有_________ 。
 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。资料:
 为白色固体,易溶于水。
为白色固体,易溶于水。【实验1】
序号 | 实验操作 | 实验现象 |
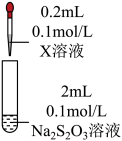
| 向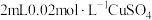 溶液中加入 溶液中加入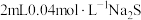 溶液 溶液 | 产生黑色固体 |
| 向 饱和 饱和 溶液(约为 溶液(约为 , , 约为3)中加入 约为3)中加入 饱和 饱和 溶液(约为 溶液(约为 , , 约为13) 约为13) | 迅速产生大量黑色固体、少量红色固体和黄色固体,静置后红色固体减少、黑色固体增多 |
(1)经检验实验中的黑色固体均为
 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为【实验2】
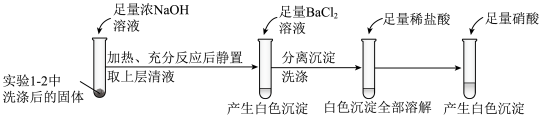
①证明实验1-2所得固体洗涤干净的实验操作及现象是
②依据实验2,推测S与NaOH反应的离子方程式为
③实验2中,加入硝酸的目的是
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:
□
 □
□ □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
序号 | 实验方案 | 实验现象 | |
3-1 |
| a:饱和 溶液 溶液b:饱和  溶液 溶液 | 电压表指针偏转,读数为0.85V |
3-2 | a: 溶液 溶液b: 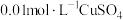 溶液 溶液 | 电压表指针偏转,读数为0.46V | |
3-3 | a: 溶液(pH调至13) 溶液(pH调至13)b: 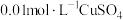 溶液 溶液 | 电压表指针偏转,读数为0.68V | |
3-4 | a: 溶液(pH调至13) 溶液(pH调至13)b: 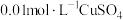 溶液 溶液 | 电压表指针略偏转,读数为0.10V | |
(4)资料表明,对于电极反应
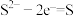 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是(5)小组同学用实验3装置补做实验3-5,排除了
 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为(6)综合上述实验可以得到的结论有
您最近半年使用:0次
名校
2 .  可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分
可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 )和黄铁矿
)和黄铁矿 为原料制备
为原料制备 其流程如图。
其流程如图。
回答下列问题:
(1) 的价层电子排布图
的价层电子排布图_______ ,“酸浸”过程中,滤渣1的主要成分为S、_______ (填化学式)。
(2)“酸浸”过程中 、
、 的质量浓度、Mn的浸出率与时间的关系如图所示。
的质量浓度、Mn的浸出率与时间的关系如图所示。_______ 。
②80~100min时, 浓度上升的原因可能是
浓度上升的原因可能是_______ 。
(3)“沉铁”过程中依次加入的试剂X、Y为_______ (填字母)。
A.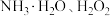 B.
B. C.
C.
(4)“滤液”萃取前调 ,若有机萃取剂用表HR示,则发生萃取的反应可表示为
,若有机萃取剂用表HR示,则发生萃取的反应可表示为 。若,
。若,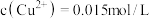 多次萃取后水相中
多次萃取后水相中 为
为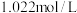 ,则铜的萃取率为
,则铜的萃取率为_______ (结果保留小数点后一位,溶液体积变化忽略不计)。
(5)利用 溶液,用空气氧化法制备
溶液,用空气氧化法制备 。在
。在 溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备
溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备 。写出上述反应的离子方程式:
。写出上述反应的离子方程式:_______ 。
(6)结合图像分析,若要获得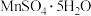 晶体的系列操作步骤为加热
晶体的系列操作步骤为加热_______ 得到_______ ℃饱和溶液,_______ ,过滤酒精洗涤,低温干燥。
 可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分
可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 )和黄铁矿
)和黄铁矿 为原料制备
为原料制备 其流程如图。
其流程如图。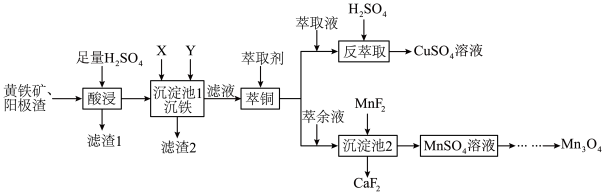
 |  |  |  | |
| 完全沉淀时的pH | 3.7 | 9.7 | 7.4 | 9.8 |
(1)
 的价层电子排布图
的价层电子排布图(2)“酸浸”过程中
 、
、 的质量浓度、Mn的浸出率与时间的关系如图所示。
的质量浓度、Mn的浸出率与时间的关系如图所示。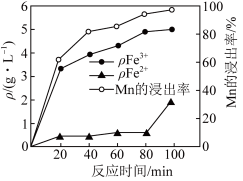
②80~100min时,
 浓度上升的原因可能是
浓度上升的原因可能是(3)“沉铁”过程中依次加入的试剂X、Y为
A.
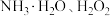 B.
B. C.
C.
(4)“滤液”萃取前调
 ,若有机萃取剂用表HR示,则发生萃取的反应可表示为
,若有机萃取剂用表HR示,则发生萃取的反应可表示为 。若,
。若,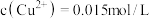 多次萃取后水相中
多次萃取后水相中 为
为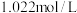 ,则铜的萃取率为
,则铜的萃取率为(5)利用
 溶液,用空气氧化法制备
溶液,用空气氧化法制备 。在
。在 溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备
溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备 。写出上述反应的离子方程式:
。写出上述反应的离子方程式:(6)结合图像分析,若要获得
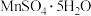 晶体的系列操作步骤为加热
晶体的系列操作步骤为加热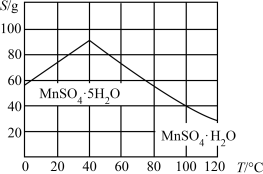
您最近半年使用:0次
3 . 将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应;反应过程中放出 气体,向所得溶液中加入物质的量浓度为
气体,向所得溶液中加入物质的量浓度为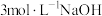 溶液至恰好沉淀完全,测得生成沉淀的质量比原合金的质量增加了
溶液至恰好沉淀完全,测得生成沉淀的质量比原合金的质量增加了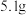 ,由此推断
,由此推断
 气体,向所得溶液中加入物质的量浓度为
气体,向所得溶液中加入物质的量浓度为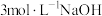 溶液至恰好沉淀完全,测得生成沉淀的质量比原合金的质量增加了
溶液至恰好沉淀完全,测得生成沉淀的质量比原合金的质量增加了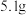 ,由此推断
,由此推断A.沉淀完全时消耗 溶液的体积为 溶液的体积为 |
B.参与反应的 的物质的量为 的物质的量为 |
C.合金的质量可能为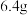 |
D.标准状况下,溶解合金时收集到 气体的体积为 气体的体积为 |
您最近半年使用:0次
解题方法
4 . 化学镀镍法得到的镀层均匀性,硬度等性能都较好,一种化学镀工艺流程如图所示:
②Ni(OH)2难溶于水;
③NaOH能稳定NaBH4,降低其水解率,NaBH4的水解反应:NaBH4+4H2O=Na[B(OH)4]+4H2;
若有3.0molNaBH4参与反应时,生成标准状况下8.96LH2,则理论上镀层增重
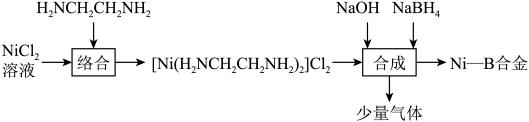
②Ni(OH)2难溶于水;
③NaOH能稳定NaBH4,降低其水解率,NaBH4的水解反应:NaBH4+4H2O=Na[B(OH)4]+4H2;
若有3.0molNaBH4参与反应时,生成标准状况下8.96LH2,则理论上镀层增重
| A.498.4g | B.684.4g | C.460g | D.515.6g |
您最近半年使用:0次
5 . 某小组同学探究硫代硫酸钠(Na2S2O3)溶液与某些常见金属离子的反应。
已知:i.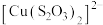 (淡绿色)、
(淡绿色)、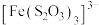 (紫黑色)、
(紫黑色)、 (无色)
(无色)
ii. 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。
iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是___________ 。
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
①取I中的浊液,离心分离,经检验,沉淀是Cu2S和S的混合物,清液中存在 。
。
i.补全I中生成黑色沉淀的总反应的离子方程式:___________
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+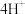
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是___________ 。
②Ⅱ中, 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了 ,理由是
,理由是___________ 。
ii.补全实验方案证实上述结论:将沉淀1洗净,___________ 。
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是___________ 。
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸, 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,___________ 是更软的酸。
已知:i.
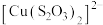 (淡绿色)、
(淡绿色)、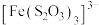 (紫黑色)、
(紫黑色)、 (无色)
(无色)ii.
 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
| 序号 | X溶液 | 现象 |
| I | CuCl2溶液 | 溶液变为淡绿色,水浴加热至50℃以上,逐渐析出黑色沉淀 | |
| Ⅱ | FeCl3溶液 | 溶液变为紫黑色,片刻后溶液变为无色 | |
| Ⅲ | AgNO3溶液 | 逐滴加入AgNO3溶液,生成白色沉淀,振荡后沉淀溶解,得无色溶液 |
 。
。i.补全I中生成黑色沉淀的总反应的离子方程式:
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+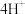
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是
②Ⅱ中,
 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。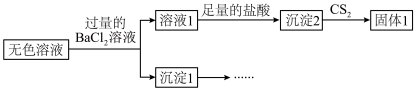
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了
 ,理由是
,理由是ii.补全实验方案证实上述结论:将沉淀1洗净,
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸,
 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
您最近半年使用:0次
6 . 从含钴余液(含 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下:
(1)在去除钙、镁时,选择适当加热条件的理由是___________ ;该步骤控制pH是影响除钙镁效果的重要因素,下图是不同pH条件下硫化钴含量和钴收率图,根据图中信息选择最适宜的pH为___________ ;___________ ;
(3)已知P507萃取剂 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大 的萃取率,原因是
的萃取率,原因是___________ ;
(4)反萃取时加入的试剂a应为___________(填代号);
(5)沉钴的离子方程式为___________ ;
(6)系列操作中如何检验 是否洗涤干净
是否洗涤干净___________ ;
(7)空气中煅烧 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下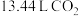 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为___________ 。
 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下: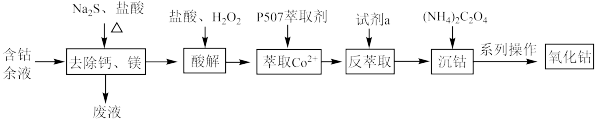
(1)在去除钙、镁时,选择适当加热条件的理由是

(3)已知P507萃取剂
 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大
 的萃取率,原因是
的萃取率,原因是(4)反萃取时加入的试剂a应为___________(填代号);
A. | B.HCl | C.NaOH | D. |
(5)沉钴的离子方程式为
(6)系列操作中如何检验
 是否洗涤干净
是否洗涤干净(7)空气中煅烧
 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下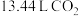 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为
您最近半年使用:0次
名校
解题方法
7 . 硫酸与Cl2反应的生成物的结构如图所示。有关说法不正确的是
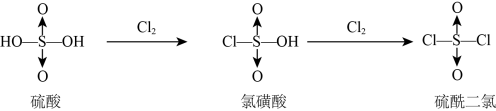
| A.氯磺酸钠NaSO3Cl与水反应:NaSO3Cl+H2O=Na++OH-+HSO3Cl- |
B.硫酰二氯与水反应的离子方程式:SO2Cl2+6H2O=4H3O++ +2Cl- +2Cl- |
| C.氯磺酸与BaCl2溶液反应的化学方程式:HSO3Cl+BaCl2+H2O=BaSO4↓+3HCl |
| D.硫酰二氯可脱去金属氯化物中的水:MgCl2·6H2O+3SO2Cl2=MgCl2+3H2SO4+6HCl |
您最近半年使用:0次
解题方法
8 . 二氧化硫脲[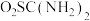 ](
](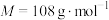 )为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
)为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
①滤液b主要成份为硫脲[ ](
](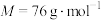 ),该物质易溶于水、有还原性。
),该物质易溶于水、有还原性。
②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[ ]。
]。
请回答:
(1)仪器Y的名称是________________ 。
(2)下列说法正确的是 。
(3)装置A的气密性检查操作为___________ 。
(4)请写出溶液b生成二氧化硫脲的化学方程式_____________ 。
(5)步骤5中将溶液温度下降到5℃的目的是______________ 。
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500 NaOH溶液,再加入25.00mL 0.5000
NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液体积为10.00mL。
溶液体积为10.00mL。
涉及到的反应有:
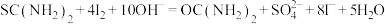
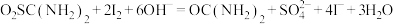

②另取0.1000g产品,加入50.00mL 0.1000 NaOH溶液,再加入30.00mL 3.000%
NaOH溶液,再加入30.00mL 3.000%  溶液,静置2分钟。改用0.1000
溶液,静置2分钟。改用0.1000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液为16.00mL。
溶液为16.00mL。
涉及到的反应有:
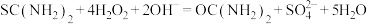


该产品中二氧化硫脲的质量分数为____________ 。
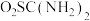 ](
](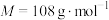 )为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
)为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下: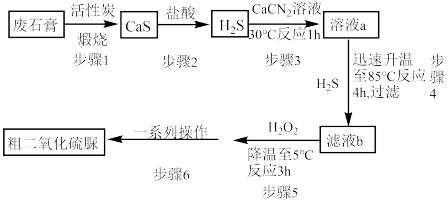

①滤液b主要成份为硫脲[
 ](
](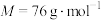 ),该物质易溶于水、有还原性。
),该物质易溶于水、有还原性。②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[
 ]。
]。请回答:
(1)仪器Y的名称是
(2)下列说法正确的是 。
A.装置B中装的X溶液为饱和 溶液 溶液 |
B.装置E中的 与 与 发生氧化还原反应,起到尾气处理的作用 发生氧化还原反应,起到尾气处理的作用 |
| C.装置F中可分多次加入碳酸氢铵,以提高二氧化硫脲的产率 |
| D.步骤6“一系列操作”可为减压过滤,用冷水洗涤沉淀2-3次,一定温度下烘干沉淀 |
(3)装置A的气密性检查操作为
(4)请写出溶液b生成二氧化硫脲的化学方程式
(5)步骤5中将溶液温度下降到5℃的目的是
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500
 NaOH溶液,再加入25.00mL 0.5000
NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液体积为10.00mL。
溶液体积为10.00mL。涉及到的反应有:
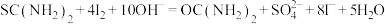
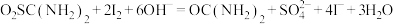

②另取0.1000g产品,加入50.00mL 0.1000
 NaOH溶液,再加入30.00mL 3.000%
NaOH溶液,再加入30.00mL 3.000%  溶液,静置2分钟。改用0.1000
溶液,静置2分钟。改用0.1000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液为16.00mL。
溶液为16.00mL。涉及到的反应有:
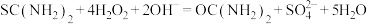


该产品中二氧化硫脲的质量分数为
您最近半年使用:0次
名校
解题方法
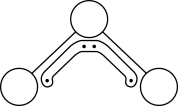
9 . 1994年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V形,键角116.5o,与SO2近似,三个原子以一个O原子为中心,与另外两个O原子分别构成一个极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个大π键——三个O原子均等地享有这4个电子。在1.01×105Pa,273K时,O3在催化剂作用下能迅速转化为O2,当生成该状态下22.4L O2时,转移电子数的物质的量为
| A.1 mol | B.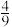 mol mol | C.0 mol | D.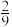 mol mol |
您最近半年使用:0次
10 . S8与NH3在无水条件下反应,得到一种二元化合物A,元素分析可知,A中含S元素69.60%。A进行如下反应:
(1)A、B、C、D的化学式分别为___________ 、___________ 、___________ 、___________ 。
(2)A与SnCl2的乙醇溶液反应除生成B外,还生成一种含Sn(IV)化合物,试写出A→B的化学方程式___________ 。
(3)D与一种无色液体(该液体是由常见的红棕色气体在加压下形成的)互为等电子体,但D与无色液体的几何构型完全不同,为环状结构,试画出D的最稳定的Lewis结构式___________ ,理由是___________ ,该Lewis结构式中,S原子的电子构型是___________ 。

(1)A、B、C、D的化学式分别为
(2)A与SnCl2的乙醇溶液反应除生成B外,还生成一种含Sn(IV)化合物,试写出A→B的化学方程式
(3)D与一种无色液体(该液体是由常见的红棕色气体在加压下形成的)互为等电子体,但D与无色液体的几何构型完全不同,为环状结构,试画出D的最稳定的Lewis结构式
您最近半年使用:0次