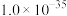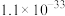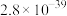名校
1 . 向mg由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成NO的体积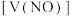 (已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
(已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
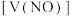 (已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
(已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是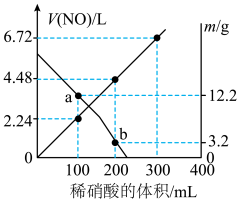
| A.a点时,100mL稀硝酸中溶解了Fe粉5.6g |
B.稀硝酸的浓度为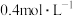 |
| C.加入稀硝酸的体积从300mL至400mL,期间收集产生的NO物质的量约为0.0083mol |
D.b点对应的溶液中可能含有的金属阳离子为 、 、 和 和 |
您最近一年使用:0次
解题方法
2 . 二氧化硫脲[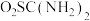 ](
](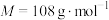 )为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
)为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
①滤液b主要成份为硫脲[ ](
](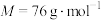 ),该物质易溶于水、有还原性。
),该物质易溶于水、有还原性。
②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[ ]。
]。
请回答:
(1)仪器Y的名称是________________ 。
(2)下列说法正确的是 。
(3)装置A的气密性检查操作为___________ 。
(4)请写出溶液b生成二氧化硫脲的化学方程式_____________ 。
(5)步骤5中将溶液温度下降到5℃的目的是______________ 。
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500 NaOH溶液,再加入25.00mL 0.5000
NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液体积为10.00mL。
溶液体积为10.00mL。
涉及到的反应有:
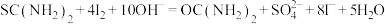
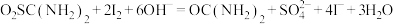

②另取0.1000g产品,加入50.00mL 0.1000 NaOH溶液,再加入30.00mL 3.000%
NaOH溶液,再加入30.00mL 3.000%  溶液,静置2分钟。改用0.1000
溶液,静置2分钟。改用0.1000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液为16.00mL。
溶液为16.00mL。
涉及到的反应有:
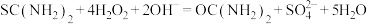


该产品中二氧化硫脲的质量分数为____________ 。
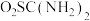 ](
](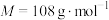 )为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
)为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下: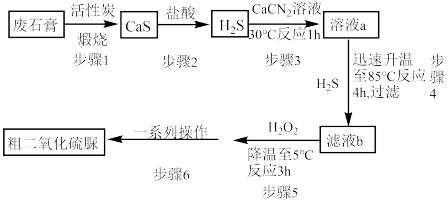

①滤液b主要成份为硫脲[
 ](
](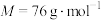 ),该物质易溶于水、有还原性。
),该物质易溶于水、有还原性。②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[
 ]。
]。请回答:
(1)仪器Y的名称是
(2)下列说法正确的是 。
A.装置B中装的X溶液为饱和 溶液 溶液 |
B.装置E中的 与 与 发生氧化还原反应,起到尾气处理的作用 发生氧化还原反应,起到尾气处理的作用 |
| C.装置F中可分多次加入碳酸氢铵,以提高二氧化硫脲的产率 |
| D.步骤6“一系列操作”可为减压过滤,用冷水洗涤沉淀2-3次,一定温度下烘干沉淀 |
(3)装置A的气密性检查操作为
(4)请写出溶液b生成二氧化硫脲的化学方程式
(5)步骤5中将溶液温度下降到5℃的目的是
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500
 NaOH溶液,再加入25.00mL 0.5000
NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液体积为10.00mL。
溶液体积为10.00mL。涉及到的反应有:
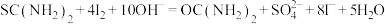
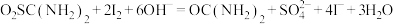

②另取0.1000g产品,加入50.00mL 0.1000
 NaOH溶液,再加入30.00mL 3.000%
NaOH溶液,再加入30.00mL 3.000%  溶液,静置2分钟。改用0.1000
溶液,静置2分钟。改用0.1000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液为16.00mL。
溶液为16.00mL。涉及到的反应有:
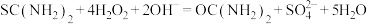


该产品中二氧化硫脲的质量分数为
您最近一年使用:0次
名校
解题方法
3 . 镓是优良的半导体材料。氮化镓是制作发光二极管的新材料,用于雷达、卫星通信设备等。某工厂利用铝土矿(主要成分为 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
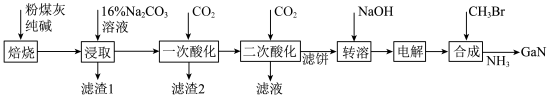
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度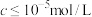 时,可认为已除尽。
时,可认为已除尽。
③金属离子氢氧化物的溶度积(25℃)
④ 、
、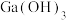 均为两性,
均为两性,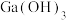 的酸性略强于
的酸性略强于 。
。
回答下列问题:
(1)写出元素镓在周期表中的位置______ ,其简化电子排布式为______ 。
(2)“焙烧”后所得产物主要有______ (写化学式)。
(3)“一次酸化”的目的是______ 。
(4)“二次酸化”中 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为______ 。
(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式______ 。
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式______ 。
(7)25℃时,已知: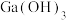 可溶于氨水中,
可溶于氨水中,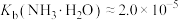 ,反应
,反应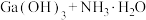
 的平衡常数
的平衡常数 ,计算反应
,计算反应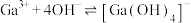 的平衡常数
的平衡常数
______ 。
 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度
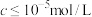 时,可认为已除尽。
时,可认为已除尽。③金属离子氢氧化物的溶度积(25℃)
|
|
| |
|
|
|
|
 、
、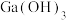 均为两性,
均为两性,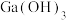 的酸性略强于
的酸性略强于 。
。回答下列问题:
(1)写出元素镓在周期表中的位置
(2)“焙烧”后所得产物主要有
(3)“一次酸化”的目的是
(4)“二次酸化”中
 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式
(7)25℃时,已知:
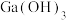 可溶于氨水中,
可溶于氨水中,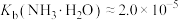 ,反应
,反应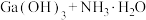
 的平衡常数
的平衡常数 ,计算反应
,计算反应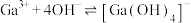 的平衡常数
的平衡常数
您最近一年使用:0次
名校
解题方法
4 . 随着小型电子设备以及新能源汽车产业的蓬勃发展,退役锂离子电池数量逐年递增,废旧锂离子电池的回收成为目前新能源产业重要的发展方向,科研人员通过对大量废旧钴酸锂( )电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
)电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
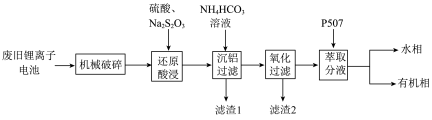
表1 粉料金属成分质量分数%
表2 部分阳离子以氢氧化物形式沉淀时溶液的
已知:Co(III)有较强氧化性, 有较强还原性。
有较强还原性。
(1)机械破碎的目的是_______
(2)还原酸浸的主要反应中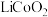 和
和 的物质的量之比为
的物质的量之比为_______
(3)沉铝操作中,加入 溶液调节溶液
溶液调节溶液 ,根据题中所给数据,分析滤渣1的主要成分
,根据题中所给数据,分析滤渣1的主要成分_______ 、_______ 。
(4)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的 在4—5,加入
在4—5,加入 溶液。写出其中沉铁的离子方程式
溶液。写出其中沉铁的离子方程式_______ ;实际生产中,随着反应时间的延长,锰和铁的沉淀率逐渐增大,但钴的损失量也随之增大,可能的原因为:① 氧化成
氧化成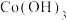 沉淀而增大钴的损失率;②
沉淀而增大钴的损失率;②_______
(5)P507(2-乙基己基磷酸-2-乙基己基酯)为有机磷酸萃取剂,下图为水相 对不同离子萃取率的影响曲线,水相合适的
对不同离子萃取率的影响曲线,水相合适的 为
为_______ 左右。

(6)该工艺中,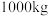 废料生产得到
废料生产得到 的质量为
的质量为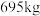 ,则该工艺的产率为
,则该工艺的产率为_______ (保留2位有效数字)。
 )电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
)电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
表1 粉料金属成分质量分数%
| Co | Li | Al | Cu | Fe | Mn | Ni |
| 23.6 | 3.4 | 3.2 | 0.84 | 2.8 | 1.1 | 0.34 |

| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 | 4.7 |
完全沉淀的 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 | 6.7 |
 有较强还原性。
有较强还原性。(1)机械破碎的目的是
(2)还原酸浸的主要反应中
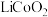 和
和 的物质的量之比为
的物质的量之比为(3)沉铝操作中,加入
 溶液调节溶液
溶液调节溶液 ,根据题中所给数据,分析滤渣1的主要成分
,根据题中所给数据,分析滤渣1的主要成分(4)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的
 在4—5,加入
在4—5,加入 溶液。写出其中沉铁的离子方程式
溶液。写出其中沉铁的离子方程式 氧化成
氧化成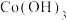 沉淀而增大钴的损失率;②
沉淀而增大钴的损失率;②(5)P507(2-乙基己基磷酸-2-乙基己基酯)为有机磷酸萃取剂,下图为水相
 对不同离子萃取率的影响曲线,水相合适的
对不同离子萃取率的影响曲线,水相合适的 为
为
(6)该工艺中,
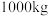 废料生产得到
废料生产得到 的质量为
的质量为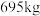 ,则该工艺的产率为
,则该工艺的产率为
您最近一年使用:0次
2023-12-05更新
|
855次组卷
|
3卷引用:吉林省长春市东北师大附中2023-2024学年高三上学期第三次摸底考试化学科试卷
名校
解题方法
5 . 虽然化学反应分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系,回答下列问题:
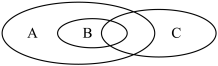
(1)如图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是______ (填字母)。
(2)配平化学方程式,并用单线桥法标出电子转移方向和数目________ 。
______H2O+_____Fe(NO3)3+_____SO2=___FeSO4+_____N2O+_____H2SO4
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是_______ (填写化学式)。
(4)配平化学方程式(化学计量数可含x)________ 。
_____Na2Sx+______NaClO+______NaOH=____Na2SO4+_____NaCl+_____H2O
(1)如图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(2)配平化学方程式,并用单线桥法标出电子转移方向和数目
______H2O+_____Fe(NO3)3+_____SO2=___FeSO4+_____N2O+_____H2SO4
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是
(4)配平化学方程式(化学计量数可含x)
_____Na2Sx+______NaClO+______NaOH=____Na2SO4+_____NaCl+_____H2O
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4
iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。___________ 。
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)___________ 0.1mol·L−1(填“>”“=”或“<”)。
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:___________ 。
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:___________ 。
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
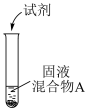
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:___________ 。
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,___________ 。
③补充实验证实了②中的分析。
a是___________ ,b是___________ 。
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是___________ ,从原子结构角度说明理由___________ 。
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是___________ 。
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:___________ 。
(6)总结:物质氧化性和还原性变化的一般规律是___________ 。

i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O
 TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。
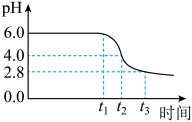
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,
③补充实验证实了②中的分析。
| 实验操作 | 试剂 | 产物 | |
| I |
| 较浓H2SO4 | 有氯气 |
| Ⅱ | a | 有氯气 | |
| Ⅲ | a+b | 无氯气 |
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:
(6)总结:物质氧化性和还原性变化的一般规律是
您最近一年使用:0次
2023-10-31更新
|
341次组卷
|
2卷引用:北京市日坛中学2023-2024学年高三上学期10月检测化学试题
名校
解题方法
7 . 五氧化二钒用作有机化工的催化剂。从废钒催化剂(主要成分为V2O5、V2O4、K2SO4、SiO2、Fe2O3和Al2O3)中回收V2O5,既避免污染环境又有利于资源综合利用,该工艺流程如下:
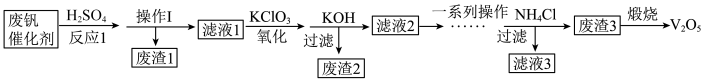
已知:金属钒的氧化物能与酸反应;SiO2不溶于水也不溶于初中常见的酸。回答下列问题:
(1)实验室进行操作Ⅰ时,需要用到的玻璃仪器有漏斗、烧杯和___________ 。
(2)加入KClO3的作用是将VO2+转化为VO ,则该转化过程中钒元素的化合价分别为
,则该转化过程中钒元素的化合价分别为___________ 。
(3)加入KOH的作用之一是保证钒存在于溶液中时,把Fe3+与Al3+转化为沉淀,则“废渣2”的主要成分是___________ 。
(4)滤渣3的成分是偏钒酸铵(NH4VO3)沉淀,煅烧偏钒酸铵(NH4VO3)还有氨气和水生成,写出“煅烧”过程中发生反应的化学方程式:___________ 。
(5)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,加入氯化铵调节溶液的最佳pH范围为___________ 。

已知:金属钒的氧化物能与酸反应;SiO2不溶于水也不溶于初中常见的酸。回答下列问题:
(1)实验室进行操作Ⅰ时,需要用到的玻璃仪器有漏斗、烧杯和
(2)加入KClO3的作用是将VO2+转化为VO
 ,则该转化过程中钒元素的化合价分别为
,则该转化过程中钒元素的化合价分别为(3)加入KOH的作用之一是保证钒存在于溶液中时,把Fe3+与Al3+转化为沉淀,则“废渣2”的主要成分是
(4)滤渣3的成分是偏钒酸铵(NH4VO3)沉淀,煅烧偏钒酸铵(NH4VO3)还有氨气和水生成,写出“煅烧”过程中发生反应的化学方程式:
(5)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
您最近一年使用:0次
8 . nesteretal A是一种从某菌体中提取出来的笼状聚半缩酮,在2021年,化学家Yuichiro Kawamoto等人提出了nesteretal A的一种全合成路线。下面展示了该全合成路线的部分反应。
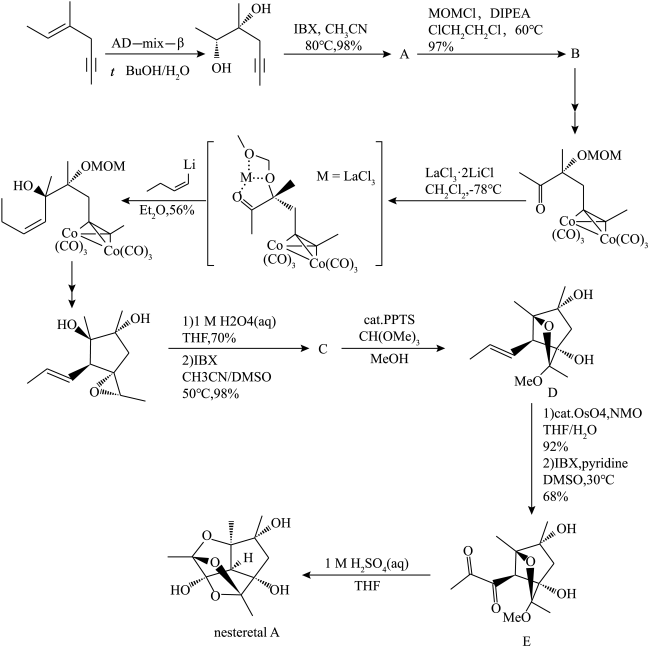
(1)已知IBX是一种氧化剂,可以将醇氧化为酮;环氧乙烷在酸性水溶液中会水解为乙二醇。请画出A、C的键线式______ 、______ 。
(2)根据前后反应,写出MOMCl的键线式______ ,并说明A到B的反应类型______ 。
(3)加入反应物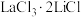 的目的是什么
的目的是什么______ ?
(4)试画出D到E的第一步反应产物的键线式______ 。(不要求立体构型)
(5)请写出nesteretal A的分子式_______ 。

(1)已知IBX是一种氧化剂,可以将醇氧化为酮;环氧乙烷在酸性水溶液中会水解为乙二醇。请画出A、C的键线式
(2)根据前后反应,写出MOMCl的键线式
(3)加入反应物
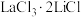 的目的是什么
的目的是什么(4)试画出D到E的第一步反应产物的键线式
(5)请写出nesteretal A的分子式
您最近一年使用:0次
名校
解题方法
9 . 我国煤储量居世界第一,对煤的综合、高效、无害化利用是二十一世纪能源战略的重要组成部分,利用含铁元素的粉煤灰获得纳米 等重要物质的工艺流程如下。
等重要物质的工艺流程如下。
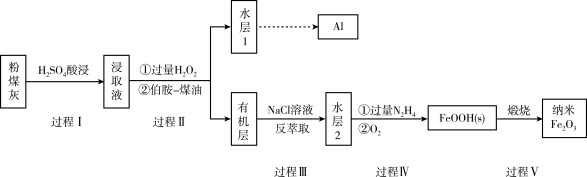
已知:i:伯胺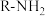 能与
能与 反应:
反应: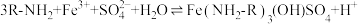 生成易溶于煤油的产物。
生成易溶于煤油的产物。
ii: 在水溶液中易与
在水溶液中易与 反应:
反应: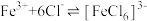
(1)写出过程I中 发生反应的离子方程式:
发生反应的离子方程式:_______ 。
(2)过程Ⅱ加入过量 的作用是
的作用是_______ 。
(3)过程Ⅱ加入伯胺-煤油对浸取液进行分离,该操作的名称是_______ 。
(4)从化学平衡角度解释过程Ⅱ利用 溶液进行反萃取的原理:
溶液进行反萃取的原理:_______ 。
(5) 具有碱性,可与
具有碱性,可与 结合生成
结合生成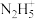 ,其中氮原子的杂化类型为
,其中氮原子的杂化类型为_______ 从结构角度分析,它比 配位能力
配位能力_______ (“强”或“弱”),过程Ⅳ中先用过量的 将水层2中
将水层2中 转化为
转化为 并生成
并生成 ,反应的离子方程式为
,反应的离子方程式为_______ ,得到的 再被
再被 氧化为
氧化为 。
。
(6)以 溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的
溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的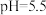 ,将烟气中的
,将烟气中的 、
、 转化为
转化为 、
、 ,均为放热反应。
,均为放热反应。
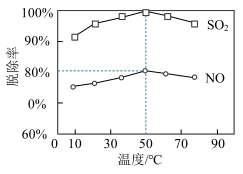
①一定时间内,温度对硫、硝脱除率的影响曲线如下图, 的脱除率高于
的脱除率高于 ,可能的原因是
,可能的原因是_______ (写出1种即可)。
②烟气中 和
和 的体积比为
的体积比为 ,
, 时的脱除率见图,则此吸收液中烟气转化生成的
时的脱除率见图,则此吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为_______ 。
 等重要物质的工艺流程如下。
等重要物质的工艺流程如下。
已知:i:伯胺
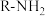 能与
能与 反应:
反应: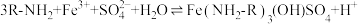 生成易溶于煤油的产物。
生成易溶于煤油的产物。ii:
 在水溶液中易与
在水溶液中易与 反应:
反应: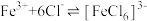
(1)写出过程I中
 发生反应的离子方程式:
发生反应的离子方程式:(2)过程Ⅱ加入过量
 的作用是
的作用是(3)过程Ⅱ加入伯胺-煤油对浸取液进行分离,该操作的名称是
(4)从化学平衡角度解释过程Ⅱ利用
 溶液进行反萃取的原理:
溶液进行反萃取的原理:(5)
 具有碱性,可与
具有碱性,可与 结合生成
结合生成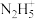 ,其中氮原子的杂化类型为
,其中氮原子的杂化类型为 配位能力
配位能力 将水层2中
将水层2中 转化为
转化为 并生成
并生成 ,反应的离子方程式为
,反应的离子方程式为 再被
再被 氧化为
氧化为 。
。(6)以
 溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的
溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的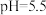 ,将烟气中的
,将烟气中的 、
、 转化为
转化为 、
、 ,均为放热反应。
,均为放热反应。①一定时间内,温度对硫、硝脱除率的影响曲线如下图,
 的脱除率高于
的脱除率高于 ,可能的原因是
,可能的原因是②烟气中
 和
和 的体积比为
的体积比为 ,
, 时的脱除率见图,则此吸收液中烟气转化生成的
时的脱除率见图,则此吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2023-05-28更新
|
570次组卷
|
2卷引用:北京首都师范大学附属中学2023届高三3月月考化学试题
名校
10 . NaDCC(结构简式为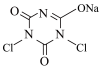 ),是一种优良的消毒剂。常温下,NaDCC为白色粉末或颗粒,性质稳定,受热易分解,难溶于冰水,在实验室中可通过以下反应和装置(夹持仪器略去)制取。
),是一种优良的消毒剂。常温下,NaDCC为白色粉末或颗粒,性质稳定,受热易分解,难溶于冰水,在实验室中可通过以下反应和装置(夹持仪器略去)制取。
原理: (氰尿酸)+2NaClO
(氰尿酸)+2NaClO
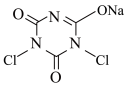 +NaOH+H2O
+NaOH+H2O
实验装置:
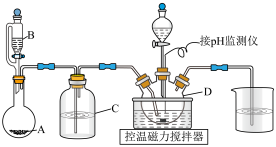
Ⅰ.制取NaDCC的实验步骤如下:
①向D中加入10mL40%NaOH溶液,水浴控温10℃左右,搅拌。
②A中加入KMnO4固体,B中加入浓盐酸,混合使之反应,打开磁力搅拌器。
③D中pH降至8左右时,向其中加入一定量氰尿酸,保持10℃左右,边搅拌边持续通入A中产生的气体,至D中有较多晶体析出,停止反应;
④将D中的混合物用冰水浴冷却,过滤,洗涤,低温晾干得到NaDCC晶体。
Ⅱ.NaDCC有效氯含量测定:
⑤用250mL碘量瓶称取0.2000gNaDCC晶体样品,加蒸馏水100mL,摇动至样品完全溶解,加适量的碘化钾和稀硫酸,避光放置5min。再用少量水冲洗碘量瓶瓶塞和瓶内壁。
⑥用滴定管快速滴入0.2000 Na2S2O3溶液至浅黄色时,加2滴指示剂后,继续滴定至终点,记录消耗Na2S2O3溶液的体积,重复三次,平均消耗Na2S2O3溶液16.76mL。
Na2S2O3溶液至浅黄色时,加2滴指示剂后,继续滴定至终点,记录消耗Na2S2O3溶液的体积,重复三次,平均消耗Na2S2O3溶液16.76mL。
⑦完成一次空白试验,消耗Na2S2O3溶液0.16mL。
已知:
样品有效氯=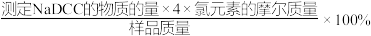
请回答下列问题:
(1)仪器B的名称是___________ 。制备NaDCC实验中使用仪器C的目的是为了提高___________ (填原料名称)的利用率。
(2)若步骤②中通入气体过快,仪器D中反应热量未及时散失,可生成较多NaClO3副产物,该副反应的离子方程式为___________ 。
(3)步骤④中洗涤的操作是___________ 。
(4)已知NaDCC在酸性环境中还原得到氰尿酸和氯化物,写出步骤⑤中样品加入适量的碘化钾和稀硫酸的离子反应方程式___________ 。
(5)步骤⑥中使用的最佳指示剂是___________ ,滴定终点的现象为溶液由___________ 变为___________ 。若变色后立即读取Na2S2O3溶液体积,则测定的样品有效氯含量结果___________ (填字母)。
A.一定偏大 B.一定偏小 C.可能偏大 D.可能偏小
(6)计算样品有效氯___________ %(保留四位有效数字)。
 ),是一种优良的消毒剂。常温下,NaDCC为白色粉末或颗粒,性质稳定,受热易分解,难溶于冰水,在实验室中可通过以下反应和装置(夹持仪器略去)制取。
),是一种优良的消毒剂。常温下,NaDCC为白色粉末或颗粒,性质稳定,受热易分解,难溶于冰水,在实验室中可通过以下反应和装置(夹持仪器略去)制取。原理:
 (氰尿酸)+2NaClO
(氰尿酸)+2NaClO
 +NaOH+H2O
+NaOH+H2O实验装置:

Ⅰ.制取NaDCC的实验步骤如下:
①向D中加入10mL40%NaOH溶液,水浴控温10℃左右,搅拌。
②A中加入KMnO4固体,B中加入浓盐酸,混合使之反应,打开磁力搅拌器。
③D中pH降至8左右时,向其中加入一定量氰尿酸,保持10℃左右,边搅拌边持续通入A中产生的气体,至D中有较多晶体析出,停止反应;
④将D中的混合物用冰水浴冷却,过滤,洗涤,低温晾干得到NaDCC晶体。
Ⅱ.NaDCC有效氯含量测定:
⑤用250mL碘量瓶称取0.2000gNaDCC晶体样品,加蒸馏水100mL,摇动至样品完全溶解,加适量的碘化钾和稀硫酸,避光放置5min。再用少量水冲洗碘量瓶瓶塞和瓶内壁。
⑥用滴定管快速滴入0.2000
 Na2S2O3溶液至浅黄色时,加2滴指示剂后,继续滴定至终点,记录消耗Na2S2O3溶液的体积,重复三次,平均消耗Na2S2O3溶液16.76mL。
Na2S2O3溶液至浅黄色时,加2滴指示剂后,继续滴定至终点,记录消耗Na2S2O3溶液的体积,重复三次,平均消耗Na2S2O3溶液16.76mL。⑦完成一次空白试验,消耗Na2S2O3溶液0.16mL。
已知:

样品有效氯=
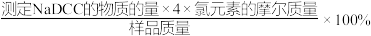
请回答下列问题:
(1)仪器B的名称是
(2)若步骤②中通入气体过快,仪器D中反应热量未及时散失,可生成较多NaClO3副产物,该副反应的离子方程式为
(3)步骤④中洗涤的操作是
(4)已知NaDCC在酸性环境中还原得到氰尿酸和氯化物,写出步骤⑤中样品加入适量的碘化钾和稀硫酸的离子反应方程式
(5)步骤⑥中使用的最佳指示剂是
A.一定偏大 B.一定偏小 C.可能偏大 D.可能偏小
(6)计算样品有效氯
您最近一年使用:0次
2023-05-12更新
|
715次组卷
|
2卷引用:河北省唐山市2023届高三第三次模拟卷化学试题