名校
解题方法
1 . 新能源汽车工业飞速发展依赖于锂离子电池的新型电极材料的研究取得的重大成果。 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。
(1)“浸锰”时, 生成
生成 的离子方程式为
的离子方程式为___________ 。
(2)步骤Ⅱ中, 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是___________ 。 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为___________ {已知该条件下,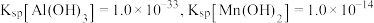 }。
}。
(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为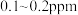 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。
①以 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧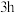 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到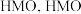 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为___________ ;
②用酸处理 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是___________ 。这一副反应对再生后的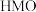 的锂富集性能的影响是
的锂富集性能的影响是___________ 。
(5)利用高纯 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
步骤1:向 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成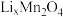 ;
;
步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使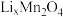 中的
中的 脱出进入腔室2。
脱出进入腔室2。 对
对 的富集效果,将
的富集效果,将 的
的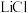 溶液通入
溶液通入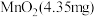 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在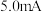 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
___________ (已知 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。
②电源2工作时, 电极上发生的电极反应为
电极上发生的电极反应为___________ 。
 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。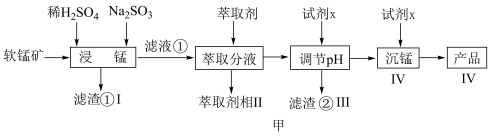
(1)“浸锰”时,
 生成
生成 的离子方程式为
的离子方程式为(2)步骤Ⅱ中,
 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是
 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为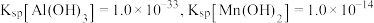 }。
}。(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为
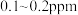 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。①以
 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧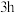 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到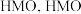 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为②用酸处理
 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是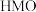 的锂富集性能的影响是
的锂富集性能的影响是(5)利用高纯
 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:步骤1:向
 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成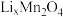 ;
;步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使
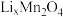 中的
中的 脱出进入腔室2。
脱出进入腔室2。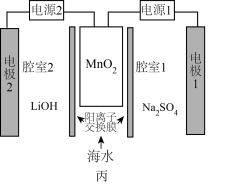
 对
对 的富集效果,将
的富集效果,将 的
的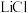 溶液通入
溶液通入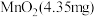 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在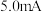 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。②电源2工作时,
 电极上发生的电极反应为
电极上发生的电极反应为
您最近半年使用:0次
解题方法
2 . 下列反应的离子方程式错误的是
A. 去除废水中的 去除废水中的 |
B.铜与稀硝酸: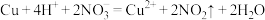 |
C. 加入水中: 加入水中: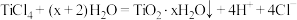 |
D.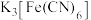 溶液滴入 溶液滴入 溶液中: 溶液中: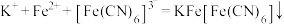 |
您最近半年使用:0次
名校
解题方法
3 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: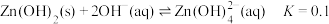 ;
;
②室温下,部分离子浓度的对数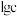 与
与 的关系如下图所示(其中
的关系如下图所示(其中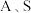 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物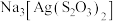 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: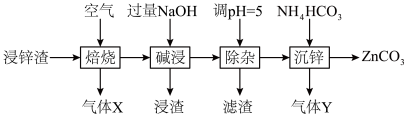
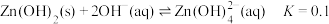 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):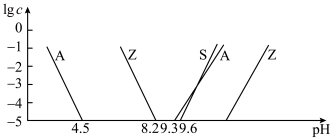
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
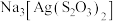 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近半年使用:0次
昨日更新
|
108次组卷
|
2卷引用:云南省罗平第一中学2024年高三二模考试化学试题
4 . 用 表示阿伏加德罗常数。下列说法正确的是
表示阿伏加德罗常数。下列说法正确的是
 表示阿伏加德罗常数。下列说法正确的是
表示阿伏加德罗常数。下列说法正确的是A.1mol 含有π键的数目为 含有π键的数目为 |
B.1mol基态Cr原子的未成对电子数为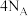 |
C.46g 和 和 的混合气体含有的原子数为 的混合气体含有的原子数为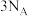 |
D.2.24L(标准状况)乙醇与足量Na充分反应,生成 的分子数为 的分子数为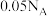 |
您最近半年使用:0次
解题方法
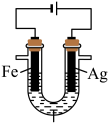
5 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制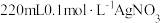 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: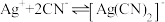 ,
,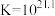 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是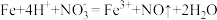 和
和___________ (用离子方程式表示,已知氧化性: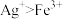 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中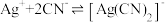 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为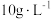 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为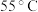 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由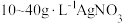 溶液和
溶液和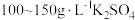 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: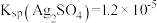 。
。
I.实验准备。
(1)用
 固体配制
固体配制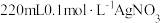 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B. C.
C. D.
D. E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
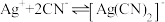 ,
,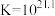 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的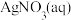 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
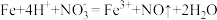 和
和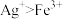 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
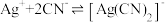 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(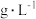 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为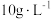 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
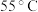 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
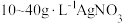 溶液和
溶液和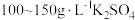 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
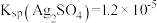 。
。
您最近半年使用:0次
7日内更新
|
119次组卷
|
2卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
6 . 用过二硫酸铵 溶液作浸取剂可以提取黄铜矿(主要成分为
溶液作浸取剂可以提取黄铜矿(主要成分为 )中的铜。
)中的铜。
已知:i. 、
、 均能导电;
均能导电;
ii. ;
;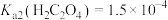 ;
;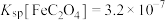
(1) 的晶胞如图1所示。
的晶胞如图1所示。 晶胞,则每个
晶胞,则每个 晶胞中含有的Fe原子个数为
晶胞中含有的Fe原子个数为___________ 。
②图2所示结构单元不能作为 晶胞的原因是
晶胞的原因是___________ 。
(2)用 溶液作浸取剂浸取
溶液作浸取剂浸取 的原理示意如图3所示。
的原理示意如图3所示。
①一段时间后, 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
②浸取初期,随着浸取时间延长, 的浸出速率迅速提高,其可能的原因是
的浸出速率迅速提高,其可能的原因是___________ 。
(3)在足量 溶液中添加少量
溶液中添加少量 溶液作为浸取剂与
溶液作为浸取剂与 作用,一段时间结果如下:
作用,一段时间结果如下:
①添加Ag⁺可以显著提高Cu元素的浸出率的原因:___________ 。
②进一步研究发现添加的少量 可以循环参与反应。
可以循环参与反应。 “再生”的离子方程式为:
“再生”的离子方程式为:___________ 。
(4)进一步从浸出液中提取铜并使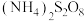 再生的流程示意图如图4所示。
再生的流程示意图如图4所示。
①滤液A中加草酸的反应为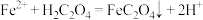 ,该反应化学平衡常数为
,该反应化学平衡常数为___________ 。
②电解滤液B而不电解滤液A的原因是___________ 。
 溶液作浸取剂可以提取黄铜矿(主要成分为
溶液作浸取剂可以提取黄铜矿(主要成分为 )中的铜。
)中的铜。已知:i.
 、
、 均能导电;
均能导电;ii.
 ;
;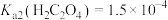 ;
;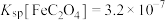
(1)
 的晶胞如图1所示。
的晶胞如图1所示。
 晶胞,则每个
晶胞,则每个 晶胞中含有的Fe原子个数为
晶胞中含有的Fe原子个数为②图2所示结构单元不能作为
 晶胞的原因是
晶胞的原因是(2)用
 溶液作浸取剂浸取
溶液作浸取剂浸取 的原理示意如图3所示。
的原理示意如图3所示。
①一段时间后,
 与
与 反应的离子方程式为
反应的离子方程式为②浸取初期,随着浸取时间延长,
 的浸出速率迅速提高,其可能的原因是
的浸出速率迅速提高,其可能的原因是(3)在足量
 溶液中添加少量
溶液中添加少量 溶液作为浸取剂与
溶液作为浸取剂与 作用,一段时间结果如下:
作用,一段时间结果如下:添加 | 未加 | |
| Cu元素的浸出率 | 98.02% | 30.90% |
| 过程中产物形态 |
|
|
②进一步研究发现添加的少量
 可以循环参与反应。
可以循环参与反应。 “再生”的离子方程式为:
“再生”的离子方程式为:(4)进一步从浸出液中提取铜并使
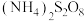 再生的流程示意图如图4所示。
再生的流程示意图如图4所示。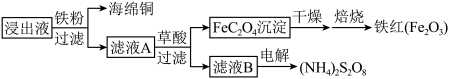
①滤液A中加草酸的反应为
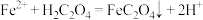 ,该反应化学平衡常数为
,该反应化学平衡常数为②电解滤液B而不电解滤液A的原因是
您最近半年使用:0次
名校
解题方法
7 . 硫酸亚铁铵 的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
Ⅰ.称取0.70 g铁屑放在烧杯中,加入足量3mol·L 的
的 溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
Ⅱ.抽滤,在得到的滤液中添加足量 ,
, 溶解后,用3 mol⋅L
溶解后,用3 mol⋅L 的稀硫酸将溶液pH调至1~2;
的稀硫酸将溶液pH调至1~2;
Ⅲ.再将溶液转移至蒸发皿中,用酒精灯加热蒸发,冷却结晶,抽滤,用无水乙醇洗涤晶体1~2次,所得到的产物质量为3.92 g。
回答下列问题:
(1)“步骤Ⅰ”中铁屑发生反应的离子方程式为___________ ,该步骤要在通风橱中进行,其目的是___________ ;若铁屑中混有少量FeS,需将生成的气体通入 溶液,反应过程中该溶液的pH
溶液,反应过程中该溶液的pH___________ (填“升高”“降低”或“不变”)。
(2)“步骤Ⅱ”中用3 mol⋅L 的稀硫酸将溶液pH调至1~2,其目的是
的稀硫酸将溶液pH调至1~2,其目的是___________ , 时该溶液中
时该溶液中
___________ (实验条件下, 的电离常数
的电离常数 、
、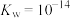 ,保留两位有效数字)。
,保留两位有效数字)。
(3)“步骤Ⅲ”中用酒精灯加热蒸发至___________ 时,停止加热;用无水乙醇洗涤晶体的目的是___________ 。
(4)该实验中硫酸亚铁铵的产率为___________ 。
 的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:Ⅰ.称取0.70 g铁屑放在烧杯中,加入足量3mol·L
 的
的 溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;Ⅱ.抽滤,在得到的滤液中添加足量
 ,
, 溶解后,用3 mol⋅L
溶解后,用3 mol⋅L 的稀硫酸将溶液pH调至1~2;
的稀硫酸将溶液pH调至1~2;Ⅲ.再将溶液转移至蒸发皿中,用酒精灯加热蒸发,冷却结晶,抽滤,用无水乙醇洗涤晶体1~2次,所得到的产物质量为3.92 g。
回答下列问题:
(1)“步骤Ⅰ”中铁屑发生反应的离子方程式为
 溶液,反应过程中该溶液的pH
溶液,反应过程中该溶液的pH(2)“步骤Ⅱ”中用3 mol⋅L
 的稀硫酸将溶液pH调至1~2,其目的是
的稀硫酸将溶液pH调至1~2,其目的是 时该溶液中
时该溶液中
 的电离常数
的电离常数 、
、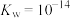 ,保留两位有效数字)。
,保留两位有效数字)。(3)“步骤Ⅲ”中用酒精灯加热蒸发至
(4)该实验中硫酸亚铁铵的产率为
您最近半年使用:0次
解题方法
8 . 实现废钨——镍型加氢催化剂(主要成分为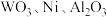 ,还含有
,还含有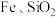 和少量含
和少量含 有机物)中有价值金属回收的工艺流程如下。
有机物)中有价值金属回收的工艺流程如下。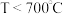 ,纯碱不与
,纯碱不与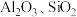 反应。
反应。
ⅱ.相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的 范围如下:
范围如下:
回答下列问题:
(1)28Ni位于元素周期表的第__________ 周期、__________ 族。
(2)“氧化”的目的为__________ 和将金属单质氧化至相应价态。
(3)“钠化焙烧”中生成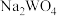 的化学方程式为
的化学方程式为__________ 。
(4)“酸化沉钨”后过滤,所得滤饼的主要成分为__________ (填化学式)。
(5)“调 ”除铁和铝,溶液的
”除铁和铝,溶液的 范围应调节为
范围应调节为__________ 。
(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
“一系列操作”依次是__________ 、及时过滤、洗涤、干燥。
(7)强碱溶液中NaClO氧化NiSO4,可沉淀出用作电池正极材料的NiOOH,该反应的离子方程式为__________ 。
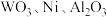 ,还含有
,还含有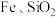 和少量含
和少量含 有机物)中有价值金属回收的工艺流程如下。
有机物)中有价值金属回收的工艺流程如下。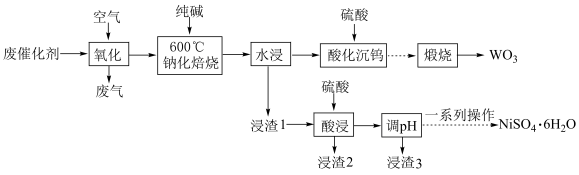
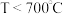 ,纯碱不与
,纯碱不与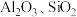 反应。
反应。ⅱ.相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的
 范围如下:
范围如下:| 金属离子 | Ni2+ | Al3+ | Fe3+ |
| 开始沉淀时的pH | 6.9 | 3.4 | 1.5 |
| 沉淀完全时的pH | 8.9 | 4.7 | 2.8 |
(1)28Ni位于元素周期表的第
(2)“氧化”的目的为
(3)“钠化焙烧”中生成
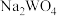 的化学方程式为
的化学方程式为(4)“酸化沉钨”后过滤,所得滤饼的主要成分为
(5)“调
 ”除铁和铝,溶液的
”除铁和铝,溶液的 范围应调节为
范围应调节为(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
| 温度 | 低于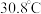 |  | 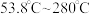 | 高于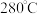 |
| 晶体形态 |  |  | 多种结晶水合物 |  |
(7)强碱溶液中NaClO氧化NiSO4,可沉淀出用作电池正极材料的NiOOH,该反应的离子方程式为
您最近半年使用:0次
名校
9 . 过硫酸钠(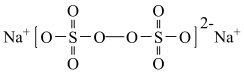 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
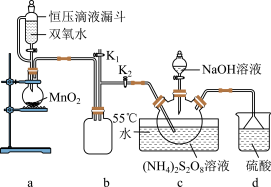
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。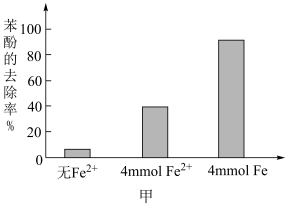
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
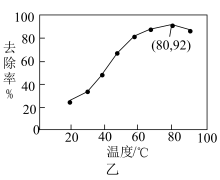
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为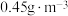 ,
,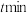 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: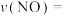
 。
。
您最近半年使用:0次
名校
解题方法
10 . 硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:___________ ;向混合溶液中通入热空气的反应的离子方程式是___________ ;可循环利用的物质是___________ (填化学式)。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:___________ 。(氨水用“NH3·H2O”表示)
②有数据表明,吸收塔中溶液的pH在5.5﹣6.0之间,生产效率较高。当控制好尾气的流量一定时,调节溶液的pH的方法是___________ 。
(3)氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以 和
和 的形式存在。某工厂处理氨氮废水的流程如图:
的形式存在。某工厂处理氨氮废水的流程如图:
含 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水 达标
达标
①过程②加入NaClO溶液可将氨氮物质(以NH3表示)转化为无毒物质,请用离子方程式表示该转化过程___________ 。
②含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到将余氯转化为无毒物质的目的___________ (填字母)。
a.KOH b.Na2SO3 c.KMnO4 d.Na2S
(1)用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
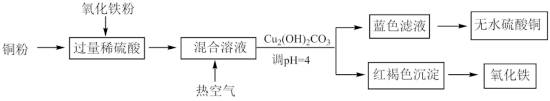
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:

②有数据表明,吸收塔中溶液的pH在5.5﹣6.0之间,生产效率较高。当控制好尾气的流量一定时,调节溶液的pH的方法是
(3)氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以
 和
和 的形式存在。某工厂处理氨氮废水的流程如图:
的形式存在。某工厂处理氨氮废水的流程如图:含
 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水 达标
达标①过程②加入NaClO溶液可将氨氮物质(以NH3表示)转化为无毒物质,请用离子方程式表示该转化过程
②含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到将余氯转化为无毒物质的目的
a.KOH b.Na2SO3 c.KMnO4 d.Na2S
您最近半年使用:0次