名校
解题方法
1 . 某化学兴趣小组用下图装置(部分夹持装置已略去)制取氨气并探究其性质。___________ 。
(2)装置B中物质是___________ ,气体通过装置C、D时,试纸颜色会发生变化的是___________ (填字母)。当装置E集满氨气时,挤压胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是___________ 。
(3)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。___________ ,证明氨气具有___________ (填“氧化性”或“还原性)。
若向a中通入标准状况下 的氨气,理论上会得到铜的质量为
的氨气,理论上会得到铜的质量为___________ g。
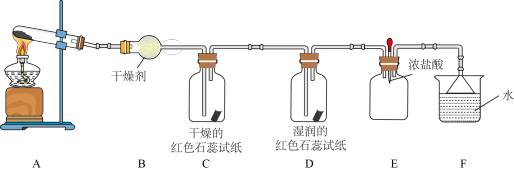
(2)装置B中物质是
(3)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
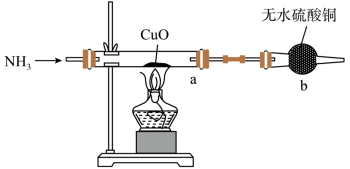
若向a中通入标准状况下
 的氨气,理论上会得到铜的质量为
的氨气,理论上会得到铜的质量为
您最近一年使用:0次
2 . 某小组用淀粉水解液和浓 (作催化剂)、
(作催化剂)、 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展实验(夹持仪器略):
,按如下流程开展实验(夹持仪器略):
①草酸能溶于水,易溶于乙醇;
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式: 。
。
请回答下列问题:
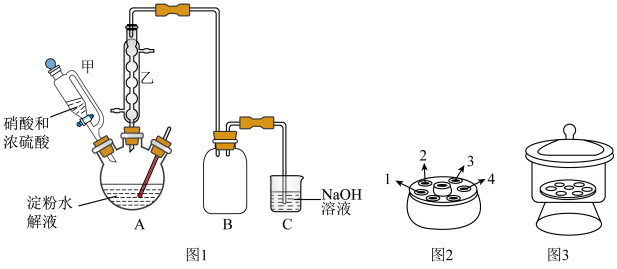
(1)仪器甲相比普通分液漏斗的优点是___________ ,步骤Ⅱ的操作名称是___________ 。
(2)NO不与 反应,但在本实验中可以完全被吸收,请用离子方程式表示NO被完全吸收的原因
反应,但在本实验中可以完全被吸收,请用离子方程式表示NO被完全吸收的原因___________ 。
(3)催化剂浓硫酸用量过多,会导致草酸产率减少,原因是___________ 。
(4)下列有关操作说法正确的是___________。
(5)草酸晶体 含有结晶水。
含有结晶水。
Ⅰ.甲同学通过如下实验测定其组成:
①配制标准氢氧化钠溶液。
②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中x的值
,则该滴定法测得产品中x的值___________ (填“偏大”“偏小”“无影响”)。
Ⅱ.乙同学取产品 ,加蒸馏水定容至
,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、 、
、 。假设其他杂质不干扰结果,产品中结晶水x为
。假设其他杂质不干扰结果,产品中结晶水x为___________ 。
 (作催化剂)、
(作催化剂)、 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展实验(夹持仪器略):
,按如下流程开展实验(夹持仪器略):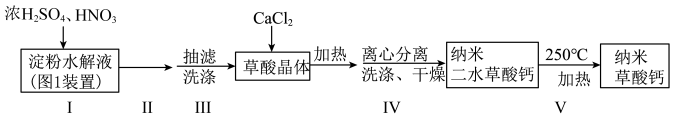
①草酸能溶于水,易溶于乙醇;
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式:
 。
。请回答下列问题:
(1)仪器甲相比普通分液漏斗的优点是
(2)NO不与
 反应,但在本实验中可以完全被吸收,请用离子方程式表示NO被完全吸收的原因
反应,但在本实验中可以完全被吸收,请用离子方程式表示NO被完全吸收的原因(3)催化剂浓硫酸用量过多,会导致草酸产率减少,原因是
(4)下列有关操作说法正确的是___________。
| A.步骤Ⅲ洗涤可用乙醇水溶液,步骤Ⅳ洗涤可用蒸馏水 |
| B.步骤Ⅳ采用离心分离,装置如图2所示,操作时应将两支离心管放置于1、4处 |
| C.步骤Ⅳ检验纳米二水草酸钙是否洗涤干净可用硝酸银溶液和稀硝酸 |
| D.步骤Ⅴ为提高反应速率,也可采用更高温度加热 |
(5)草酸晶体
 含有结晶水。
含有结晶水。Ⅰ.甲同学通过如下实验测定其组成:
①配制标准氢氧化钠溶液。
②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述
 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中x的值
,则该滴定法测得产品中x的值Ⅱ.乙同学取产品
 ,加蒸馏水定容至
,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、 、
、 。假设其他杂质不干扰结果,产品中结晶水x为
。假设其他杂质不干扰结果,产品中结晶水x为
您最近一年使用:0次
3 . 宏观辨识与微观探析是化学学科重要的学科素养。回答下列问题:
Ⅰ.已知某无色水样中只含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种。某化学研究性学习小组对该水样的成分进行检验:
中的若干种。某化学研究性学习小组对该水样的成分进行检验:
①取部分水样;
②向水样中滴加足量硝酸钡溶液,产生白色沉淀;
③向步骤②所得沉淀中滴加足量稀盐酸,沉淀部分溶解;
④向步骤③所得溶液中滴加硝酸银溶液,又产生白色沉淀。
(1)该水样中一定存在的离子是__________ (填离子符号,下同),可能存在的离子是__________ ,一定不存在的离子是__________ 。
(2)若要确定可能存在的离子是否存在,还需进行的实验操作是__________ 。
Ⅱ.现有 、
、 、
、 、
、 四种溶液,该小组同学设计如下实验步骤进行鉴别:
四种溶液,该小组同学设计如下实验步骤进行鉴别:
①取等体积的上述四种溶液A、B、C、D分别置于四支试管中,对四支试管均进行下列操作:加入过量的 溶液、加热,将湿润的红色石蕊试纸靠近试管口。观察到盛装B、D溶液的试管口的试纸变蓝。
溶液、加热,将湿润的红色石蕊试纸靠近试管口。观察到盛装B、D溶液的试管口的试纸变蓝。
②向①中反应后的四支试管中,分别依次加入足量 溶液,观察到盛装B、C溶液的试管内产生白色沉淀。
溶液,观察到盛装B、C溶液的试管内产生白色沉淀。
(3)溶液A、B、C、D中的溶质依次为__________ 、__________ 、__________ 、__________ (填化学式)。
(4)有同学提出用一种试剂即可将四种溶液鉴别出来,该试剂为__________ (填化学式)。
Ⅰ.已知某无色水样中只含有
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种。某化学研究性学习小组对该水样的成分进行检验:
中的若干种。某化学研究性学习小组对该水样的成分进行检验:①取部分水样;
②向水样中滴加足量硝酸钡溶液,产生白色沉淀;
③向步骤②所得沉淀中滴加足量稀盐酸,沉淀部分溶解;
④向步骤③所得溶液中滴加硝酸银溶液,又产生白色沉淀。
(1)该水样中一定存在的离子是
(2)若要确定可能存在的离子是否存在,还需进行的实验操作是
Ⅱ.现有
 、
、 、
、 、
、 四种溶液,该小组同学设计如下实验步骤进行鉴别:
四种溶液,该小组同学设计如下实验步骤进行鉴别:①取等体积的上述四种溶液A、B、C、D分别置于四支试管中,对四支试管均进行下列操作:加入过量的
 溶液、加热,将湿润的红色石蕊试纸靠近试管口。观察到盛装B、D溶液的试管口的试纸变蓝。
溶液、加热,将湿润的红色石蕊试纸靠近试管口。观察到盛装B、D溶液的试管口的试纸变蓝。②向①中反应后的四支试管中,分别依次加入足量
 溶液,观察到盛装B、C溶液的试管内产生白色沉淀。
溶液,观察到盛装B、C溶液的试管内产生白色沉淀。(3)溶液A、B、C、D中的溶质依次为
(4)有同学提出用一种试剂即可将四种溶液鉴别出来,该试剂为
您最近一年使用:0次
4 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:___________ 性。从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小明认为可能是___________ 。小王觉得可以设计实验验证这一推论,具体操作是___________ 。
(3)配平下列反应:___________ 。
___________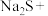 ___________
___________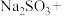 ___________
___________ ___________
___________ ___________
___________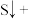 ___________
___________
(4)一种铁基脱硫剂脱除硫化氢( )的方法包括吸收和再生两个阶段,其工艺流程原理如下:
)的方法包括吸收和再生两个阶段,其工艺流程原理如下:___________ 写出“再生”的反应的离子方程式:___________ 。
②当吸收224 mL(标准状况) 时,若要保持脱硫液中
时,若要保持脱硫液中 的物质的量不变,则所通入的氧气的体积为
的物质的量不变,则所通入的氧气的体积为___________ mL。

(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小明认为可能是
(3)配平下列反应:
___________
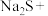 ___________
___________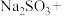 ___________
___________ ___________
___________ ___________
___________ ___________
___________
(4)一种铁基脱硫剂脱除硫化氢(
 )的方法包括吸收和再生两个阶段,其工艺流程原理如下:
)的方法包括吸收和再生两个阶段,其工艺流程原理如下:
②当吸收224 mL(标准状况)
 时,若要保持脱硫液中
时,若要保持脱硫液中 的物质的量不变,则所通入的氧气的体积为
的物质的量不变,则所通入的氧气的体积为
您最近一年使用:0次
解题方法
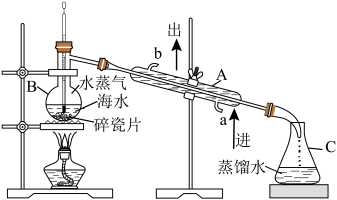
5 . 海洋资源的利用具有非常广阔的前景。回答下列问题:
(1)实验室模拟蒸馏法淡化海水如图所示,应向蒸馏烧瓶中加入沸石,目的是___________ 。下述装置图中有___________ 处错误。 、
、 、
、 ,要除去这些杂质离子得到精盐水,加入以下试剂的顺序可为
,要除去这些杂质离子得到精盐水,加入以下试剂的顺序可为___________ (填字母,可重复选用)。
a.NaOH溶液 b. 溶液 c.
溶液 c. 溶液 d.盐酸
溶液 d.盐酸
(3)根据以下数据分析,为什么冶炼镁时选择氯化镁,而冶炼铝时却选择氧化铝?
理由:___________ 。
(4)从海水中提取溴的工业过程如下图所示: .写出步骤②中苦卤(NaBr)被氯气氧化的化学反应方程式
.写出步骤②中苦卤(NaBr)被氯气氧化的化学反应方程式___________ 。
 .请写出步骤④反应的离子方程式:
.请写出步骤④反应的离子方程式:___________ 。
 .上述过程中步骤③④⑤的目的是
.上述过程中步骤③④⑤的目的是___________ 。
(1)实验室模拟蒸馏法淡化海水如图所示,应向蒸馏烧瓶中加入沸石,目的是
 、
、 、
、 ,要除去这些杂质离子得到精盐水,加入以下试剂的顺序可为
,要除去这些杂质离子得到精盐水,加入以下试剂的顺序可为a.NaOH溶液 b.
 溶液 c.
溶液 c. 溶液 d.盐酸
溶液 d.盐酸(3)根据以下数据分析,为什么冶炼镁时选择氯化镁,而冶炼铝时却选择氧化铝?
| 物质 | MgO |  |  |  |
| 熔点/℃ | 2852 | 2054 | 714 | 190 |
(4)从海水中提取溴的工业过程如下图所示:

 .写出步骤②中苦卤(NaBr)被氯气氧化的化学反应方程式
.写出步骤②中苦卤(NaBr)被氯气氧化的化学反应方程式 .请写出步骤④反应的离子方程式:
.请写出步骤④反应的离子方程式: .上述过程中步骤③④⑤的目的是
.上述过程中步骤③④⑤的目的是
您最近一年使用:0次
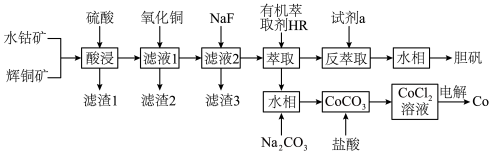
6 . 以水钴矿(Co2O3·H2O,含Fe2O3、MgO、CaO)和辉铜矿(Cu2S,含SiO2、Fe2O3)为原料制取胆矾和单质钴。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
③萃取Cu2+的反应原理;Cu2++2HR CuR2+2H+;
CuR2+2H+;
④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于___________ 。
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为___________ g(忽略溶液体积的变化)。
(5)“反萃取”步骤中加入的“试剂a”为___________ 。
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶1∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为___________ 。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Cu2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 2.7 | 7.5 | 7.6 | 4.7 |
| 完全沉淀时(c=10-5mol/L)的pH | 3.7 | 9.0 | 9.1 | 6.2 |
 CuR2+2H+;
CuR2+2H+;④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:
(2)“滤渣1”的主要成分为
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为
(5)“反萃取”步骤中加入的“试剂a”为
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶1∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为
您最近一年使用:0次
解题方法
7 . 四氯化锡( )是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
)是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
回答下列问题:
(1)“仪器a”的名称是___________ ,A中反应的离子方程式为___________ 。
(2)实验前应进行的操作是___________ ,实验开始时,应先点燃___________ (填“A”或“D”)处的酒精灯。
(3)若无“洗气瓶B”,可能会导致的问题是___________ 。
(4)实验结束后,“小试管b”内收集到的液体呈淡黄色,其原因是___________ 。
(5)“洗气瓶F”中所盛放的药品是___________ 。
 )是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
)是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。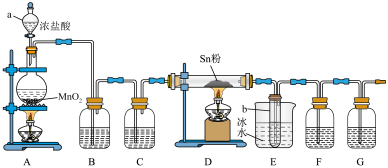
| 药品 | 颜色、状态 | 熔点(℃) | 沸点(℃) | 其他性质 |
| Sn | 银白色固体 | 231 | 2260 | 较活泼金属能与 、HCl等气体发生反应 、HCl等气体发生反应 |
 | 无色液体 | ﹣33 | 114 | 极易与水反应产生 溶胶 溶胶 |
(1)“仪器a”的名称是
(2)实验前应进行的操作是
(3)若无“洗气瓶B”,可能会导致的问题是
(4)实验结束后,“小试管b”内收集到的液体呈淡黄色,其原因是
(5)“洗气瓶F”中所盛放的药品是
您最近一年使用:0次
名校
解题方法
8 . 高砷烟尘(主要成分有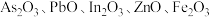 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在
在 易分解为
易分解为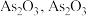 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)滤渣的主要成分为_______ (填化学式)。
(2)“高压酸浸”时, 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为_______ 。 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为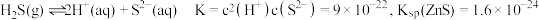 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
_______ 。
(4)“还原”后溶液酸性增强,主要原因是_______ (用离子方程式表示)。
(5)“结晶”操作为_______ 、过滤、洗涤、干燥。
(6)“萃余液”中含有的金属阳离子为_______ (填离子符号),将 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为_______ 。
(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用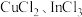 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是_______ ,该晶胞的六个面均为矩形,上、下底面的晶胞参数为 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为_______ (用含a、b、d的式子表示)。
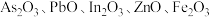 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: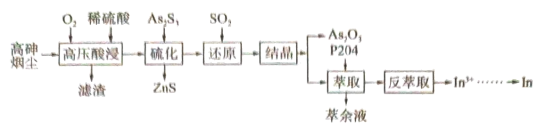
 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在
在 易分解为
易分解为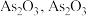 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)滤渣的主要成分为
(2)“高压酸浸”时,
 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为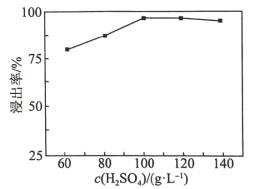
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为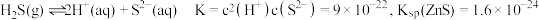 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
(4)“还原”后溶液酸性增强,主要原因是
(5)“结晶”操作为
(6)“萃余液”中含有的金属阳离子为
 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、
 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用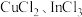 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
昨日更新
|
139次组卷
|
4卷引用: 湖南省北师联盟2024届高三下学期模拟考试三模化学试题
名校
解题方法
9 . 现有部分短周期元素的信息如表所示:
A、B、D三种单质(分别由X、Y、Z元素组成)和甲、乙、丙、丁、戊五种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种高能燃料,分子中含有18个电子,其组成元素与丙相同。___________ ,其简单离子的结构示意图为___________ 。
(2)丁的电子式为___________ 。
(3)丙中所含的化学键类型是___________ (填序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5 molNaClO参加反应时转移1 mol电子,该反应的化学方程式为___________ 。
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为___________ 。
| 元素编号 | 元素性质或原子结构信息 |
| X | 第三周期元素中简单离子半径最小的元素 |
| Y | 其最简单氢化物丙的水溶液呈碱性 |
| Z | 原子核外电子数和所在周期数相等 |

(2)丁的电子式为
(3)丙中所含的化学键类型是
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5 molNaClO参加反应时转移1 mol电子,该反应的化学方程式为
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为
您最近一年使用:0次
解题方法
10 . 废旧铅蓄电池具有较高的回收利用价值。由废铅膏(含 、
、 、
、 和
和 以及少量的铁和铝的氧化物)制备
以及少量的铁和铝的氧化物)制备 的流程如下:
的流程如下: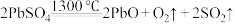 ;
;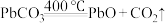
②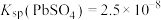 ,
,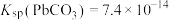
请回答下列问题:
(1)“浸取”时为增大浸取速率,可以采取的措施有___________ (请写一点)。
(2)“浸取”时 发生的主要反应的化学方程式为
发生的主要反应的化学方程式为___________ 。
(3)“浸取”时将 换成
换成 溶液效果会更好,
溶液效果会更好, 除作还原剂外,还有的作用为
除作还原剂外,还有的作用为___________ 。
(4)“脱硫”的目的是___________ 。
(5)“脱硫”时 转化反应的离子方程式为
转化反应的离子方程式为___________ ;用沉淀溶解平衡原理解释选择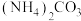 的原因
的原因___________ 。
(6)“焙烧”时会有中间产物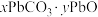 生成,固体残留率
生成,固体残留率 与温度的关系如图所示,则358℃时对应固体的成分为
与温度的关系如图所示,则358℃时对应固体的成分为___________ (填化学式)。
 、
、 、
、 和
和 以及少量的铁和铝的氧化物)制备
以及少量的铁和铝的氧化物)制备 的流程如下:
的流程如下: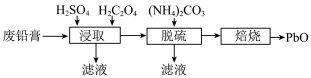
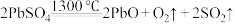 ;
;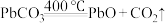
②
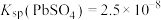 ,
,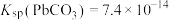
请回答下列问题:
(1)“浸取”时为增大浸取速率,可以采取的措施有
(2)“浸取”时
 发生的主要反应的化学方程式为
发生的主要反应的化学方程式为(3)“浸取”时将
 换成
换成 溶液效果会更好,
溶液效果会更好, 除作还原剂外,还有的作用为
除作还原剂外,还有的作用为(4)“脱硫”的目的是
(5)“脱硫”时
 转化反应的离子方程式为
转化反应的离子方程式为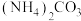 的原因
的原因(6)“焙烧”时会有中间产物
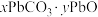 生成,固体残留率
生成,固体残留率 与温度的关系如图所示,则358℃时对应固体的成分为
与温度的关系如图所示,则358℃时对应固体的成分为
您最近一年使用:0次



