名校
解题方法
1 . 为除去粗盐中的Ca2+、Mg2+、 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)______ 。
(2)第③步中,加入的试剂是______ (填化学式),判断该试剂已过量的方法是______ 。
(3)第③步和第②步______ (填“能”或“不能”)交换,原因是______ 。
(4)第④步中涉及反应的离子方程式______ 。
(5)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是______ 。
 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)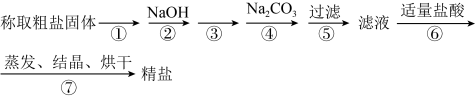
(2)第③步中,加入的试剂是
(3)第③步和第②步
(4)第④步中涉及反应的离子方程式
(5)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
您最近一年使用:0次
2 . A、B、C、D四种物质之间有下图所示的转化关系。已知:A是空气中的主要成分之一,B、C、D均为化合物,且C为一种红棕色气体。
(1)写出B的化学式:___________ ,A→B的过程___________ (填“是”或“否”)属于氮的固定。
(2)在上图D→C的过程中,D表现出强___________ (填“氧化性”或“还原性”)。
(3)配平C→D的化学方程式:__________ 。



(1)写出B的化学式:
(2)在上图D→C的过程中,D表现出强
(3)配平C→D的化学方程式:


您最近一年使用:0次
解题方法
3 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。由镍矿渣[主要含 、NiS,还含锌、铁、钙的氧化物、
、NiS,还含锌、铁、钙的氧化物、 等]制备草酸镍晶体的流程如图:
等]制备草酸镍晶体的流程如图: 与萃取剂(用HA表示)存在:
与萃取剂(用HA表示)存在: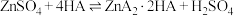
(1)“酸浸”过程中,生成了一种臭鸡蛋气味的气体,写出相应反应的离子方程式_______ ,滤渣1的主要成分是_______ 。
(2)已知“除铁”时,NaClO的作用是将 氧化为
氧化为 并转化为
并转化为 沉淀而除去,若将氧化剂改为
沉淀而除去,若将氧化剂改为 ,写出
,写出 与
与 反应生成
反应生成 的化学方程式
的化学方程式_______ 。
(3)“除钙”时,加入 溶液使钙离子转化为
溶液使钙离子转化为 沉淀,写出
沉淀,写出 的电子式
的电子式_______ 。
(4)若已知萃取剂的密度大于水的密度,则应保留_______ 液体。(填“上层”或“下层”)在完成“萃取”操作后,后续操作依次为_______ 、_______ 。
 、NiS,还含锌、铁、钙的氧化物、
、NiS,还含锌、铁、钙的氧化物、 等]制备草酸镍晶体的流程如图:
等]制备草酸镍晶体的流程如图: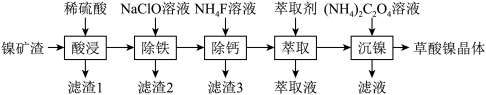
 与萃取剂(用HA表示)存在:
与萃取剂(用HA表示)存在: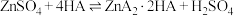
(1)“酸浸”过程中,生成了一种臭鸡蛋气味的气体,写出相应反应的离子方程式
(2)已知“除铁”时,NaClO的作用是将
 氧化为
氧化为 并转化为
并转化为 沉淀而除去,若将氧化剂改为
沉淀而除去,若将氧化剂改为 ,写出
,写出 与
与 反应生成
反应生成 的化学方程式
的化学方程式(3)“除钙”时,加入
 溶液使钙离子转化为
溶液使钙离子转化为 沉淀,写出
沉淀,写出 的电子式
的电子式(4)若已知萃取剂的密度大于水的密度,则应保留
您最近一年使用:0次
解题方法
4 . 合成氨及其衍生工业是化工生产的重要门类,其部分衍生工业如下图所示。
(1)写出反应Ⅰ的化学方程式______________ 。“固体2”俗名为____________ 。
(2)将一定质量的Cu粉投入到400mL 2mol/L的稀硝酸中,待Cu粉完全溶解时,收集到标准状况下的NO气体2.24L(假设硝酸的还原产物只有NO且气体全部逸出),再向反应后的溶液中缓慢加入Fe粉,充分反应后,最终溶液中只有一种溶质。
①写出Cu与稀硝酸反应的离子方程式________________ 。最初的Cu粉质量为__________ g。
②加入铁粉后,最终溶液的溶质是_________ (填化学式),至少需要加入铁粉为________ g。
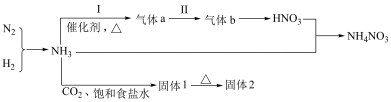
(1)写出反应Ⅰ的化学方程式
(2)将一定质量的Cu粉投入到400mL 2mol/L的稀硝酸中,待Cu粉完全溶解时,收集到标准状况下的NO气体2.24L(假设硝酸的还原产物只有NO且气体全部逸出),再向反应后的溶液中缓慢加入Fe粉,充分反应后,最终溶液中只有一种溶质。
①写出Cu与稀硝酸反应的离子方程式
②加入铁粉后,最终溶液的溶质是
您最近一年使用:0次
5 . 下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
(1)②的元素符号为___________ ;写出②的简单氢化物的化学式___________ 。
(2)①、⑤的原子半径大小是:①___________ ⑤(填“>”或“<”)。
(3)③、④和⑤中,金属性最强的元素是___________ (填元素符号)。
(4)③、⑥的最高价氧化物对应的水化物相互反应的离子方程式为___________ 。
族 周期 |  A A | 0 | |||||||
| 1 |  A A |  A A |  A A |  A A |  A A |  A A | |||
| 2 | ① | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | Ar | ||||
(2)①、⑤的原子半径大小是:①
(3)③、④和⑤中,金属性最强的元素是
(4)③、⑥的最高价氧化物对应的水化物相互反应的离子方程式为
您最近一年使用:0次
6 . 人类利用化学反应不仅可以创造新物质,还可以获取能量或实现不同形式能量之间的转化。回答下列问题:
(1)冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。制作冷敷袋可以利用___________ (填标号)。
a.吸热的物理变化 b.放热的物理变化 c.吸热的化学变化 d.放热的化学变化
(2)氨气是重要的化工原料,工业合成氨反应: 。已知在25℃、
。已知在25℃、 时,拆开
时,拆开 键、
键、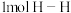 键和
键和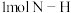 键所需能量分别为
键所需能量分别为 和
和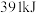 。
。
①根据上述数据判断,合成氨的反应是___________ 反应(填“吸热”或“放热”)。
②每消耗 ,反应放出或吸收的热量
,反应放出或吸收的热量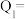
___________  。
。
③将 和
和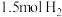 充入密闭容器中,在相同条件下发生该反应,达平衡时,放出或吸收的热量为
充入密闭容器中,在相同条件下发生该反应,达平衡时,放出或吸收的热量为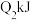 ,则
,则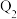
___________  (填“>”“<”或“=”),理由是
(填“>”“<”或“=”),理由是___________ 。
(3)饮用水中的 对人类健康产生危害,为了降低饮用水中
对人类健康产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 。补充完整下列化学方程式
。补充完整下列化学方程式_______ 。
___________ ___________
___________ ___________
___________ ___________+___________
___________+___________ ___________
___________
(4)从旧CPU中回收金部分流程如下。 、氯金酸、金元素的化合价为
、氯金酸、金元素的化合价为 )
)
若用 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量是
的物质的量是___________ 。
(5)明矾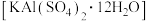 可用于净水。往明矾溶液中逐滴滴加
可用于净水。往明矾溶液中逐滴滴加 溶液,若使
溶液,若使 恰好完全沉淀,发生反应的离子方程式为
恰好完全沉淀,发生反应的离子方程式为___________ 。
(6)彩漂剂的主要成分是双氧水,使用时会释放出一种无色无味的气体,使污垢活化,易于洗涤。但是不能长期存放,会降低彩漂效果,则发生的反应的还原产物为___________ (写化学式)。
(1)冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。制作冷敷袋可以利用
a.吸热的物理变化 b.放热的物理变化 c.吸热的化学变化 d.放热的化学变化
(2)氨气是重要的化工原料,工业合成氨反应:
 。已知在25℃、
。已知在25℃、 时,拆开
时,拆开 键、
键、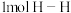 键和
键和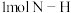 键所需能量分别为
键所需能量分别为 和
和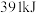 。
。①根据上述数据判断,合成氨的反应是
②每消耗
 ,反应放出或吸收的热量
,反应放出或吸收的热量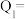
 。
。③将
 和
和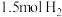 充入密闭容器中,在相同条件下发生该反应,达平衡时,放出或吸收的热量为
充入密闭容器中,在相同条件下发生该反应,达平衡时,放出或吸收的热量为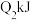 ,则
,则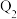
 (填“>”“<”或“=”),理由是
(填“>”“<”或“=”),理由是(3)饮用水中的
 对人类健康产生危害,为了降低饮用水中
对人类健康产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 。补充完整下列化学方程式
。补充完整下列化学方程式___________
 ___________
___________ ___________
___________ ___________+___________
___________+___________ ___________
___________
(4)从旧CPU中回收金部分流程如下。

 、氯金酸、金元素的化合价为
、氯金酸、金元素的化合价为 )
)若用
 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量是
的物质的量是(5)明矾
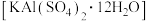 可用于净水。往明矾溶液中逐滴滴加
可用于净水。往明矾溶液中逐滴滴加 溶液,若使
溶液,若使 恰好完全沉淀,发生反应的离子方程式为
恰好完全沉淀,发生反应的离子方程式为(6)彩漂剂的主要成分是双氧水,使用时会释放出一种无色无味的气体,使污垢活化,易于洗涤。但是不能长期存放,会降低彩漂效果,则发生的反应的还原产物为
您最近一年使用:0次
解题方法
7 . 元素周期表与元素周期律在学习、研究中有很重要的作用。表中是6种不同元素的相关信息,其中W、X、Y、Z位于短周期。请回答以下问题:
(1)元素W、X、Y最高价氧化物水化物的酸性由强到弱的顺序为_______ (填化学式)。与Y同主族元素硒Se位于Y的下一周期,则Se在元素周期表中的位置是_______ , 的电子式是
的电子式是_______ 。
(2)元素周期表中,同主族元素性质具有相似性和递变性,请写出元素Q的单质与水反应的离子方程式_______ 。Z与X分别形成的气态简单氢化物稳定性高的为_______ (填化学式)。
(3)海水中提取R的单质,将R氧化为单质后,用空气将其吹入吸收塔中,与吸收剂 和水反应,则发生反应的离子的方程式是
和水反应,则发生反应的离子的方程式是_______ 。
| 元素 | 元素相关信息 |
| W | 最高化合价+7价 |
| X | 原子最外层电子数是内层电子总数的一半,且为非金属元素 |
| Y | 原子M层比L层少2个电子 |
| Z | 原子获得3个电子达到8电子稳定结构 |
| Q | 焰色试验(透过蓝色钴玻璃观察)火焰呈紫色 |
| R | 原子结构示意图为: |
 的电子式是
的电子式是(2)元素周期表中,同主族元素性质具有相似性和递变性,请写出元素Q的单质与水反应的离子方程式
(3)海水中提取R的单质,将R氧化为单质后,用空气将其吹入吸收塔中,与吸收剂
 和水反应,则发生反应的离子的方程式是
和水反应,则发生反应的离子的方程式是
您最近一年使用:0次
解题方法
8 . 150mL某无色溶液中可能含有 中的若干种,现将此溶液分成三等份,进行如下实验:
中的若干种,现将此溶液分成三等份,进行如下实验:
①向第一份中加入足量的 稀盐酸,生成0.448L气体(已换算成标准状况下);
稀盐酸,生成0.448L气体(已换算成标准状况下);
②向第二份中加入足量NaOH溶液并加热,收集到0.04mol气体;
③向第三份中加入足量BaCl2溶液,得到沉淀6.27g,加入足量 稀盐酸充分反应后,剩余沉淀2.33g。
稀盐酸充分反应后,剩余沉淀2.33g。
根据上述实验,回答下列问题:
(1)用12mol·L-1的浓盐酸配制240mL0.5mol·L-1稀盐酸,需要用量筒量取___________ mL浓盐酸,若在量取浓盐酸时俯视刻度线,则会导致配制的稀盐酸的浓度___________ (填“偏高”、“偏低”或“不变”)。
(2)实验②中生成气体的离子方程式为___________ 。
(3)实验③中沉淀部分溶解的化学方程式为___________ ,剩余沉淀的化学式为___________ 。
(4)原溶液中
___________ 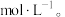
(5)经分析,溶液中一定存在Na+,理由是___________ 。
 中的若干种,现将此溶液分成三等份,进行如下实验:
中的若干种,现将此溶液分成三等份,进行如下实验:①向第一份中加入足量的
 稀盐酸,生成0.448L气体(已换算成标准状况下);
稀盐酸,生成0.448L气体(已换算成标准状况下);②向第二份中加入足量NaOH溶液并加热,收集到0.04mol气体;
③向第三份中加入足量BaCl2溶液,得到沉淀6.27g,加入足量
 稀盐酸充分反应后,剩余沉淀2.33g。
稀盐酸充分反应后,剩余沉淀2.33g。根据上述实验,回答下列问题:
(1)用12mol·L-1的浓盐酸配制240mL0.5mol·L-1稀盐酸,需要用量筒量取
(2)实验②中生成气体的离子方程式为
(3)实验③中沉淀部分溶解的化学方程式为
(4)原溶液中

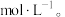
(5)经分析,溶液中一定存在Na+,理由是
您最近一年使用:0次
9 . 化学在生产生活中无处不在。
 .某汽车安全气囊的气体发生剂主要含有叠氮化钠(
.某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、三氧化二铁(
)、三氧化二铁( )、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)汽车受到猛烈碰撞时,点火器点火引发 迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是___________ (填字母),生成氮气的电子式为___________ 。 .
. 、
、 (甲醇)既是重要的化工原料,又是重要的能源物质。
(甲醇)既是重要的化工原料,又是重要的能源物质。
(2)将2.0 mol 和4.0 mol
和4.0 mol  通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应
通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应 ,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用
,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________ 。
(3)一定条件下,将1.0 mol 与2.0 mol
与2.0 mol  充入密闭容器中发生反应
充入密闭容器中发生反应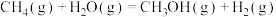 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是___________ (填字母)。
a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的 e.加入合适的催化剂
e.加入合适的催化剂
(4)用 设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为
设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为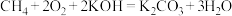 。
。 向B电极定向移动,则
向B电极定向移动,则___________ (填“A”或“B”)电极入口通甲烷,该电极反应的离子方程式为___________ 。
②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为___________ 。
 .某汽车安全气囊的气体发生剂主要含有叠氮化钠(
.某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、三氧化二铁(
)、三氧化二铁( )、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。(1)汽车受到猛烈碰撞时,点火器点火引发
 迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是A.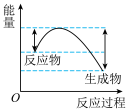 B.
B.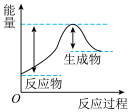 C.
C.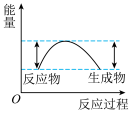
 .
. 、
、 (甲醇)既是重要的化工原料,又是重要的能源物质。
(甲醇)既是重要的化工原料,又是重要的能源物质。(2)将2.0 mol
 和4.0 mol
和4.0 mol  通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应
通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应 ,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用
,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为(3)一定条件下,将1.0 mol
 与2.0 mol
与2.0 mol  充入密闭容器中发生反应
充入密闭容器中发生反应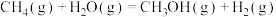 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的
 e.加入合适的催化剂
e.加入合适的催化剂(4)用
 设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为
设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为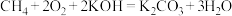 。
。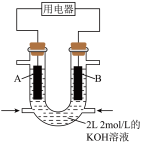
 向B电极定向移动,则
向B电极定向移动,则②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
您最近一年使用:0次
解题方法
10 . 某化学小组按下图所示实验流程比较浓硝酸和稀硝酸的氧化性强弱,其中B为一种紫红色金属,C为红棕色气体。
(1)A与B反应的化学方程式是_________________________ ;A与B反应迅速,实验中需要采取措施控制气体放出的快慢及多少,则装置I可以选择的装置为_________________________ 。 气体,该操作的目的是
气体,该操作的目的是___________ 。
(3)装置Ⅱ中发生反应的化学方程式是_______________ 。
(4)通过实验可得出:浓硝酸的氧化性比稀硝酸______________ (填“强”或“弱”),判断的依据是___________________ 。

(1)A与B反应的化学方程式是

 气体,该操作的目的是
气体,该操作的目的是(3)装置Ⅱ中发生反应的化学方程式是
(4)通过实验可得出:浓硝酸的氧化性比稀硝酸
您最近一年使用:0次