名校
解题方法
1 . 在处理 废气的过程中,催化剂
废气的过程中,催化剂 会逐渐失活变为
会逐渐失活变为 。某小组为解决这一问题,实验研究
。某小组为解决这一问题,实验研究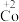 和
和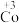 之间的相互转化。资料:
之间的相互转化。资料: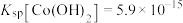 ,
,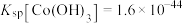
(1)探究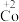 的还原性
的还原性
实验Ⅰ.粉红色的 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。
实验Ⅱ.向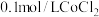 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ.按如图装置进行实验,观察到电压表指针偏转。
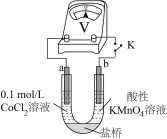
①甲同学根据实验Ⅲ得出结论: 可以被酸性
可以被酸性 溶液氧化。
溶液氧化。
乙同学补充实验Ⅳ,___________ (补全实验操作及现象),否定了该观点。
②探究碱性条件下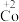 的还原性,进行实验。
的还原性,进行实验。
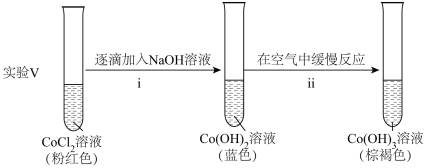
ⅱ中反应的化学方程式是___________ 。
③根据氧化还原反应规律解释:还原性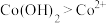 :
: 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使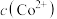 和
和 均降低,但
均降低,但___________ 降低的程度更大,还原剂的还原性增强。
(2)探究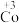 的氧化性
的氧化性
①根据实验Ⅲ和Ⅳ推测氧化性: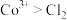 ,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,
,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,___________ (补全实验操作及现象),反应的离子方程式是___________ 。
②向Ⅴ中得到的棕褐色沉淀中滴加 溶液,加入催化剂,产生无色气泡,该气体是
溶液,加入催化剂,产生无色气泡,该气体是___________ 。
(3)利用“三室两膜”装置(如图)实现“电解”制备 。
。
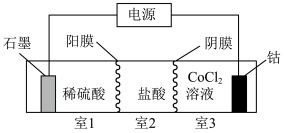
①石墨电极的电极反应式为___________
②生成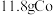 时,室1溶液质量理论上减少
时,室1溶液质量理论上减少___________ g。
 废气的过程中,催化剂
废气的过程中,催化剂 会逐渐失活变为
会逐渐失活变为 。某小组为解决这一问题,实验研究
。某小组为解决这一问题,实验研究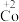 和
和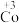 之间的相互转化。资料:
之间的相互转化。资料: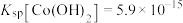 ,
,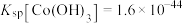
(1)探究
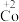 的还原性
的还原性实验Ⅰ.粉红色的
 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。实验Ⅱ.向
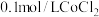 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ.按如图装置进行实验,观察到电压表指针偏转。

①甲同学根据实验Ⅲ得出结论:
 可以被酸性
可以被酸性 溶液氧化。
溶液氧化。乙同学补充实验Ⅳ,
②探究碱性条件下
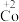 的还原性,进行实验。
的还原性,进行实验。
ⅱ中反应的化学方程式是
③根据氧化还原反应规律解释:还原性
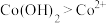 :
: 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使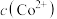 和
和 均降低,但
均降低,但(2)探究
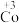 的氧化性
的氧化性①根据实验Ⅲ和Ⅳ推测氧化性:
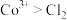 ,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,
,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,②向Ⅴ中得到的棕褐色沉淀中滴加
 溶液,加入催化剂,产生无色气泡,该气体是
溶液,加入催化剂,产生无色气泡,该气体是(3)利用“三室两膜”装置(如图)实现“电解”制备
 。
。
①石墨电极的电极反应式为
②生成
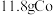 时,室1溶液质量理论上减少
时,室1溶液质量理论上减少
您最近一年使用:0次
名校
解题方法
2 . 某同学欲探究H2O2的氧化还原性:
(1)该同学从化合价的角度分析H2O2既有氧化性又有还原性,探究H2O2的氧化性可以选取的物质是:___________ (填序号)
①淀粉KI溶液(酸性) ②酸性KMnO4溶液 ③Cl2 ④HNO3溶液
任选一个你所选的物质进行实验,观察到___________ 现象,证明H2O2有氧化性,反应的离子方程式为___________ 。
(2)继续探究:
资料:Na2O2+2H2O=2NaOH+H2O2、2H2O2=2H2O+O2↑
①制备H2O2:将Na2O2溶于冰水中,产生少量气泡,得溶液A。
向A中加入过量稀H2SO4,得溶液B。
②检验H2O2:向溶液A、B中分别滴加适量KMnO4溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。反应的离子方程式为___________ 。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含MnO2,对其产生的原因提出猜想:
猜想1.KMnO4,有氧化性,能被还原为MnO2
猜想2.Mn2+有___________ 性,能与H2O2反应产生MnO2
猜想3……
③探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
iii是ii和i的对照实验。
①X是___________ 。
②a是___________ 、b是___________ 。
③取i中棕褐色固体,实验证明是MnO2。
综上所述,H2O2体现氧化性还是还原性与反应对象的性质和溶液的酸碱性有关。
(1)该同学从化合价的角度分析H2O2既有氧化性又有还原性,探究H2O2的氧化性可以选取的物质是:
①淀粉KI溶液(酸性) ②酸性KMnO4溶液 ③Cl2 ④HNO3溶液
任选一个你所选的物质进行实验,观察到
(2)继续探究:
资料:Na2O2+2H2O=2NaOH+H2O2、2H2O2=2H2O+O2↑
①制备H2O2:将Na2O2溶于冰水中,产生少量气泡,得溶液A。
向A中加入过量稀H2SO4,得溶液B。
②检验H2O2:向溶液A、B中分别滴加适量KMnO4溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。反应的离子方程式为
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含MnO2,对其产生的原因提出猜想:
猜想1.KMnO4,有氧化性,能被还原为MnO2
猜想2.Mn2+有
猜想3……
③探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
| 序号 | 实验 | 试剂 | 现象 |
| i | 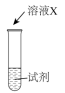 | a | 生成棕褐色固体,产生大量气泡 |
| ii | b | 有少量气泡 | |
| iii | H2O2溶液 | 有少量气泡 |
①X是
②a是
③取i中棕褐色固体,实验证明是MnO2。
综上所述,H2O2体现氧化性还是还原性与反应对象的性质和溶液的酸碱性有关。
您最近一年使用:0次
名校
解题方法
3 . 在处理NO废气的过程中,催化剂 会逐渐失活变为
会逐渐失活变为 。某小组为解决这一问题,实验研究
。某小组为解决这一问题,实验研究 和
和 之间的相互转化。
之间的相互转化。
资料:Ⅰ.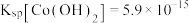

Ⅱ.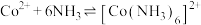
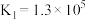
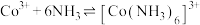
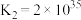
Ⅲ. 和
和 在酸性条件下均能生成
在酸性条件下均能生成
(1)探究 的还原性
的还原性
实验Ⅰ 粉红色的 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。
实验Ⅱ 向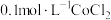 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ 按如图装置进行实验,观察到电压表指针偏转。
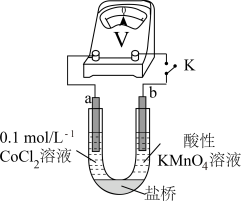
①甲同学根据实验Ⅲ得出结论: 能被酸性
能被酸性 溶液氧化。乙同学补充实验Ⅳ,
溶液氧化。乙同学补充实验Ⅳ,_______ (补全实验操作及现象),否定了该观点 。
②探究碱性条件下Co(Ⅱ)的还原性,进行实验。
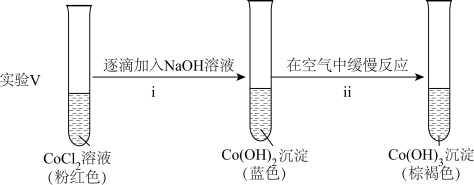
ⅱ中反应的化学方程式是_______ 。
③根据氧化还原反应规律解释还原性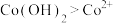 :
: 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使 和
和 均降低,但
均降低,但_______ 降低的程度更大,还原剂的还原性增强。
(2)探究 的氧化性
的氧化性
①根据实验Ⅲ和Ⅳ推测氧化性: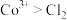 ,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,
,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,_______ (补全实验操作及现象),反应的离子方程式是_______ 。
②向Ⅴ中得到的棕褐色沉淀中,滴加 溶液,加入催化剂,产生无色气泡,该气体是
溶液,加入催化剂,产生无色气泡,该气体是_______ 。
 会逐渐失活变为
会逐渐失活变为 。某小组为解决这一问题,实验研究
。某小组为解决这一问题,实验研究 和
和 之间的相互转化。
之间的相互转化。资料:Ⅰ.
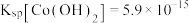

Ⅱ.
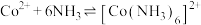
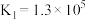
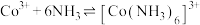
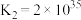
Ⅲ.
 和
和 在酸性条件下均能生成
在酸性条件下均能生成
(1)探究
 的还原性
的还原性实验Ⅰ 粉红色的
 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。实验Ⅱ 向
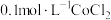 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ 按如图装置进行实验,观察到电压表指针偏转。

①甲同学根据实验Ⅲ得出结论:
 能被酸性
能被酸性 溶液氧化。乙同学补充实验Ⅳ,
溶液氧化。乙同学补充实验Ⅳ,②探究碱性条件下Co(Ⅱ)的还原性,进行实验。

ⅱ中反应的化学方程式是
③根据氧化还原反应规律解释还原性
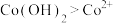 :
: 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使 和
和 均降低,但
均降低,但(2)探究
 的氧化性
的氧化性①根据实验Ⅲ和Ⅳ推测氧化性:
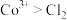 ,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,
,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,②向Ⅴ中得到的棕褐色沉淀中,滴加
 溶液,加入催化剂,产生无色气泡,该气体是
溶液,加入催化剂,产生无色气泡,该气体是
您最近一年使用:0次
名校
4 . 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
(1)制备N2H4
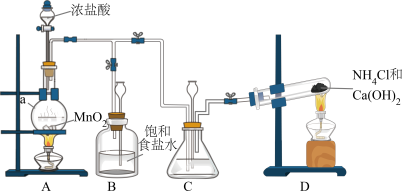
制备N2H4的离子方程式为___________ 。
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
(2)滴定到达终点的现象是___________ 。
(3)实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合肼的质量分数为___________ 。
Ⅲ.探究肼的性质。
(4)写出肼的电子式___________ ,肼为___________ 分子。(填“极性”或“非极性”)。
(5)预设肼可能具有___________ (a.氧化性 b.还原性 c.酸性 d.碱性)。
将制得的肼分离提纯后,进行如图实验探究。
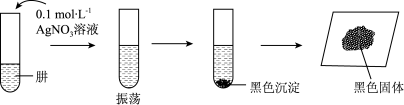
【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
(6)请完成表中的空白部分:①___________ ;②___________ 。
(7)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:___________ 。
(1)制备N2H4

制备N2H4的离子方程式为
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
(2)滴定到达终点的现象是
(3)实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合肼的质量分数为
Ⅲ.探究肼的性质。
(4)写出肼的电子式
(5)预设肼可能具有
将制得的肼分离提纯后,进行如图实验探究。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
| 操作 | 现象 | 实验结论 |
| i.取少量黑色固体于试管中,加入适量①___________ | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii.取少量黑色固体于试管中加入足量稀硝酸,振荡 | ②___________ | 黑色固体是Ag和Ag2O |
(7)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:
您最近一年使用:0次
名校
5 . 某小组探究含Cr元素的化合物间的转化,进行如下实验。
资料:
i.含Cr元素的常见粒子: (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、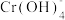 (亮绿色)。
(亮绿色)。
ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
(1)已知 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:_____ 。
(2)I中,溶液由橙色变为绿色的总反应的离子方程式是_____ 。
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是_____ 。
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:______ 。然后滴入NaOH溶液,有蓝灰色沉淀生成,继续滴入NaOH溶液,沉淀溶解,溶液变为______ 色。
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。
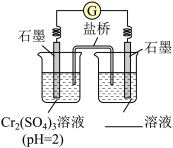
右侧烧杯的溶液中,氧化剂是_____ 。
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为_____ 。
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为_____ 。
(5)由上述实验, 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):
酸性条件下,
_____ H2O2;碱性条件下, 
_____ H2O2。
资料:
i.含Cr元素的常见粒子:
 (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、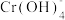 (亮绿色)。
(亮绿色)。ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
| 装置 | 步骤 | 操作 | 现象 |
 2mL0.0125mol•L-1K2Cr2O7溶液 | I | 先滴入稀硫酸至pH≈2,再滴入5滴5%H2O2溶液,振荡 | 溶液橙色加深。滴入H2O2溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 |
| Ⅱ | 继续缓慢滴入10滴2mol•L-1NaOH溶液,边滴,边振荡 | 又有气泡生成,溶液最终变为黄色 |
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:(2)I中,溶液由橙色变为绿色的总反应的离子方程式是
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。

右侧烧杯的溶液中,氧化剂是
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为
(5)由上述实验,
 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):酸性条件下,


您最近一年使用:0次
2023-01-07更新
|
405次组卷
|
4卷引用:北京市西城区2022-2023学年高二上学期1月期末考试化学试题
名校
解题方法
6 . 在处理NO废气的过程中,催化剂[Co(NH3)6]2+会逐渐失活变为[Co(NH3)6]3+。某小组为解决这一问题,实验研究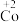 和
和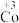 之间的相互转化。
之间的相互转化。
资料:i.Ksp[Co(OH)2]=5.9×10-15,Ksp[Co(OH)3]=1.6×10-44
ii.Co2++6NH3 [Co(NH3)6]2+K1=1.3×105
[Co(NH3)6]2+K1=1.3×105
Co3++6NH3 [Co(NH3)6]3+K2=2×1035
[Co(NH3)6]3+K2=2×1035
iii.[Co(NH3)6]2+和[Co(NH3)6]3+在酸性条件下均能生成NH
(1)探究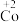 的还原性
的还原性
实验I.粉红色的CoCl2溶液或CoSO4溶液在空气中久置,无明显变化。
实验II.向0.1mol/LCoCl2溶液中滴入2滴酸性KMnO4溶液,无明显变化。
实验III.按如图装置进行实验,观察到电压表指针偏转。
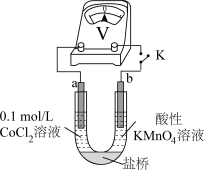
①甲同学根据实验III得出结论:Co2+可以被酸性KMnO4溶液氧化。
乙同学补充实验IV,____ (补全实验操作及现象),否定了该观点。
②探究碱性条件下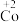 的还原性,进行实验。
的还原性,进行实验。
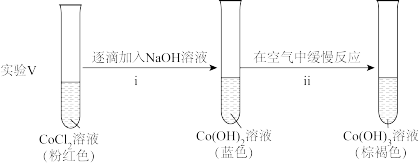
ii中反应的化学方程式是____ 。
③根据氧化还原反应规律解释:还原性Co(OH)2>Co2+:Co2+-e-=Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但____ 降低的程度更大,还原剂的还原性增强。
(2)探究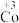 的氧化性
的氧化性
①根据实验III和IV推测氧化性:Co3+>Cl2,设计实验证明:向V中得到的棕褐色沉淀中,____ (补全实验操作及现象),反应的离子方程式是____ 。
②向V中得到的棕褐色沉淀中滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是____ 。
(3)催化剂[Co(NH3)6]2+的失活与再生
①结合数据解释[Co(NH3)6]2+能被氧化为[Co(NH3)6]3+而失活的原因:____ 。
②根据以上实验,设计物质转化流程图实现[Co(NH3)6]2+的再生:____ 。
示例:Co CoCl2
CoCl2 Co(OH)2
Co(OH)2
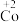 和
和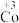 之间的相互转化。
之间的相互转化。资料:i.Ksp[Co(OH)2]=5.9×10-15,Ksp[Co(OH)3]=1.6×10-44
ii.Co2++6NH3
 [Co(NH3)6]2+K1=1.3×105
[Co(NH3)6]2+K1=1.3×105Co3++6NH3
 [Co(NH3)6]3+K2=2×1035
[Co(NH3)6]3+K2=2×1035iii.[Co(NH3)6]2+和[Co(NH3)6]3+在酸性条件下均能生成NH

(1)探究
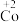 的还原性
的还原性实验I.粉红色的CoCl2溶液或CoSO4溶液在空气中久置,无明显变化。
实验II.向0.1mol/LCoCl2溶液中滴入2滴酸性KMnO4溶液,无明显变化。
实验III.按如图装置进行实验,观察到电压表指针偏转。

①甲同学根据实验III得出结论:Co2+可以被酸性KMnO4溶液氧化。
乙同学补充实验IV,
②探究碱性条件下
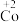 的还原性,进行实验。
的还原性,进行实验。
ii中反应的化学方程式是
③根据氧化还原反应规律解释:还原性Co(OH)2>Co2+:Co2+-e-=Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但
(2)探究
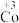 的氧化性
的氧化性①根据实验III和IV推测氧化性:Co3+>Cl2,设计实验证明:向V中得到的棕褐色沉淀中,
②向V中得到的棕褐色沉淀中滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是
(3)催化剂[Co(NH3)6]2+的失活与再生
①结合数据解释[Co(NH3)6]2+能被氧化为[Co(NH3)6]3+而失活的原因:
②根据以上实验,设计物质转化流程图实现[Co(NH3)6]2+的再生:
示例:Co
 CoCl2
CoCl2 Co(OH)2
Co(OH)2
您最近一年使用:0次
2022-05-08更新
|
1337次组卷
|
9卷引用:北京市西城区2022届高三第二次模拟测试化学试题
名校
解题方法
7 . 某同学欲探究 的氧化还原性:
的氧化还原性:
资料: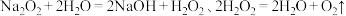
制备 :将
:将 溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀 ,得溶液B。
,得溶液B。
检验 :向溶液A、B中分别滴加适量
:向溶液A、B中分别滴加适量 溶液。
溶液。
I.B中产生气泡,滴入的溶液紫色褪去。
(1)反应的离子方程式为___________ 。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:
(2)猜想1. 有氧化性,能被还原为
有氧化性,能被还原为
猜想2. 有
有___________ 性,能与 反应产生
反应产生
猜想3……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
iii是ii和i的对照实验。
①X是___________ 。
②a是___________ 、b是___________ 。
③取i中棕褐色固体,实验证明是 。
。
综上所述, 体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
 的氧化还原性:
的氧化还原性:资料:
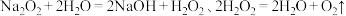
制备
 :将
:将 溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀 ,得溶液B。
,得溶液B。检验
 :向溶液A、B中分别滴加适量
:向溶液A、B中分别滴加适量 溶液。
溶液。I.B中产生气泡,滴入的溶液紫色褪去。
(1)反应的离子方程式为
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含
 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:(2)猜想1.
 有氧化性,能被还原为
有氧化性,能被还原为
猜想2.
 有
有 反应产生
反应产生
猜想3……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
| 序号 | 实验 | 试剂 | 现象 |
| i |  | a | 生成棕褐色固体,产生大量气泡 |
| ii | b | 有少量气泡 | |
| iii |  溶液 溶液 | 有少量气泡 |
①X是
②a是
③取i中棕褐色固体,实验证明是
 。
。综上所述,
 体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
您最近一年使用:0次
8 . 某同学欲探究H2O2的氧化还原性:
(1)该同学从化合价的角度分析H2O2既有氧化性又有还原性,其原因是___________ 。
(2)探究H2O2的氧化性可以选取的物质是:___________ (填序号)
①淀粉KI溶液 ②FeSO4溶液 ③Cl2④HNO3溶液
任选一个你所选的物质进行实验,观察到___________ 现象,证明H2O2有氧化性,反应的离子方程式为___________ 。
(3)继续探究:
资料:Na2O2+2H2O=2NaOH+H2O2、2H2O2=2H2O+O2↑
①制备H2O2:将Na2O2溶于冰水中,产生少量气泡,得溶液A。
向A中加入过量稀H2SO4,得溶液B。
②检验H2O2:向溶液A、B中分别滴加适量KMnO4溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
反应的离子方程式为___________ 。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含MnO2,对其产生的原因提出猜想:
猜想1.KMnO4,有氧化性,能被还原为MnO2
猜想2.Mn2+有___________ 性,能与H2O2反应产生MnO2
猜想3……
③探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
iii是ii和i的对照实验。
①X是___________ 。
②a是___________ 、b是___________ 。
③取i中棕褐色固体,实验证明是MnO2。
综上所述,H2O2体现氧化性还是还原性与反应对象的性质和溶液的酸碱性有关。
(1)该同学从化合价的角度分析H2O2既有氧化性又有还原性,其原因是
(2)探究H2O2的氧化性可以选取的物质是:
①淀粉KI溶液 ②FeSO4溶液 ③Cl2④HNO3溶液
任选一个你所选的物质进行实验,观察到
(3)继续探究:
资料:Na2O2+2H2O=2NaOH+H2O2、2H2O2=2H2O+O2↑
①制备H2O2:将Na2O2溶于冰水中,产生少量气泡,得溶液A。
向A中加入过量稀H2SO4,得溶液B。
②检验H2O2:向溶液A、B中分别滴加适量KMnO4溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
反应的离子方程式为
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含MnO2,对其产生的原因提出猜想:
猜想1.KMnO4,有氧化性,能被还原为MnO2
猜想2.Mn2+有
猜想3……
③探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
| 序号 | 实验 | 试剂 | 现象 |
| i | 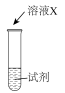 | a | 生成棕褐色固体,产生大量气泡 |
| ii | b | 有少量气泡 | |
| iii | H2O2溶液 | 有少量气泡 |
①X是
②a是
③取i中棕褐色固体,实验证明是MnO2。
综上所述,H2O2体现氧化性还是还原性与反应对象的性质和溶液的酸碱性有关。
您最近一年使用:0次
9 . 过氧化氢水溶液是医药、卫生行业上广泛使用的消毒剂。某兴趣小组对过氧化氢(H2O2)氧化性和还原性开展如下探究。
【查阅资料】
①BaO2与稀硫酸反应可制得H2O2,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2。
②H2O2在常温下会缓慢分解成水和氧气,在加热或MnO2等催化剂作用下会迅速分解。
③H2O2在碱性条件下能与Mn2+反应生成棕褐色固体,产生大量气泡。
【实验探究】
(1)制备H2O2:将BaO2溶于足量的冷稀硫酸中充分反应,经_____ (填操作名称)得到含H2O2的溶液A。
(2)检验H2O2:取一定量的溶液A于试管中,加入少量MnO2,迅速产生大量气泡,检验该气体的方法是_____ 。
(3)探究H2O2的氧化性和还原性:
I.向一定量的KMnO4溶液中滴加溶液A,产生气泡,溶液紫色褪去。反应的化学方程式为2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O,其中H2O2作_____ 剂。
Ⅱ.向一定量的FeSO4溶液中滴加溶液A,溶液变为棕黄色,此反应的离子方程式为_____ ,其中H2O2作_____ 剂。
Ⅲ.该小组设计如表实验探究H2O2与Mn2+的反应。
①设计实验i的目的是_____ 。
②试剂a应选_____ 。
A.NaCl B.HCl C.NaOH D.KNO3
③取ii中生成的棕褐色固体,滴加浓盐酸,加热,产生黄绿色气体,应选用的气体发生装置是_____ (填序号)。
A. B.
B.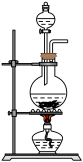 C.
C.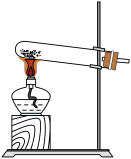 D.
D.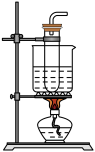
(4)综上所述,H2O2在反应中表现氧化性或还原性,与其它反应物的氧化性或还原性强弱以及溶液的_____ 性等因素有关。
【查阅资料】
①BaO2与稀硫酸反应可制得H2O2,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2。
②H2O2在常温下会缓慢分解成水和氧气,在加热或MnO2等催化剂作用下会迅速分解。
③H2O2在碱性条件下能与Mn2+反应生成棕褐色固体,产生大量气泡。
【实验探究】
(1)制备H2O2:将BaO2溶于足量的冷稀硫酸中充分反应,经
(2)检验H2O2:取一定量的溶液A于试管中,加入少量MnO2,迅速产生大量气泡,检验该气体的方法是
(3)探究H2O2的氧化性和还原性:
I.向一定量的KMnO4溶液中滴加溶液A,产生气泡,溶液紫色褪去。反应的化学方程式为2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O,其中H2O2作
Ⅱ.向一定量的FeSO4溶液中滴加溶液A,溶液变为棕黄色,此反应的离子方程式为
Ⅲ.该小组设计如表实验探究H2O2与Mn2+的反应。
| 序号 | 实验 | 溶液 | 现象 |
| i | 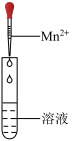 | H2O2 | 有少量气泡 |
| ii | H2O2+H2SO4 | 有少量气泡 | |
| iii | H2O2+a | 生成棕褐色固体,产生大量气泡 |
②试剂a应选
A.NaCl B.HCl C.NaOH D.KNO3
③取ii中生成的棕褐色固体,滴加浓盐酸,加热,产生黄绿色气体,应选用的气体发生装置是
A.
 B.
B. C.
C. D.
D.
(4)综上所述,H2O2在反应中表现氧化性或还原性,与其它反应物的氧化性或还原性强弱以及溶液的
您最近一年使用:0次
名校
10 . 下表为元素周期表的一部分,请参照元素在表中的位置,回答下列问题:
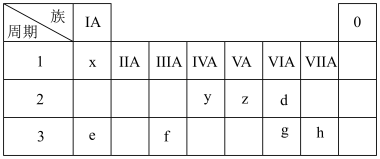
(1)比较d、e常见离子的半径大小(用化学式表示,下同):_______ >_______ ;
(2)比较g、h的最高价氧化物对应水化物的酸性强弱:_______ >_______ 。
(3)用电子式表示e、g组成的简单化合物的形成过程:_______ 。
(4)下列说法不正确的是_______。
(5)由表中两种元素的原子按 组成的常见液态化合物
组成的常见液态化合物 的稀溶液易被
的稀溶液易被 催化分解,查阅资料可知:在催化过程中发生了两步氧化还原反应,第一步反应中
催化分解,查阅资料可知:在催化过程中发生了两步氧化还原反应,第一步反应中 表现还原性;第二步反应中
表现还原性;第二步反应中 表现氧化性;请写出第二步反应的离子方程式(Q用化学式表示)
表现氧化性;请写出第二步反应的离子方程式(Q用化学式表示)_______ 。
(6)上述元素可组成盐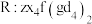 ,向盛有一定量
,向盛有一定量 盐溶液的烧杯中逐滴滴加
盐溶液的烧杯中逐滴滴加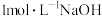 溶液,沉淀物质的量随
溶液,沉淀物质的量随 溶液体积的变化如下图所示:
溶液体积的变化如下图所示:
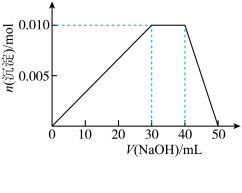
若向上述 盐溶液中改加
盐溶液中改加 溶液,充分反应后,溶液中产生沉淀的物质的量为
溶液,充分反应后,溶液中产生沉淀的物质的量为_______  。
。

(1)比较d、e常见离子的半径大小(用化学式表示,下同):
(2)比较g、h的最高价氧化物对应水化物的酸性强弱:
(3)用电子式表示e、g组成的简单化合物的形成过程:
(4)下列说法不正确的是_______。
A.最简单的氢化物的稳定性 |
B.最高价氧化物对应的水化物的碱性 |
| C.与y元素同主族的第四周期元素的单质是半导体材料 |
| D.y、h两元素组成的化合物中一定只含共价键 |
(5)由表中两种元素的原子按
 组成的常见液态化合物
组成的常见液态化合物 的稀溶液易被
的稀溶液易被 催化分解,查阅资料可知:在催化过程中发生了两步氧化还原反应,第一步反应中
催化分解,查阅资料可知:在催化过程中发生了两步氧化还原反应,第一步反应中 表现还原性;第二步反应中
表现还原性;第二步反应中 表现氧化性;请写出第二步反应的离子方程式(Q用化学式表示)
表现氧化性;请写出第二步反应的离子方程式(Q用化学式表示)(6)上述元素可组成盐
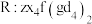 ,向盛有一定量
,向盛有一定量 盐溶液的烧杯中逐滴滴加
盐溶液的烧杯中逐滴滴加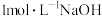 溶液,沉淀物质的量随
溶液,沉淀物质的量随 溶液体积的变化如下图所示:
溶液体积的变化如下图所示:
若向上述
 盐溶液中改加
盐溶液中改加 溶液,充分反应后,溶液中产生沉淀的物质的量为
溶液,充分反应后,溶液中产生沉淀的物质的量为 。
。
您最近一年使用:0次



