解题方法
1 . 某合作学习小组在实验室进行了由食盐制备纯碱的实验探究。请回答下列实验方案中的有关问题:
(1)制备原理:饱和氯化钠与碳酸氢铵反应得碳酸氢钠晶体,碳酸氢钠分解得到纯碱。反应为___ (写化学方程式)。
制备碳酸氢钠有以下三种方案,其中最好的方案是___ (填方案代号)。
方案A:分别将二氧化碳和氨气通入饱和食盐水中;
方案B:将二氧化碳通入含大量氨的饱和食盐水中;
方案C:将氨气通入含二氧化碳的饱和食盐水中。
(2)制备流程:
配制含氨的饱和食盐水→配制二氧化碳→制备碳酸氢钠→制备碳酸钠
实验中使用的部分简易装置如图所示:

其中装置乙的作用为___ ,装置丙的作用为___ ;实验中在装置乙丙之间还应连接制备碳酸氢钠的装置,且反应温度控制在30-35℃,请在答题卡上方框内画出该装置的简易图示___ 。实验的最后一步是将碳酸氢钠晶体转移到___ 中,加热至无水蒸气逸出既得碳酸钠。
(3)实验探究:制备碳酸氢钠的温度要控制在30-35℃,其理由是____ 。
本方法制得的纯碱中可能含有氯化钠,请设计检验实验方案,完成表中内容。
(1)制备原理:饱和氯化钠与碳酸氢铵反应得碳酸氢钠晶体,碳酸氢钠分解得到纯碱。反应为
制备碳酸氢钠有以下三种方案,其中最好的方案是
方案A:分别将二氧化碳和氨气通入饱和食盐水中;
方案B:将二氧化碳通入含大量氨的饱和食盐水中;
方案C:将氨气通入含二氧化碳的饱和食盐水中。
(2)制备流程:
配制含氨的饱和食盐水→配制二氧化碳→制备碳酸氢钠→制备碳酸钠
实验中使用的部分简易装置如图所示:

其中装置乙的作用为
(3)实验探究:制备碳酸氢钠的温度要控制在30-35℃,其理由是
本方法制得的纯碱中可能含有氯化钠,请设计检验实验方案,完成表中内容。
| 实验步骤 | 实验现象与结论 |
您最近一年使用:0次
解题方法
2 . 下图是中学化学实验中出现频率较高的装置,它是由物质制备、生成物性质检验和尾气处理三部分组成。请你用中学化学常见试剂设计一个实验,通过乙中的反应和丙中的实验现象,得出三种物质性质递变的结论。试将试剂名称、丙中的实验现象及由此得出的实验结论填入下列空白处。

(1)所用试剂的名称:甲_______ ,乙_______ ,丙_______ 。
(2)丙中现象:_______ 。丙中反应的化学方程式:_______ 。
(3)实验结论:_______ 。

(1)所用试剂的名称:甲
(2)丙中现象:
(3)实验结论:
您最近一年使用:0次
名校
3 . 下列实验目的、实验操作及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 验证肉桂醛中含碳碳双键 | 向肉桂醛(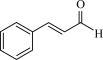 )中加入酸性KMnO4溶液 )中加入酸性KMnO4溶液 | 肉桂醛中含有碳碳双键 |
| B | 比较CuSO4和KMnO4的催化效果 | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4溶液和KMnO4溶液,CuSO4溶液产生气泡速率快 | CuSO4催化H2O2溶液分解效果更好 |
| C | 验证菠菜中含有铁元素 | 将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入几滴KSCN溶液,溶液不变红 | 说明菠菜中不含铁元素 |
| D | 判断强酸和弱酸 | NaHCO3溶液显碱性,NaHSO3溶液显酸性 | 可以确定H2CO3是弱酸,无法判断H2SO3是否为弱酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-19更新
|
807次组卷
|
2卷引用:江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题
解题方法
4 . 下列实验操作及现象均正确的是
| 选项 | 实验目的 | 实验操作 | 实验现象 |
| A | 探究硼酸和碳酸的酸性强弱 | 将足量硼酸滴入Na2CO3溶液中 | 有气泡产生 |
| B | 验证铜和浓硫酸反应的产物中有硫酸铜生成 | 直接向反应后的试管中加入蒸馏水 | 溶液变蓝 |
| C | 探究维生素C可以还原Fe3+ | 向盛有FeCl3溶液的试管中滴加适量浓维生素C溶液 | 溶液由黄色变为浅绿色 |
| D | 探究Fe3+和I-之间的反应为可逆反应 | 向氯化铁溶液中滴入少量 KI溶液,将反应后的溶液两等分,向其中一份滴入KSCN溶液,另一份滴淀粉溶液 | 一份溶液显血红色,另一份溶液显蓝色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 某地出产的矿石A可看作由主要成分硅酸铜盐X·7H2O (摩尔质量=406 g·mol-1 )与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液I和II中滴入KSCN溶液,前者无现象,后者显血红色。所有数据均已折算为标准状况。
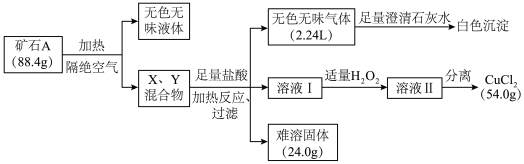
请回答:
(1)写出Y中除氧以外的元素符号_________ ,X的化学式为________ 。
(2)如果往溶液II中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所致,写出反应的离子方程式________ ; 加足量H2O2后对溶液II进行分离,可得到该元素的氧化物Z 4.0g,写出杂质Y与盐酸反应的化学方程式________ 。
(3)将Z与KNO3、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成KNO2和H2O。写出该反应的化学方程式________ 。
(4)通过完全电解上述流程所得的54.0 g CuCl2 (熔融状态)制备Cu,但还原产物也可能是Cu2O,试设计实验证明还原产物的组成__________ 。

请回答:
(1)写出Y中除氧以外的元素符号
(2)如果往溶液II中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所致,写出反应的离子方程式
(3)将Z与KNO3、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成KNO2和H2O。写出该反应的化学方程式
(4)通过完全电解上述流程所得的54.0 g CuCl2 (熔融状态)制备Cu,但还原产物也可能是Cu2O,试设计实验证明还原产物的组成
您最近一年使用:0次
6 . 风绪小组探究 的相关性质。
的相关性质。
(1)对于 和水反应放出氧气的现象,他们推测,可能和
和水反应放出氧气的现象,他们推测,可能和 有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是
有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是 在水中反应生成了
在水中反应生成了 ,后
,后 分解。通过查阅资料得知:
分解。通过查阅资料得知: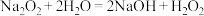 ,
,
①借助资料和实验,发现可以通过 溶于冷水制备少量的
溶于冷水制备少量的 。使用冷水的原因是
。使用冷水的原因是_______ 。
②为验证资料的真实性,他们向溶液中滴加适量的酸性 溶液,发现产生气泡,产生气泡的原因是(用方程式表示)
溶液,发现产生气泡,产生气泡的原因是(用方程式表示)_______ 。
(2)在有同学做实验时,还观察到了棕褐色沉淀,他们推测是 。猜测可能是
。猜测可能是 与
与 发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
①先向沉淀中加入浓盐酸并加热,观察到有_______ 气体产生,发生反应_______ 。证明了猜想正确。
②后续得知,同学在制酸性 溶液时,加入的硫酸的量不一样。推测可能是
溶液时,加入的硫酸的量不一样。推测可能是 浓度不同造成的。于是,他们改用有
浓度不同造成的。于是,他们改用有 的
的 溶液滴入
溶液滴入 溶液中,仅观察到了
溶液中,仅观察到了_______ 沉淀,并证明是 ,反应方程式是
,反应方程式是_______ 。
(3) 在反应时,表现氧化性还是还原性,和
在反应时,表现氧化性还是还原性,和_______ 有关。
 的相关性质。
的相关性质。(1)对于
 和水反应放出氧气的现象,他们推测,可能和
和水反应放出氧气的现象,他们推测,可能和 有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是
有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是 在水中反应生成了
在水中反应生成了 ,后
,后 分解。通过查阅资料得知:
分解。通过查阅资料得知: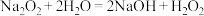 ,
,
①借助资料和实验,发现可以通过
 溶于冷水制备少量的
溶于冷水制备少量的 。使用冷水的原因是
。使用冷水的原因是②为验证资料的真实性,他们向溶液中滴加适量的酸性
 溶液,发现产生气泡,产生气泡的原因是(用方程式表示)
溶液,发现产生气泡,产生气泡的原因是(用方程式表示)(2)在有同学做实验时,还观察到了棕褐色沉淀,他们推测是
 。猜测可能是
。猜测可能是 与
与 发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。①先向沉淀中加入浓盐酸并加热,观察到有
②后续得知,同学在制酸性
 溶液时,加入的硫酸的量不一样。推测可能是
溶液时,加入的硫酸的量不一样。推测可能是 浓度不同造成的。于是,他们改用有
浓度不同造成的。于是,他们改用有 的
的 溶液滴入
溶液滴入 溶液中,仅观察到了
溶液中,仅观察到了 ,反应方程式是
,反应方程式是(3)
 在反应时,表现氧化性还是还原性,和
在反应时,表现氧化性还是还原性,和
您最近一年使用:0次
解题方法
7 . 最近我国有人报道,将0.1 mol· L-1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1 mol· L-1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得浑浊。
(1)设此装置中发生的是铜离子和硫离子直接相遇的反应,已知 (Cu2+/Cu)和
(Cu2+/Cu)和 (S/S2-)分别为0.345 V和-0.476V, nF
(S/S2-)分别为0.345 V和-0.476V, nF =RTlnK,
=RTlnK, 表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数
表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数____ ,写出平衡常数表达式______ 。
(2)金属铜和浑浊现象均出现在蛋壳外,这意味着____ 。
(3)该报道未提及硫离子与铜离子相遇时溶液的pH。现设pH=6,写出反应的离子方程式______ 。
(4)请对此实验结果作一简短评论____ 。
(1)设此装置中发生的是铜离子和硫离子直接相遇的反应,已知
 (Cu2+/Cu)和
(Cu2+/Cu)和 (S/S2-)分别为0.345 V和-0.476V, nF
(S/S2-)分别为0.345 V和-0.476V, nF =RTlnK,
=RTlnK, 表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数
表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数(2)金属铜和浑浊现象均出现在蛋壳外,这意味着
(3)该报道未提及硫离子与铜离子相遇时溶液的pH。现设pH=6,写出反应的离子方程式
(4)请对此实验结果作一简短评论
您最近一年使用:0次
解题方法
8 . “消洗灵”是具有消毒、杀菌、漂白和洗涤等综合功效的固体粉末,消毒原理与“84消毒液”相似,化学组成可以表示为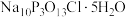 (磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
(磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
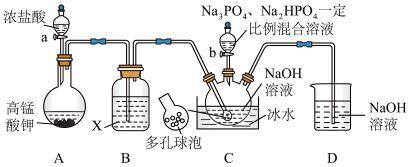
回答下列问题:
(1)①写出X试剂的名称______________ 。
②写出C中采用多孔球泡的目的______________ 。
③写出D装置的作用______________ 。
(2)打开仪器a的活塞及弹簧夹K,制备 碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
① “一系列操作”包括___________ 、___________ 、过滤、洗涤、低温干燥。
②若C中的 与
与 按物质的量之比
按物质的量之比 混合,写出C中制备“消洗灵”的总反应的化学方程式
混合,写出C中制备“消洗灵”的总反应的化学方程式______________ 。
③若生成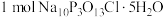 ,写出理论上至少消耗
,写出理论上至少消耗 的物质的量
的物质的量______________ 。
(3)“消洗灵”消毒时对金属腐蚀性小,原因是成分中的磷酸钠与空气共同作用,在金属表面形成不溶性磷酸盐膜,对金属具有良好的保护作用。写出用“消洗灵”对镁合金消毒,形成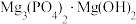 保护层的反应的化学方程式
保护层的反应的化学方程式______________ 。
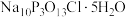 (磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
(磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
回答下列问题:
(1)①写出X试剂的名称
②写出C中采用多孔球泡的目的
③写出D装置的作用
(2)打开仪器a的活塞及弹簧夹K,制备
 碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。① “一系列操作”包括
②若C中的
 与
与 按物质的量之比
按物质的量之比 混合,写出C中制备“消洗灵”的总反应的化学方程式
混合,写出C中制备“消洗灵”的总反应的化学方程式③若生成
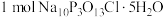 ,写出理论上至少消耗
,写出理论上至少消耗 的物质的量
的物质的量(3)“消洗灵”消毒时对金属腐蚀性小,原因是成分中的磷酸钠与空气共同作用,在金属表面形成不溶性磷酸盐膜,对金属具有良好的保护作用。写出用“消洗灵”对镁合金消毒,形成
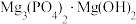 保护层的反应的化学方程式
保护层的反应的化学方程式
您最近一年使用:0次
解题方法
9 . 氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途。某兴趣小组用四氯化硅与氮气在氢气气氛保护下,加热发生反应,可得较高纯度的氮化硅及氯化氢,设计如图所示装置。
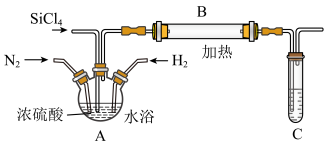
试回答下列问题:
(1)实验室制备氢气常用锌和稀硫酸反应,制取时常在反应混合物中加入少量硫酸铜溶液,其目的是_______ 。
(2)图中装置A的作用是_______ 、调节通入气体速率和充分混合气体。通过观察_______ ,来调节通入气体的速率。
(3)加热B玻璃管之前,为防止意外发生,必须进行的操作是_______ (不用详述步骤),B中发生反应的化学方程式为_______ 。
(4)四氯化硅与水反应生成两种酸,写出用烧碱溶液吸收尾气中四氯化硅的化学方程式:_______ 。

试回答下列问题:
(1)实验室制备氢气常用锌和稀硫酸反应,制取时常在反应混合物中加入少量硫酸铜溶液,其目的是
(2)图中装置A的作用是
(3)加热B玻璃管之前,为防止意外发生,必须进行的操作是
(4)四氯化硅与水反应生成两种酸,写出用烧碱溶液吸收尾气中四氯化硅的化学方程式:
您最近一年使用:0次
10 . 实验室常用NH4Cl(饱和)与NaNO2(饱和)加热制备N2。
(1)该制备反应的离子方程式为_______ 。
(2)用该方法制得的N2气中常含有H2O、NO、O2、NH3等杂质,请分别写出除去O2和NH3所用的化学物质,O2:_______ ;NH3_______ 。
(3)上述除杂实验装置中,除去杂质_______ 的装置应该放在最后一步。
(1)该制备反应的离子方程式为
(2)用该方法制得的N2气中常含有H2O、NO、O2、NH3等杂质,请分别写出除去O2和NH3所用的化学物质,O2:
(3)上述除杂实验装置中,除去杂质
您最近一年使用:0次
2021-07-17更新
|
148次组卷
|
2卷引用:第29届全国高中学生化学奥林匹克竞赛(江苏赛区)初赛试题



