解题方法
1 . 为探究某绿矾样品的变质情况,化学兴趣小组的同学设计了下列实验方案。
可供选择的试剂:硫氰化钾溶液、酸性高锰酸钾溶液、氯水、氢氧化钠溶液、氯化钡溶液,请参与完成方案设计。
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。
(1)如何证明绿矾已经被氧化_______ 。
(2)如何证明绿矾已经被完全氧化_______ 。
(3)在使用硫酸亚铁时,如何防止 的干扰?写出相关离子方程式
的干扰?写出相关离子方程式_______ 。
可供选择的试剂:硫氰化钾溶液、酸性高锰酸钾溶液、氯水、氢氧化钠溶液、氯化钡溶液,请参与完成方案设计。
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。
(1)如何证明绿矾已经被氧化
(2)如何证明绿矾已经被完全氧化
(3)在使用硫酸亚铁时,如何防止
 的干扰?写出相关离子方程式
的干扰?写出相关离子方程式
您最近一年使用:0次
解题方法
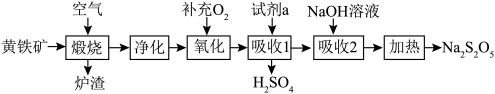
2 . 硫酸的消耗量是衡量一个国家化学工业发展水平的标志。以黄铁矿(主要成分为 )为原料生产
)为原料生产 和
和 。
。
(1) 中铁元素的化合价为
中铁元素的化合价为___________ ;试剂a为___________ 。
(2)若要增大煅烧过程的反应速率,应采取的措施是___________ (写两条即可)。
(3)煅烧时主要反应的化学方程式为___________ 。
(4)“氧化”时,反应的化学方程式为___________ 。
(5) 可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中
可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中 的含量。请配平其反应的化学方程式:
的含量。请配平其反应的化学方程式:_________
______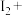 _______
_______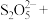 _______
_______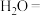 ________
________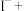 ______
______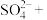 ___________
___________
若要检验 是否变质生成了
是否变质生成了 ,所用的试剂是
,所用的试剂是___________ 。
(6)在测定某葡萄酒中 的含量时,取
的含量时,取 葡萄酒样品,消耗
葡萄酒样品,消耗 碘标准液
碘标准液 。样品中
。样品中 的含量为
的含量为___________  。
。
 )为原料生产
)为原料生产 和
和 。
。
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)若要增大煅烧过程的反应速率,应采取的措施是
(3)煅烧时主要反应的化学方程式为
(4)“氧化”时,反应的化学方程式为
(5)
 可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中
可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中 的含量。请配平其反应的化学方程式:
的含量。请配平其反应的化学方程式:______
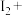 _______
_______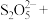 _______
_______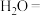 ________
________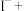 ______
______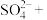 ___________
___________
若要检验
 是否变质生成了
是否变质生成了 ,所用的试剂是
,所用的试剂是(6)在测定某葡萄酒中
 的含量时,取
的含量时,取 葡萄酒样品,消耗
葡萄酒样品,消耗 碘标准液
碘标准液 。样品中
。样品中 的含量为
的含量为 。
。
您最近一年使用:0次
名校
3 . 高锰酸钾为紫黑色、细长的棱形结晶或颗粒,是一种强氧化剂,可溶于水,常用作消毒剂、水净化剂、氧化剂、漂白剂、毒气吸收剂等。
Ⅰ.制备KMnO4
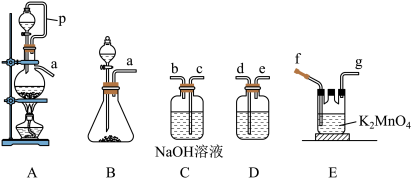
(1)若实验室选用A装置制备Cl2,导管P的作用为_______ 。
(2)若实验室选用B装置制备氯气,当锥形瓶中放置的药品为漂粉精,则对应的化学反应方程式为_______ 。
(3)用氯气氧化K2MnO4制备KMnO4,则其接口顺序为a→_______ (按气流方向从左到右,用小写字母表示)。
(4)工业上采用惰性电极隔膜法电解,可制得KMnO4.装置如图:
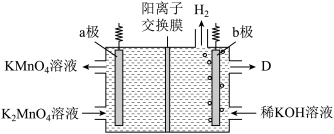
写出电解总反应的化学方程式:_______ 。
Ⅱ.测定KMnO4产品的纯度
称取2.400 0 g样品溶于水,加入硫酸酸化后配成100.00 mL溶液,用移液管取20.00 mL置于锥形瓶中,用0.500 0 mol·L-1标准(NH4)2Fe(SO4)2溶液进行滴定。
(5)滴定终点的现象是_______ 。
(6)数据处理。将三次实验消耗(NH4)2Fe(SO4)2溶液体积取平均值为30.00 mL。计算该KMnO4产品的质量分数为_______ %(保留小数点后两位)。
(7)进一步分析发现,测定结果偏高,其原因可能是_______(填标号)。
Ⅰ.制备KMnO4

(1)若实验室选用A装置制备Cl2,导管P的作用为
(2)若实验室选用B装置制备氯气,当锥形瓶中放置的药品为漂粉精,则对应的化学反应方程式为
(3)用氯气氧化K2MnO4制备KMnO4,则其接口顺序为a→
(4)工业上采用惰性电极隔膜法电解,可制得KMnO4.装置如图:

写出电解总反应的化学方程式:
Ⅱ.测定KMnO4产品的纯度
称取2.400 0 g样品溶于水,加入硫酸酸化后配成100.00 mL溶液,用移液管取20.00 mL置于锥形瓶中,用0.500 0 mol·L-1标准(NH4)2Fe(SO4)2溶液进行滴定。
(5)滴定终点的现象是
(6)数据处理。将三次实验消耗(NH4)2Fe(SO4)2溶液体积取平均值为30.00 mL。计算该KMnO4产品的质量分数为
(7)进一步分析发现,测定结果偏高,其原因可能是_______(填标号)。
| A.洗涤后,锥形瓶未干燥直接加入待测的KMnO4溶液 |
| B.装液前,滴定管水洗后没有用标准液润洗 |
| C.滴定前仰视读数,滴定后俯视读数 |
| D.标准(NH4)2Fe(SO4)2溶液部分氧化变质 |
您最近一年使用:0次
2022-09-30更新
|
404次组卷
|
4卷引用:河南省顶级名校2022-2023学年高三上学期第一次月考化学试题
河南省顶级名校2022-2023学年高三上学期第一次月考化学试题河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期10月月考化学试题湖南省长沙市第一中学2022-2023学年高三上学期月考(一)化学试题(已下线)回归教材重难点11 熟记“五气体”制备实验、“两定量”测定实验-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)
名校
解题方法
4 . 以白云石(化学式表示为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:
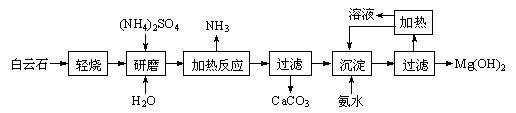
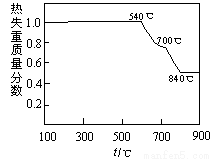
已知:①白云石加热过程中,固体失重百分比与温度的关系如下图所示:
② Ksp[Mg(OH)2]=5.61×10-12。
(1)根据流程图判断白云石“轻烧”后固体产物的主要成份_____ (填化学式)。结合上图判断“轻烧”温度应不超过 _____ 。
(2)“加热反应”的化学方程式为_________________________ 。
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)=_______ (已知)。
(4)该工艺中可以循环使用的物质是________ (填化学式)。
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,从环境保护的用度分析,该工艺采用轻烧白云石 的方法,其优点是__________________________ 。

已知:①白云石加热过程中,固体失重百分比与温度的关系如下图所示:

② Ksp[Mg(OH)2]=5.61×10-12。
(1)根据流程图判断白云石“轻烧”后固体产物的主要成份
(2)“加热反应”的化学方程式为
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)=
(4)该工艺中可以循环使用的物质是
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,从环境保护的用度分析,该工艺采用轻烧白云石 的方法,其优点是
您最近一年使用:0次
2017-10-13更新
|
225次组卷
|
2卷引用:江苏省苏州市2018届高三期初调研化学试题
解题方法
5 . 【化学---选修2:化学与技术】
MnO2和锌是制造干电池的主要原料。
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解。
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌。简化流程框图如下(中间产物的固体部分已经略去):
软锰矿、闪锌矿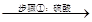 滤液A
滤液A Zn2+、Mn2+、Fe2+、Al3+
Zn2+、Mn2+、Fe2+、Al3+
ZnSO4、MnSO4溶液 Zn+MnO2+产品D
Zn+MnO2+产品D
已知各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:__________________________、_____________________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为___________(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是___
____________________,另外一种固体物质可为___________。
(4)步骤④中电解过程中MnO2在______极析出,该电极上发生的反应方程式为________________。产品D的化学式为_________________,该物质对整个生产的意义是___________________________。
MnO2和锌是制造干电池的主要原料。
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解。
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌。简化流程框图如下(中间产物的固体部分已经略去):
软锰矿、闪锌矿
 滤液A
滤液A Zn2+、Mn2+、Fe2+、Al3+
Zn2+、Mn2+、Fe2+、Al3+
ZnSO4、MnSO4溶液
 Zn+MnO2+产品D
Zn+MnO2+产品D已知各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:__________________________、_____________________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为___________(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是___
____________________,另外一种固体物质可为___________。
(4)步骤④中电解过程中MnO2在______极析出,该电极上发生的反应方程式为________________。产品D的化学式为_________________,该物质对整个生产的意义是___________________________。
您最近一年使用:0次
解题方法
6 . 有一Na2SO3固体因部分被氧化而变质。为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:
甲同学:称取mg样品溶于水,加入过量的BaCl2溶液。过滤,向沉淀中加入过量盐酸,再过滤,将残留固体洗涤后进行烘干,冷却后称得质量为m1g。
(1)BaCl2溶液必须过量的原因是_______ 。在滤液中滴加_______ 溶液,若没有白色沉淀生成,则证明BaCl2溶液不足,还需继续在滤液中加入BaCl2溶液后进行过滤。
(2)洗涤残留固体的方法是_______ ;在洗出液中滴加_______ 溶液,可以判断残留固体是否洗涤干净。
乙同学:称取mg样品溶于水,配成溶液,用滴定管取VmL于锥形瓶中,用浓度为cmol/L的标准酸性高锰酸钾溶液滴定至终点。反应关系为:SO +MnO
+MnO SO
SO +Mn2+(未配平)
+Mn2+(未配平)
(3)配制样品溶液时,不一定 需要的实验仪器是_______(选填答案编号)。
(4)滴定终点的判断依据是_______ 。
(5)上述滴定中,滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用_______ 。滴定管液面变化如图所示,从图Ⅰ图Ⅱ显示消耗的高锰酸钾溶液体积为_______ 。

甲同学:称取mg样品溶于水,加入过量的BaCl2溶液。过滤,向沉淀中加入过量盐酸,再过滤,将残留固体洗涤后进行烘干,冷却后称得质量为m1g。
(1)BaCl2溶液必须过量的原因是
(2)洗涤残留固体的方法是
乙同学:称取mg样品溶于水,配成溶液,用滴定管取VmL于锥形瓶中,用浓度为cmol/L的标准酸性高锰酸钾溶液滴定至终点。反应关系为:SO
 +MnO
+MnO SO
SO +Mn2+(未配平)
+Mn2+(未配平)(3)配制样品溶液时,
| A.容量瓶 | B.玻璃棒 | C.滴定管 | D.烧杯 |
(5)上述滴定中,滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用

您最近一年使用:0次
名校
7 . 乳酸亚铁晶体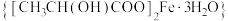 (相对分子质量:288),可由乳酸与
(相对分子质量:288),可由乳酸与 反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
Ⅰ.制备碳酸亚铁:装置如图所示。
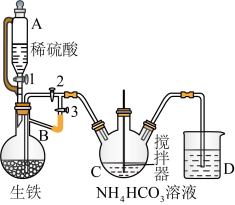
(1)仪器C的名称是_______ 。
(2)该实验使用生铁比纯铁更好,原因为_______ 。
(3)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是_______ ,然后关闭活塞1,打开活塞2,关闭活塞3,此后,C装置溶液中有沉淀生成,并有大量气泡冒出,则C中发生反应的离子方程式为_______ 。
Ⅱ.制备乳酸亚铁。
(4)向纯净的 固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式
固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式_______ 。为防止乳酸亚铁变质,在上述体系中还应加入适量_______ 。反应结束后,将所得溶液隔绝空气低温浓缩、降温结晶、过滤、洗涤、干燥,得乳酸亚铁晶体。
Ⅲ.乳酸亚铁晶体纯度的测量。
(5)某同学查阅文献后,用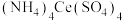 滴定法测定样品中
滴定法测定样品中 的含量并计算样品纯度(反应中
的含量并计算样品纯度(反应中 还原为
还原为 ),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的
),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的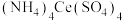 标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为
标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为_______ (保留三位有效数字,以质量分数表示)。
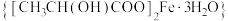 (相对分子质量:288),可由乳酸与
(相对分子质量:288),可由乳酸与 反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。Ⅰ.制备碳酸亚铁:装置如图所示。

(1)仪器C的名称是
(2)该实验使用生铁比纯铁更好,原因为
(3)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是
Ⅱ.制备乳酸亚铁。
(4)向纯净的
 固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式
固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式Ⅲ.乳酸亚铁晶体纯度的测量。
(5)某同学查阅文献后,用
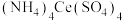 滴定法测定样品中
滴定法测定样品中 的含量并计算样品纯度(反应中
的含量并计算样品纯度(反应中 还原为
还原为 ),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的
),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的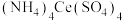 标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为
标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为
您最近一年使用:0次
2022-12-07更新
|
105次组卷
|
2卷引用:河北省衡水市冀州区第一中学2020-2021学年高三上学期期末考试化学试题
解题方法
8 . 下列设计的实验方案能达到相应实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明反应速率会随反应物浓度的增大而加快 | 用3 mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1 mL 1 mol/L  溶液迅速产生较多气泡 溶液迅速产生较多气泡 |
| B | 检验 晶体是否已氧化变质 晶体是否已氧化变质 | 将 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 |
| C | 证明“84消毒液”的氧化能力随溶液pH的减小而增强 | 将“84消毒液"(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| D | 证明氯化银的溶解度大于硫化银的溶解度 | 向2 mL 0.1 mol/L硝酸银溶液中加入1mL 0.1 mol/L NaCl溶液,出现白色沉淀,再加入几滴0.1 molL的 溶液,有黑色沉淀生成 溶液,有黑色沉淀生成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 根据下列实验目的、操作及现象所得结论正确的是
| 选项 | 实验目的 | 操作及现象 | 结论 |
| A | 比较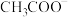 和 和 的水解常数 的水解常数 | 分别测定浓度均为 的 的 和 和 溶液的 溶液的 ,后者大于前者 ,后者大于前者 | 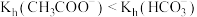 |
| B | 比较 的氧化性 的氧化性 | 向 、 、 混合溶液中依次加入少量氯水和 混合溶液中依次加入少量氯水和 ,振荡、静置,溶液分层、下层为紫红色 ,振荡、静置,溶液分层、下层为紫红色 | 氧化性: |
| C | 探究 固体样品是否变质 固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量 溶液,有白色沉淀产生 溶液,有白色沉淀产生 | 样品已经变质 |
| D | 探究补铁剂中铁元素的化合价 | 将补铁剂溶于稀硫酸,滴入酸性 溶液,酸性 溶液,酸性 溶液紫红色褪去 溶液紫红色褪去 | 此补铁剂中铁元素只有 价 价 |
| A.A | B.B | C.C. | D.D |
您最近一年使用:0次
2022-11-09更新
|
280次组卷
|
3卷引用:山东省潍坊市2022-2023学年高三上学期期中考试化学考试题
10 . [CH3CH(OH)COO]2Fe(乳酸亚铁)是一种广泛应用于食品的铁强化剂,可由乳酸与FeCO3反应制得。兴趣小组在实验室按下列步骤制备乳酸亚铁晶体并进行含量测定。回答下列问题:
I.制备FeCO3:
兴趣小组利用FeSO4(用废铁屑和稀硫酸反应制得)和NH4HCO3在如图装置制备FeCO3:

(1)植物油的作用_______ 。
(2)实验过程中,将生成的FeSO4溶液和NH4HCO3溶液混合的操作是_______ 。
(3)经过滤、洗涤得到FeCO3,久置后,发现在盛有FeCO3试剂瓶的瓶口有红褐色物质,其原因是_______ (用化学方程式解释)。
Ⅱ.制备乳酸亚铁:
(4)兴趣小组向FeCO3固体中加入乳酸溶液,在一定条件下搅拌使之充分反应,并测得反应溶液的pH、温度对乳酸亚铁产率的影响如图所示,

①溶液pH控制在5~6之间乳酸亚铁产率较高的主要原因是_______ 。
②在最适宜的条件下,该反应的化学方程式为:_______
为防止乳酸亚铁变质,在上述体系中还应加入适量铁粉。反应结束后,将所得溶液隔绝空气低温蒸发,_______ (一系列操作)得到乳酸亚铁晶体。该晶体存放时应注意_______ 。
Ⅲ.测定乳酸亚铁的纯度:
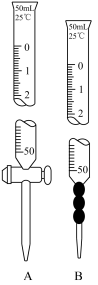
(5)兴趣小组通过用硫酸铈铵(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量来计算乳酸亚铁固体样品纯度(反应中Ce元素被还原为Ce3+)。称取2.5g样品配制成100.00mL溶液,取该溶液25.00mL,将0.1000mol/L(NH4)4Ce(SO4)4标准溶液装入_______ 中(填A或B),反复滴定2~3次,平均消耗(NH4)4Ce(SO4)4标准溶液25.00mL,则样品中乳酸亚铁的纯度为_______ 。
I.制备FeCO3:
兴趣小组利用FeSO4(用废铁屑和稀硫酸反应制得)和NH4HCO3在如图装置制备FeCO3:

(1)植物油的作用
(2)实验过程中,将生成的FeSO4溶液和NH4HCO3溶液混合的操作是
(3)经过滤、洗涤得到FeCO3,久置后,发现在盛有FeCO3试剂瓶的瓶口有红褐色物质,其原因是
Ⅱ.制备乳酸亚铁:
(4)兴趣小组向FeCO3固体中加入乳酸溶液,在一定条件下搅拌使之充分反应,并测得反应溶液的pH、温度对乳酸亚铁产率的影响如图所示,

①溶液pH控制在5~6之间乳酸亚铁产率较高的主要原因是
②在最适宜的条件下,该反应的化学方程式为:
为防止乳酸亚铁变质,在上述体系中还应加入适量铁粉。反应结束后,将所得溶液隔绝空气低温蒸发,
Ⅲ.测定乳酸亚铁的纯度:
(5)兴趣小组通过用硫酸铈铵(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量来计算乳酸亚铁固体样品纯度(反应中Ce元素被还原为Ce3+)。称取2.5g样品配制成100.00mL溶液,取该溶液25.00mL,将0.1000mol/L(NH4)4Ce(SO4)4标准溶液装入

您最近一年使用:0次
2022-08-24更新
|
226次组卷
|
3卷引用:湖南省邵阳市第二中学2022届高三下学期全真模拟考试化学试题



