解题方法
1 . 甘氨酸亚铁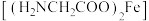 是一种补血剂,工业上用赤铁矿
是一种补血剂,工业上用赤铁矿 (含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
(含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:

已知:甘氨酸(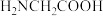 ),易溶于水,微溶于乙醇,具有两性。滤渣1成份为
),易溶于水,微溶于乙醇,具有两性。滤渣1成份为 。
。
回答下列问题:
(1)“碱浸”去除的元素是___________ 。(填化学式)
(2)“还原”时的还原产物是___________ 。(填化学式)
(3)“沉淀”的离子方程式___________ ,“副产品”是___________ (写名称)
(4)柠檬酸的作用防止 氧化,“反应”的化学方程式为
氧化,“反应”的化学方程式为___________ 。
(5) 是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是
是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是______ 。
(6)某同学通过如下实验测定该补血剂中 的含量:
的含量:
①配制:用分析天平称取
 样品,再用煮沸并冷却的蒸馏水配制
样品,再用煮沸并冷却的蒸馏水配制 溶液。配制时还需要的定量仪器是
溶液。配制时还需要的定量仪器是___________ 。
②滴定:用酸化的 溶液滴定用
溶液滴定用
移液管移取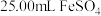 溶液于锥形瓶中,用
溶液于锥形瓶中,用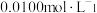 的
的 ,溶液滴定,平行滴定3次,
,溶液滴定,平行滴定3次, 溶液的平均用量为
溶液的平均用量为 ,则样品
,则样品 的质量分数为
的质量分数为___________ 。
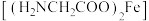 是一种补血剂,工业上用赤铁矿
是一种补血剂,工业上用赤铁矿 (含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
(含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
已知:甘氨酸(
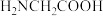 ),易溶于水,微溶于乙醇,具有两性。滤渣1成份为
),易溶于水,微溶于乙醇,具有两性。滤渣1成份为 。
。回答下列问题:
(1)“碱浸”去除的元素是
(2)“还原”时的还原产物是
(3)“沉淀”的离子方程式
(4)柠檬酸的作用防止
 氧化,“反应”的化学方程式为
氧化,“反应”的化学方程式为(5)
 是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是
是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是(6)某同学通过如下实验测定该补血剂中
 的含量:
的含量:①配制:用分析天平称取

 样品,再用煮沸并冷却的蒸馏水配制
样品,再用煮沸并冷却的蒸馏水配制 溶液。配制时还需要的定量仪器是
溶液。配制时还需要的定量仪器是②滴定:用酸化的
 溶液滴定用
溶液滴定用移液管移取
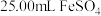 溶液于锥形瓶中,用
溶液于锥形瓶中,用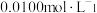 的
的 ,溶液滴定,平行滴定3次,
,溶液滴定,平行滴定3次, 溶液的平均用量为
溶液的平均用量为 ,则样品
,则样品 的质量分数为
的质量分数为
您最近一年使用:0次
名校
2 . 草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
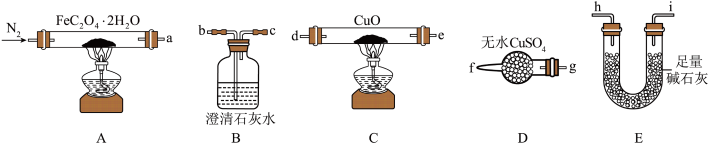
(1)气体产物成分的探究。小组成员采用如图装置进行实验:_______ →尾气处理装置(仪器可重复使用)。
②检查装置气密性后,先通入一段时间N2,其目的为_______ 。
③实验证明了气体产物中含有CO,依据的实验现象为_______ 。
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是_______ 。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为_______ 。
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的实验现象为_______ 。
II.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL(已知: )。
)。
(4)步骤2中还涉及的离子方程式_______ ;步骤3中加入锌粉的目的_______ 。
(5)草酸亚铁样品的纯度为_______ (列出计算式即可);若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将_______ (填“偏高”、“偏低”或“不变”)。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如图装置进行实验:
②检查装置气密性后,先通入一段时间N2,其目的为
③实验证明了气体产物中含有CO,依据的实验现象为
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的实验现象为
II.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL(已知:
 )。
)。(4)步骤2中还涉及的离子方程式
(5)草酸亚铁样品的纯度为
您最近一年使用:0次
3 . 高铁酸钾(K2FeO4)是一种新型高效的水处理剂,在碱性溶液中较稳定。工业上有干法与湿法两种制备高铁酸钾的方法。(已知:Fe3++3H2O⇌Fe(OH)3+3H+)
(1)高铁酸钾可用于杀菌消毒,是因为它具有强___________ 性。
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为________ 。这种分散系区分于其他分散系的最本质区别是_________ 。
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______ +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。
①完成上述离子方程式:___________ 。
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为___________ 。(计算结果保留到0.1%)
湿法制备高铁酸钾的流程如下图。
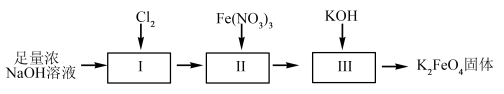
(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。___________ ,反应每生成1molCl-转移的电子数目为___________ 。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

(1)高铁酸钾可用于杀菌消毒,是因为它具有强
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______
 +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。①完成上述离子方程式:
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为
湿法制备高铁酸钾的流程如下图。

(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

| A.24℃,75g∙L-1 | B.26℃,75g∙L-1 | C.28℃,75g∙L-1 | D.22℃,80g∙L-1 |
您最近一年使用:0次
名校
解题方法
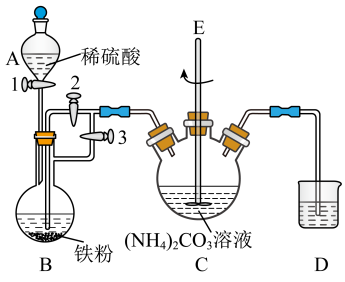
4 . 碳酸亚铁( )是一种重要的工业盐,是制备医用补铁剂的原料。常温下它是一种白色、难溶于水的晶体。在干燥的环境中性质稳定,在潮湿的空气中,易被
)是一种重要的工业盐,是制备医用补铁剂的原料。常温下它是一种白色、难溶于水的晶体。在干燥的环境中性质稳定,在潮湿的空气中,易被 氧化,长期放置后最终转化为
氧化,长期放置后最终转化为 。实验小组通过查阅文献资料设计用下图装置制备少量
。实验小组通过查阅文献资料设计用下图装置制备少量 。
。
①连接装置检查气密性后,先将开关2关闭,然后依次打开开关3和1,将A中稀硫酸滴入B中。
②反应一段时间后,当D中气泡均匀冒出,关闭开关3,打开开关2.使装置B中的溶液进入装置C。
③当装置B中溶液不再进入C后,关闭开关1。
④充分反应后将装置C中生成的固体经过滤、洗涤、干燥。
回答下列问题:
(1)装置B中产生的气体是___________ (化学式),反应开始时持续通入该气体的目的是___________ 。
(2)装置D的作用___________ 。(选择:A.吸收尾气 B.防止空气进入装置影响产物)
(3)步骤④中证明固体洗涤干净的实验方案是___________ 。
II.因存放时间较长,装置密封性缺失导致 发生了变质,某同学设计如下方案对样品的质量百分含量进行测定:
发生了变质,某同学设计如下方案对样品的质量百分含量进行测定:
准确称取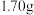 样品,用适量的稀硫酸使其完全溶解配成
样品,用适量的稀硫酸使其完全溶解配成 溶液。量取
溶液。量取 溶液于锥形瓶中,滴加适量磷酸,用
溶液于锥形瓶中,滴加适量磷酸,用 的
的 标准溶液滴定至终点,(离子方程式为:
标准溶液滴定至终点,(离子方程式为: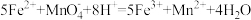 )消耗
)消耗 标准溶液
标准溶液 (重复实验2~3次)。
(重复实验2~3次)。
(4)计算样品中 的质量百分含量为
的质量百分含量为___________ %。(写出必要的计算过程,结果保留到小点数后一位)
 )是一种重要的工业盐,是制备医用补铁剂的原料。常温下它是一种白色、难溶于水的晶体。在干燥的环境中性质稳定,在潮湿的空气中,易被
)是一种重要的工业盐,是制备医用补铁剂的原料。常温下它是一种白色、难溶于水的晶体。在干燥的环境中性质稳定,在潮湿的空气中,易被 氧化,长期放置后最终转化为
氧化,长期放置后最终转化为 。实验小组通过查阅文献资料设计用下图装置制备少量
。实验小组通过查阅文献资料设计用下图装置制备少量 。
。
①连接装置检查气密性后,先将开关2关闭,然后依次打开开关3和1,将A中稀硫酸滴入B中。
②反应一段时间后,当D中气泡均匀冒出,关闭开关3,打开开关2.使装置B中的溶液进入装置C。
③当装置B中溶液不再进入C后,关闭开关1。
④充分反应后将装置C中生成的固体经过滤、洗涤、干燥。
回答下列问题:
(1)装置B中产生的气体是
(2)装置D的作用
(3)步骤④中证明固体洗涤干净的实验方案是
II.因存放时间较长,装置密封性缺失导致
 发生了变质,某同学设计如下方案对样品的质量百分含量进行测定:
发生了变质,某同学设计如下方案对样品的质量百分含量进行测定:准确称取
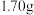 样品,用适量的稀硫酸使其完全溶解配成
样品,用适量的稀硫酸使其完全溶解配成 溶液。量取
溶液。量取 溶液于锥形瓶中,滴加适量磷酸,用
溶液于锥形瓶中,滴加适量磷酸,用 的
的 标准溶液滴定至终点,(离子方程式为:
标准溶液滴定至终点,(离子方程式为: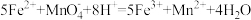 )消耗
)消耗 标准溶液
标准溶液 (重复实验2~3次)。
(重复实验2~3次)。(4)计算样品中
 的质量百分含量为
的质量百分含量为
您最近一年使用:0次
名校
解题方法
5 . 某“84”消毒液部分标签如下图所示、回答下列问题:
(1)写出 变质失效中属于氧化还原反应的方程式
变质失效中属于氧化还原反应的方程式_______ 。
(2)计算该“84”消毒液的物质的量浓度_______  (保留小数点后一位,下同)。
(保留小数点后一位,下同)。
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 )的浓硫酸配制1000
)的浓硫酸配制1000 0.50
0.50 的稀硫酸用于增强“84消毒液”的消毒能力。需用量筒量取浓硫酸的体积为
的稀硫酸用于增强“84消毒液”的消毒能力。需用量筒量取浓硫酸的体积为_______  。
。
(4)某实验用480 2.0
2.0
 的消毒液,现用
的消毒液,现用 固体配制。
固体配制。
a.要用托盘天平称量 的固体质量为
的固体质量为_______ g。
b.配制时。一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却。正确的操作顺序为:_______ (填序号)。在配制过程中,除需要烧杯、托盘天平外还必需的仪器有_______ (写两种)。
(5)下列操作可能使配制溶液浓度偏低的是_______ 。
A.移液时,未洗涤烧杯内壁和玻璃棒
B.溶解后未经冷却就移液
C.移液时,有少量液体溅出
D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
净含量:500 密度:1.19  主要成份:25%  ( ( 的摩尔质量74.5 的摩尔质量74.5 ) )注意事项:密封保存,易吸收空气中的  变质 变质 |
 变质失效中属于氧化还原反应的方程式
变质失效中属于氧化还原反应的方程式(2)计算该“84”消毒液的物质的量浓度
 (保留小数点后一位,下同)。
(保留小数点后一位,下同)。(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84
 )的浓硫酸配制1000
)的浓硫酸配制1000 0.50
0.50 的稀硫酸用于增强“84消毒液”的消毒能力。需用量筒量取浓硫酸的体积为
的稀硫酸用于增强“84消毒液”的消毒能力。需用量筒量取浓硫酸的体积为 。
。(4)某实验用480
 2.0
2.0
 的消毒液,现用
的消毒液,现用 固体配制。
固体配制。a.要用托盘天平称量
 的固体质量为
的固体质量为b.配制时。一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却。正确的操作顺序为:
(5)下列操作可能使配制溶液浓度偏低的是
A.移液时,未洗涤烧杯内壁和玻璃棒
B.溶解后未经冷却就移液
C.移液时,有少量液体溅出
D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
您最近一年使用:0次
名校
6 . 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑保存试剂的容器)
| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 配制100mL一定物质的量浓度的NaCl溶液 | 胶头滴管、烧杯、量筒、玻璃棒 | 蒸馏水NaCl固体 |
| B | 制备Fe(OH)3胶体 | 烧杯 | 饱和FeCl3溶液、NaOH溶液 |
| C | 探究Na2SO3样品是否变质 | 胶头滴管、试管 | 待测样品、蒸馏水、BaCl2溶液 |
| D | 检验钠在氧气中充分燃烧的产物 | 试管、酒精灯、胶头滴管 | 待测产物、蒸馏水、木条 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-10更新
|
303次组卷
|
2卷引用:山东省济南市2022-2023学年高一上学期期末考试化学试题
7 . I.含氯消毒剂、医用酒精、过氧化物等均能有效灭活病毒,为抗击新型冠状肺炎(COVID—19)作出了贡献。请回答下列问题:
(1)下列物质用作消毒剂时,原理与其它不同的是___ (填字母)。
(2)某兴趣小组欲探究过氧化钠样品是否变质,进行下列操作:取少量样品,溶解,加入___ 溶液(填化学式),振荡,有白色沉淀产生,证明Na2O2已变质。
(3)亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,可由ClO2与H2O2按一定比例混合后在NaOH溶液中反应制得。制备时ClO2与H2O2完全反应的物质的量理论比为___ 。
Ⅱ.某化学兴趣小组利用如图装置进行“铁粉与水蒸气反应”的实验,并检验产物的性质(部分夹持装置已略去),请回答下列问题:
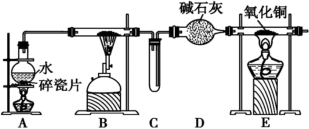
(4)A、B两个装置中应先点燃___ 处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是___ 。
(5)B装置硬质玻璃管中发生反应的化学方程式为___ 。
(6)D装置中盛放的碱石灰的作用是___ 。
(1)下列物质用作消毒剂时,原理与其它不同的是
| A.NaClO | B.O3 | C.医用酒精 | D.H2O2 |
(3)亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,可由ClO2与H2O2按一定比例混合后在NaOH溶液中反应制得。制备时ClO2与H2O2完全反应的物质的量理论比为
Ⅱ.某化学兴趣小组利用如图装置进行“铁粉与水蒸气反应”的实验,并检验产物的性质(部分夹持装置已略去),请回答下列问题:

(4)A、B两个装置中应先点燃
(5)B装置硬质玻璃管中发生反应的化学方程式为
(6)D装置中盛放的碱石灰的作用是
您最近一年使用:0次
8 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中的CO2和H2O而变质。某课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计如图装置来测定过氧化钠的质量分数。
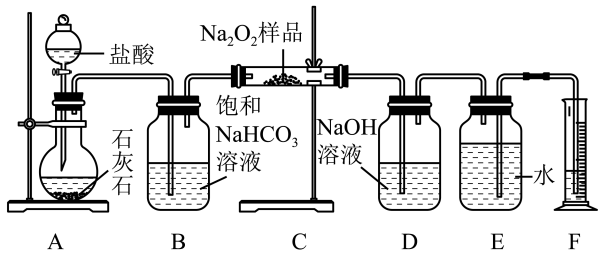
(1)将仪器连接好以后,第一步必须进行的操作是___________ 。
(2)写出装置C中发生反应的化学方程式:___________ 、___________ 。
(3)装置D中NaOH溶液的作用是___________ 。
(4)测量收集到的气体体积时必须包括三个步骤:
①使装置内的气体冷却至室温;
②___________ ;
③读取量筒中水的体积。
(5)装置C中Na2O2充分反应,读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中Na2O2的质量分数为___________ 。
(6)Na2O2可用来制备一种应用前景非常好的高效、多功能水处理剂Na2FeO4。化学方程式为 ,对此反应下列说法中正确的是___________(填字母)。
,对此反应下列说法中正确的是___________(填字母)。

(1)将仪器连接好以后,第一步必须进行的操作是
(2)写出装置C中发生反应的化学方程式:
(3)装置D中NaOH溶液的作用是
(4)测量收集到的气体体积时必须包括三个步骤:
①使装置内的气体冷却至室温;
②
③读取量筒中水的体积。
(5)装置C中Na2O2充分反应,读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中Na2O2的质量分数为
(6)Na2O2可用来制备一种应用前景非常好的高效、多功能水处理剂Na2FeO4。化学方程式为
 ,对此反应下列说法中正确的是___________(填字母)。
,对此反应下列说法中正确的是___________(填字母)。| A.Na2O2只作氧化剂 | B.O2是还原产物 |
| C.Na2FeO4既是氧化产物又是还原产物 | D.2 mol FeSO4发生反应时,共有10 mol电子发生转移 |
您最近一年使用:0次
名校
解题方法
9 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_______ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用如图装置来测定过氧化钠的质量分数。
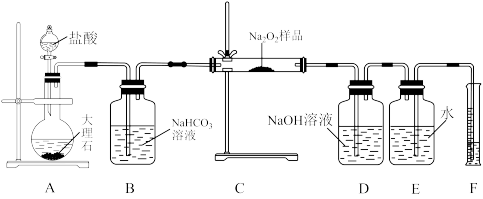
①将仪器连接好以后,必须进行的第一步操作是_______ 。
②B装置出来的气体是否需要干燥_______ (填“是”或“否”)。写出装置B中发生反应的化学方程式_______ 。
③D中NaOH溶液的作用_______ 。
④实验结束时,读取实验中生成气体的体积时,不合理的是_______ 。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为_______ 。
⑥实验完成后E到F之间导管内残留水的体积会使测量结果_______ (填“偏大”“偏小”或“不影响”)。
(3)取a g C2H6O2某物质在氧气中完全燃烧,将其产物跟足量的Na2O2固体完全反应,反应后固体的质量增加_______ (填大于、等于或者小于)a g。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用如图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步操作是
②B装置出来的气体是否需要干燥
③D中NaOH溶液的作用
④实验结束时,读取实验中生成气体的体积时,不合理的是
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为
⑥实验完成后E到F之间导管内残留水的体积会使测量结果
(3)取a g C2H6O2某物质在氧气中完全燃烧,将其产物跟足量的Na2O2固体完全反应,反应后固体的质量增加
您最近一年使用:0次
2021-10-23更新
|
80次组卷
|
3卷引用:山东省潍坊第四中学2021-2022学年高一上学期第一次阶段性考试化学试题
名校
10 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠经常因为保存不当容易吸收空气中CO2而变质。
I.某课外小组欲用如图装置探究过氧化钠与CO2反应后的产物。已知:碳酸氢钠受热易分解。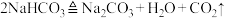 ,试回答下列问题:
,试回答下列问题:

(1)B装置的作用是________ 。
(2)观察到的实验现象:双球干燥管内淡黄色粉末逐渐转弯为白色,点燃的蚊香燃烧更加剧烈。请根据实验现象写出C装置的化学方程式:____ ,该反应中氧化剂和还原剂的质量比为_______ ;若2分子CO2通过C装置后恰好完全反应,这过程转移____ 个电子。
II.该课外小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_________ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
III.超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,写出该反应的化学方程式_______ 。
I.某课外小组欲用如图装置探究过氧化钠与CO2反应后的产物。已知:碳酸氢钠受热易分解。
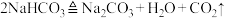 ,试回答下列问题:
,试回答下列问题:
(1)B装置的作用是
(2)观察到的实验现象:双球干燥管内淡黄色粉末逐渐转弯为白色,点燃的蚊香燃烧更加剧烈。请根据实验现象写出C装置的化学方程式:
II.该课外小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
III.超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,写出该反应的化学方程式
您最近一年使用:0次



