1 . 碘酸钙[ ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:
Ⅰ.将一定质量的 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL  、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用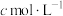 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)
(1)仪器a的名称为___________ ,b中应盛放的最佳传热介质是___________ 。
(2)步骤Ⅰ中反应生成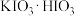 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:___________ 。反应过程中,在烧瓶瓶颈或仪器a下口处可能会看到___________ (填物质名称)析出,其原因是___________ 。
(3)步骤Ⅱ“一系列操作”包括静置、___________ 、洗涤、干燥,其中洗涤所用较佳试剂为___________ (填“水”或“乙醇”)。
(4)碘酸钙粗晶纯度为___________ %(用含a、c、V的代数式表示),下列情况导致产品纯度测定结果偏低的是___________ (填字母)。
A.所配待测溶液中含有 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数
C.盛放 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
 ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:Ⅰ.将一定质量的
 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1
 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL
 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL  、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用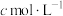 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)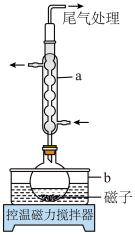
(1)仪器a的名称为
(2)步骤Ⅰ中反应生成
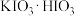 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:(3)步骤Ⅱ“一系列操作”包括静置、
(4)碘酸钙粗晶纯度为
A.所配待测溶液中含有
 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数C.盛放
 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
您最近一年使用:0次
昨日更新
|
168次组卷
|
2卷引用:2024届九师联盟高三下学期四月月考化学试卷
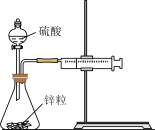
2 . 用下列装置制取和收集气体正确的是(不考虑除杂和尾气吸收)
| 选项 | 制取气体 | a | b |
|
| A |  | 稀硫酸 | 大理石 | |
| B |  | 稀硝酸 | 铜粉 | |
| C |  | 浓硝酸 | 铝片 | |
| D |  | 双氧水 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
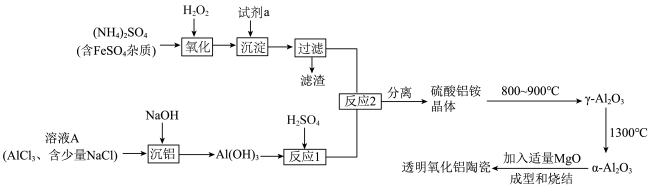
3 . 透明氧化铝陶瓷被认为是最具潜力的材料之一,制备透明氧化铝陶瓷的一种方法的流程如图所示:
(1)试剂a应选用___________ (填名称), 的电子式为
的电子式为___________ 。
(2)“反应1”的离子方程式为___________ 。
(3)检验上述流程中“过滤”后杂质已除尽的方法是___________ 。
(4)“沉铝”时,欲使 恰好完全转化为
恰好完全转化为 沉淀,应控制pH的范围是
沉淀,应控制pH的范围是___________ {已知:溶液中 、
、 浓度小于
浓度小于 认为
认为 沉淀完全,
沉淀完全,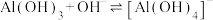 ,
,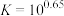 ,
,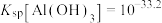 }。
}。
(5)硫酸铝铵晶体[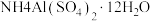 ]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的
]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的 溶液,沉淀质量最大时,反应的总离子方程式为
溶液,沉淀质量最大时,反应的总离子方程式为___________ 。
(6)硫酸铝铵晶体加热到800~900℃得到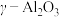 ,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为
,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为___________ 。___________ 特性;用它制造刚玉球磨机,是利用它的___________ 特性。
(1)试剂a应选用
 的电子式为
的电子式为(2)“反应1”的离子方程式为
(3)检验上述流程中“过滤”后杂质已除尽的方法是
(4)“沉铝”时,欲使
 恰好完全转化为
恰好完全转化为 沉淀,应控制pH的范围是
沉淀,应控制pH的范围是 、
、 浓度小于
浓度小于 认为
认为 沉淀完全,
沉淀完全,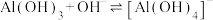 ,
,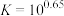 ,
,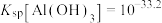 }。
}。(5)硫酸铝铵晶体[
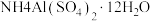 ]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的
]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的 溶液,沉淀质量最大时,反应的总离子方程式为
溶液,沉淀质量最大时,反应的总离子方程式为(6)硫酸铝铵晶体加热到800~900℃得到
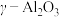 ,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为
,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为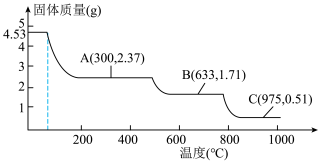
您最近一年使用:0次
2024-05-12更新
|
146次组卷
|
2卷引用:2024届九师联盟高三下学期四月月考化学试卷
4 . 对下列实验现象或操作解释正确的是
| 选项 | 现象或操作 | 解释 |
| A | 淀粉-KI溶液中滴入氯水变蓝,再通入 ,蓝色褪去 ,蓝色褪去 |  具有漂白性 具有漂白性 |
| B | 配制 溶液时,先将 溶液时,先将 溶于适量盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的锡粒 溶于适量盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的锡粒 | 抑制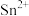 水解,并防止 水解,并防止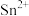 被氧化为 被氧化为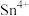 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有 |
| D | 向钾盐固体中滴加浓盐酸,将产生的气体通入品红溶液,品红溶液褪色 | 钾盐为亚硫酸钾 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-12更新
|
291次组卷
|
2卷引用:2024届九师联盟高三下学期四月月考化学试卷
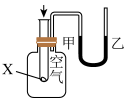
5 . 亚硝酰氯(NOCl)是重要的有机合成试剂,可由NO与Cl2在常温下合成。NOCl可与氧气反应,易水解生成一种氧化物和氯化氢,已知各物质的沸点:NOCl为-5.5℃,Cl2为-34℃,NO为-152℃,某学习小组在实验室利用如图装置制备亚硝酰氯。
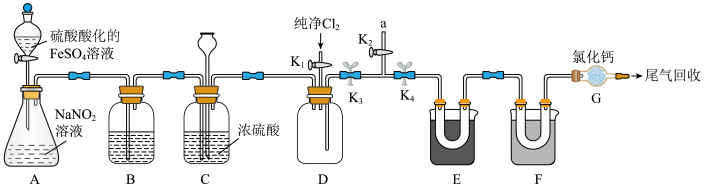
回答下列问题:
(1)A装置的作用是制取NO,反应的离子方程式为
(2)实验时利用装置B除去某些杂质气体并通过观察B中的气泡来判断反应速率,则装置B中所盛试剂为
(3)C中长颈漏斗的作用是
(4)实验室用二氧化锰和浓盐酸制取Cl2的反应中氧化剂和还原剂的比例为
(5)实验开始时,先关闭K3,打开K2、K4,从a处通一段时间氩气将E、F装置中的空气排尽,然后在a处接废气处理装置,关闭K1、K4,打开K3,再打开分液漏斗的活塞,滴加酸性FeSO4溶液,当观察到D中
(6)为收集产物和分离未反应的两种原料,E、F装置采用不同温度的低温浴槽,其中装置E的温度T区间应控制在
您最近一年使用:0次
6 . 高铁酸钾(K2FeO4)有强氧化性,是一种环保、高效、多功能饮用水处理剂,受热易分解,酸性环境中易变质。制备流程如图所示:
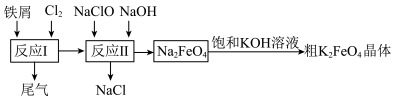
回答下列问题:
(1)K2FeO4中铁的化合价为
(2)铁屑需事先用Na2CO3溶液洗涤,目的是
(3)反应II的离子方程式为
(4)K2FeO4处理饮用水的原理是
(5)反应II中过量NaOH除了作为反应物外还有什么作用
(6)已知K2FeO4难溶于乙醇,可溶于水,故洗涤K2FeO4晶体时,先使用冷水洗涤,再使用乙醇洗涤,简述用乙醇洗涤K2FeO4晶体的操作
(7)检测产品纯度的原理如图所示:
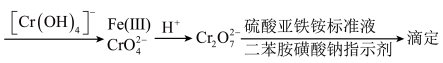
具体步骤:准确称取1.980g高铁酸钾粗品配成100.0mL溶液,取10.00mL该待测液于锥形瓶中,加入浓碱性溶液和过量的三价铬盐;再加稀硫酸和指示剂二苯胺磺酸钠,用0.1000mol/L的(NH4)2Fe(SO4)2标准液滴定至终点,重复以上步骤2~3次,平均消耗(NH4)2Fe(SO4)2溶液27.00mL(假设杂质不参与反应),则该粗品中高铁酸钾的质量分数为
您最近一年使用:0次
名校
解题方法
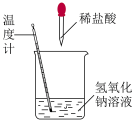
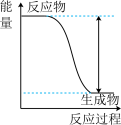
7 . 下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
|
|
|
|
| A.温度计的水银柱不断上升 | B.反应物总能量大于生成物总能量 | C.反应开始后,甲处液面低于乙处液面 | D.反应开始后,针筒活塞向右移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-27更新
|
196次组卷
|
113卷引用:高二人教版选修4 第一章 第一节 化学反应与能量的变化
高二人教版选修4 第一章 第一节 化学反应与能量的变化【全国百强校】甘肃省兰州市第一中学2018-2019学年高一下学期3月月考化学试题河北省秦皇岛市第一中学2018-2019学年高二第一学期第一次月考化学试题河北省唐山市第一中学2019-2020学年高一下学期第二次月考化学试题山西省晋中市平遥中学2019-2020高一下学期在线学习质量检测化学试题浙江省杭州市塘栖中学2019-2020学年高二下学期3月阶段性检测-化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第四次综合测试化学试题河北省邯郸市大名县第一中学2020-2021学年高二上学期9月月考化学试题江西省南昌市新建区第一中学2020-2021学年高二上学期第二次月考化学试题湖北省石首市第一中学2020-2021学年高二上学期9月月考化学试题江苏省沭阳县修远中学2020-2021学年高二下学期第一次联考化学试题浙江省杭州市富阳区场口中学2020-2021学年高一下学期3月教学质量检测化学试题甘肃省兰州市第一中学2020-2021学年高一下学期4月月考化学试题河北省安平中学2019--2020学年下学期高一第二次质量检测考试化学试题江苏省镇江市丹阳高级中学2021-2022学年高二上学期10月大练化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第一次月考化学试题辽宁师范大学附属中学2021-2022学年高二上学期10月月考化学试题陕西省西安市临潼区铁路中学2021-2022学年高一下学期5月第二次月考化学试题甘肃省庆阳第六中学2022-2023学年高二上学期第一次月考化学试题重庆市西南大学附属中学校2022-2023学年高三上学期第二次月考化学试题浙江省杭州市四校2023-2024学年高二上学期10月联考化学试题湖南省南雅中学2023-2024学年高二上学期第一次月考化学试题山西省太原市第五中学校2023-2024学年高二上学期10月月考化学试题山西省大同市第一中学校2023-2024学年高二上学期10月月考化学试题河南省焦作市博爱县第一中学2023-2024学年高二上学期第一次半月考化学试题陕西省汉中市乡县第一中学2023-2024学年高二上学期10月月考化学试题(已下线)2011-2012学年北京市朝阳区高二下学期期末统一考试化学试卷2016-2017学年江西省奉新县第一中学高二下学期第一次月考化学试卷天津市红桥区2016-2017学年高一下学期期中考试化学试题【全国区级联考】北京市东城区2017-2018学年高二下学期期末考试化学试题北京市第一七一中学2018-2019学年高二上学期期中考试化学试题步步为赢 高一化学暑假作业:作业六 化学能与热能黑龙江省哈尔滨市第三中学校2018-2019学年高一下学期第二学段考试化学试题西藏林芝市第二中学2019-2020学年高二上学期第一次月考理综化学试题河北省张家口市第一中学西校区、万全中学2019-2020学年高二第一学期期初考试化学试题(已下线)2019年3月17日 《每日一题》 必修2 每周一测湖北省宜昌市第二中学(人文艺术高级中学)2019-2020学年高二上学期10月月考化学试题第一节 化学能与热能——A学习区 夯实基础(人教版必修2)课时1 化学反应与热能——A学习区 夯实基础(人教版(2019)第二册)专题2 化学反应与能量转化 易错疑难集训(二)——A学习区 夯实基础(苏教版必修2)山东省烟台市第二中学2019-2020学年高一下学期4月月考化学试题河北省邯郸市磁县第二中学2019-2020学年高一下学期期中考试化学试卷江西省抚州市南城县第二中学2019-2020学年高一下学期开学考试(自强班)化学试题山东省烟台市第三中学2019-2020学年高一下学期4月月考化学试题北京二中2019-2020学年高二下学期选修 IV模块考试化学试题广东省第二师范学院番禺附属中学2019-2020学年高一下学期期中段考化学试题(已下线)第09练 化学反应与能量的变化-2020年【衔接教材·暑假作业】新高二化学(人教版)黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二上学期开学考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1节 化学反应的热效应 课时1 化学反应的反应热必修第二册RJ第6章第一节 化学反应与能量变化 课时1鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第1节 化学反应的热效应 课时1 化学反应的反应热、内能变化与焓变浙江省东阳中学2020-2021学年高二上学期10月阶段考试化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 第一节 反应热 课时1 反应热 焓变江西省宜丰二中2021届高三上学期第一次月考化学试题人教版2019必修第二册 第六章 第一节综合拔高练(鲁科版2019)必修第二册 第2章 化学键 化学反应规律 综合检测卷江苏省扬州中学2020-2021学年高一下学期期中考试化学试题山西省柳林县2020--2021学年高一下学期期中考试化学试题(苏教版2019)必修第二册专题6 化学反应与能量变化 第二单元 化学反应中的热 课时1 化学反应中的能量变化(已下线)作业01 反应热-2021年高二化学暑假作业(人教版2019)新疆塔什库尔干塔吉克自治县深塔中学2020-2021学年高二下学期期末考试化学试题选择性必修1(SJ)专题1第一单元课时1 化学反应的熔变选择性必修1专题1第一单元 课时1 化学反应的焓变重庆市第七中学校2020-2021学年高一下学期半期考试化学试题(已下线)第1章 化学反应与能量(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(B班)化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(A班)化学试题广东省佛山市南海区桂城中学2021-2022学年高二上学期第一次月考化学试题江苏省宿迁市沭阳县2021-2022学年高二上学期期中调研测试化学试题(已下线)1.1.1 反应热 焓变(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)四川省西昌市2020-2021学年高一下学期期中检测化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021-2022学年高一下学期第一次线上测试化学试题安徽省蚌埠第三中学2021-2022学年高一下学期4月阶段测试化学试题四川省宜宾市叙州区第一中学校2021-2022学年高一下学期期中考试化学试题广东省揭阳华侨高级中学2021-2022学年高二上学期第一次阶段考试化学试题第一章 化学反应的热效应(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)广西柳州市第三中学2022-2023学年高二上学期10月月考化学试题新疆乌鲁木齐市第八中学2022-2023学年高二上学期期中考试化学试题广东省深圳实验学校高中部2022-2023学年高二上学期第一阶段考试化学试题河北省卢龙县第二高级中学2021-2022学年高二上学期期中考试化学试题江苏省宿迁市北大附属宿迁实验学校2022-2023学年高二上学期11月期中化学试题1.1.1化学反应的焓变 课后河南省驻马店高级中学2023-2024学年高二上学期期中考试化学试题新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高二上学期第二次月考试化学试卷安徽省安庆市岳西中学2023-2024学年高二上学期9月月考化学试题浙江省杭州东方中学2023-2024学年高二上学期期中考试化学试题广东省汕头市潮南区龙岭中英文学校2023-2024学年高二上学期10月月考化学试题新疆阿克苏市实验中学2023-2024学年高二上学期第一次月考化学试题河北省石家庄市第二中学2023-2024学年高一下学期期中考试化学试题2016-2017学年福建省龙岩四校高二上学期期中联考化学试卷吉林省辽源市第五中学2016-2017学年高二下学期期末考试化学试题福建省清流一中2017-2018学年高二上学期第二阶段(期中)考试化学(理)试题【全国百强校】贵州省思南中学2017-2018学年高一下学期期中考试化学试题【全国百强校】吉林省延边第二中学2018-2019学年高一下学期期中考试化学试题浙江省金华市方格外国语学校2019-2020学年高二上学期期中考试化学试题广东省深圳市新安中学2019-2020学年高二上学期期中考试化学试题福建省莆田第二十四中学2019-2020学年高一化学下学期期中测试卷甘肃省张掖市高台县第一中学2019-2020学年高一下学期期中考试化学试题黑龙江省齐齐哈尔市实验中学2019-2020 学年高一下学期期中考试化学试题福建省三明市三地三校2020-2021学年高二上学期期中联考化学试题湖北省部分高中2020-2021学年高二上学期期中考试化学试题浙江省嘉兴市第五高级中学2018-2019学年高二下学期期中考试化学(学考)试题甘肃省会宁县第一中学2020-2021学年高一下学期期中考试化学试题黑龙江省双鸭山市第一中学2020-2021学年高一下学期期中考试化学试题江苏省太湖高级中学2021-2022学年高一下学期期中考试化学试题广东省徐闻县徐闻中学2022-2023学年高二上学期开学测试化学试题浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题湖南省邵阳市新邵县第八中学2022-2023学年高二上学期期末质量检测化学试题湖南省邵阳市新邵县2022-2023学年高二上学期期末质量检测化学试题湖北省部分普通高中联盟2022-2023学年高一下学期期中联考化学试题湖南省株洲市炎陵县2022-2023学年高一下学期4月期中素质检测化学试题江西省宜春市丰城市第九中学2023-2024学年高二上学期开学考试化学(B卷)试题重庆市巴渝学校2023-2024学年高二上学期期中(半期)考试化学试题
8 . 利用某矿渣(主要成分为Fe2O3及SiO2、CoO、NiCO3、PbCO3等杂质)提取高附加值的铁红(Fe2O3)的一种工艺流程如图所示,按要求回答下列问题。

(1)“酸浸”过程中为提高浸取效率,可以采用的措施为___________ ;其中“浸渣”成分为___________ 。
(2)“还原”过程中发生反应的离子方程式为___________ ,可用试剂___________ 来检验该反应是否完全。
(3)若没有“调pH”直接沉钴镍,可能带来的影响是___________ 。
(4)“沉铁”过程中发生反应的离子方程式为___________ 。
(5)已知Ksp(CoS)=3.0×10-26,K(NiS)=2.8×10-21,当溶液中的离子浓度c≤1.0×10-5mol/L时可认为沉淀完全。“沉钴镍”时若溶液中c(Co2+)=c(Ni2+)=0.01mol/L,逐渐加入Na2S,计算说明两种离子________ (填“能”或“不能”)完全先后分离。

(1)“酸浸”过程中为提高浸取效率,可以采用的措施为
(2)“还原”过程中发生反应的离子方程式为
(3)若没有“调pH”直接沉钴镍,可能带来的影响是
(4)“沉铁”过程中发生反应的离子方程式为
(5)已知Ksp(CoS)=3.0×10-26,K(NiS)=2.8×10-21,当溶液中的离子浓度c≤1.0×10-5mol/L时可认为沉淀完全。“沉钴镍”时若溶液中c(Co2+)=c(Ni2+)=0.01mol/L,逐渐加入Na2S,计算说明两种离子
您最近一年使用:0次
解题方法
9 . 根据操作及现象,下列结论中正确的是
| 选项 | 实验操作及现象 | 结论 |
| A | 将实验室制备的乙烯通入酸性KMnO4溶液中,溶液褪色 | 乙烯被酸性KMnO4溶液氧化 |
| B | 向某钠盐化合物粉末上滴加浓盐酸,将产生的气体通入品红溶液,品红溶液褪色 | 该钠盐为Na2SO3、NaHSO3或Na2S2O3中的一种 |
| C | 将氯气通入KI-淀粉溶液中,溶液先变蓝后褪色 | 氯气将生成的I2氧化 |
| D | 将浓盐酸与MnO2共热一段时间,二者均有剩余 | 该反应为可逆反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
10 . 肉桂酸是一种重要的有机合成中间体,被广泛应用于制备药物、食品添加剂等精细化学品。实验室利用苯甲醛和乙酸酐无水环境下合成肉桂酸的原理及部分试剂物理常数如下。
某实验小组采用如下装置制备肉桂酸,实验步骤如下,按要求回答下列问题。
②反应结束稍冷,加入10mL温水,改用装置2利用水蒸气蒸馏出未反应完的苯甲醛。
③将烧瓶冷却,加入10mL10%氢氧化钠溶液溶解肉桂酸,加热煮沸后加入少量活性炭脱色,趁热抽滤。
④将滤液冷却后,搅拌并用浓盐酸酸化,冷却后抽滤,洗涤沉淀,抽干获得粗产品1.5g。
(1)仪器a的名称是___________ ,与仪器b___________ (填“能”或“不能”)互换。
(2)步骤①中加热方式可以采用___________ ;a的上口连接盛有CaCl2固体的干燥管,目的是___________ 。
(3)装置2中水蒸气发生器为___________ (填“1”或“2”),判断水蒸气蒸馏操作结束的实验现象为___________ 。
(4)步骤④中可采用___________ 洗涤沉淀,加入浓盐酸酸化的目的是___________ 。
(5)该实验中肉桂酸的产率约为___________ %。(保留两位有效数字)
 +
+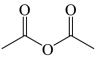
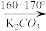
 +CH3COOH
+CH3COOH
| 名称 | 性状 | 比重 | 熔点℃ | 沸点℃ | 溶解度 |
| 苯甲醛 | 无色油状液体 | 1.044 | -26 | 179 | 微溶于水 |
| 乙酸酐 | 无色透明液体 | 1.082 | -73 | 140 | 与水缓慢反应生成乙酸 |
| 肉桂酸 | 白色晶体 | 1.248 | 135 | 300 | 难溶于冷水,可溶于热水,易溶于乙醇 |

②反应结束稍冷,加入10mL温水,改用装置2利用水蒸气蒸馏出未反应完的苯甲醛。
③将烧瓶冷却,加入10mL10%氢氧化钠溶液溶解肉桂酸,加热煮沸后加入少量活性炭脱色,趁热抽滤。
④将滤液冷却后,搅拌并用浓盐酸酸化,冷却后抽滤,洗涤沉淀,抽干获得粗产品1.5g。
(1)仪器a的名称是
(2)步骤①中加热方式可以采用
(3)装置2中水蒸气发生器为
(4)步骤④中可采用
(5)该实验中肉桂酸的产率约为
您最近一年使用:0次
2024-01-14更新
|
491次组卷
|
4卷引用:THUSSAT中学生标准学术能力2023-2024学年高三上学期1月诊断性测理科综合试卷
THUSSAT中学生标准学术能力2023-2024学年高三上学期1月诊断性测理科综合试卷2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学(已下线)实验综合题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)