1 . 铁的化合物
在 保护和搅拌下,向
保护和搅拌下,向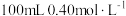 的浅绿色
的浅绿色 溶液中加入
溶液中加入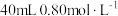 的NaOH溶液,得到
的NaOH溶液,得到 沉淀,保持通
沉淀,保持通 升温至40℃,将气体切换为空气。随着空气通入,悬浊体系由浅绿色变深,形成蓝绿色沉淀A(反应1),继续通入空气,沉淀颜色变化,最后转化为黄色固体B(反应2)。此时若停止通空气,向体系中补充适量NaOH并调控温度,B可以进一步与体系中的物种反应再变为
升温至40℃,将气体切换为空气。随着空气通入,悬浊体系由浅绿色变深,形成蓝绿色沉淀A(反应1),继续通入空气,沉淀颜色变化,最后转化为黄色固体B(反应2)。此时若停止通空气,向体系中补充适量NaOH并调控温度,B可以进一步与体系中的物种反应再变为 (反应3),也可转化为黑色磁性物质C(反应4)。B在150℃彻底脱水形成砖红色氧化物D,失重10.0%。
(反应3),也可转化为黑色磁性物质C(反应4)。B在150℃彻底脱水形成砖红色氧化物D,失重10.0%。
A是一种名为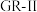 (Green Rust,绿锈,简称GR)的物质,其结构可从
(Green Rust,绿锈,简称GR)的物质,其结构可从 结构演变得到。
结构演变得到。 为层状结构,层板由两层采取密堆积排布的
为层状结构,层板由两层采取密堆积排布的 构成,
构成, 占据层板中密堆积形成的所有八面体空隙,层间通过氢键连接。若层板中部分
占据层板中密堆积形成的所有八面体空隙,层间通过氢键连接。若层板中部分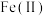 被氧化为
被氧化为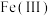 ,会导致其带正电荷,因而需在层间引入阴离子平衡电荷,同时也带入水分子,形成绿锈。晶体衍射和谱学表征显示,
,会导致其带正电荷,因而需在层间引入阴离子平衡电荷,同时也带入水分子,形成绿锈。晶体衍射和谱学表征显示,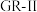 中
中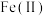 和
和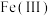 的原子比为
的原子比为 。
。
(1)写出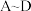 的化学式。A:
的化学式。A:______ ;B:______ ;C:______ ;D:______ ;(对A要求:价态不同的铁分开写并注明氧化数;此处可忽略层间水分子)。
(2)写出反应1~反应4的离子方程式________ (提示:注意起始加入反应物的计量关系,确定反应体系的组成。)
(3)有研究者通过差热分析确定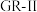 结构中层间水分子的数目。结果显示,在
结构中层间水分子的数目。结果显示,在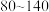 ℃之间出现一个热效应为
℃之间出现一个热效应为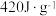 的吸热峰,对应于水分子的脱去。在此范围水的蒸发焓为
的吸热峰,对应于水分子的脱去。在此范围水的蒸发焓为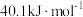 ,可近似当作此条件下上述脱水反应的摩尔焓变。通过计算确定A的化学式中所含水分子数n=
,可近似当作此条件下上述脱水反应的摩尔焓变。通过计算确定A的化学式中所含水分子数n=__________ 。
(4)若将起始反应物 换成
换成 ,可形成类似层状结构的蓝绿色物质
,可形成类似层状结构的蓝绿色物质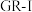 。鉴于
。鉴于 和
和 的大小、形状和电荷不同,当其进入层间时,3个
的大小、形状和电荷不同,当其进入层间时,3个 取代2个
取代2个 并导致层内阳离子电荷和层间堆积方式的调整。推出
并导致层内阳离子电荷和层间堆积方式的调整。推出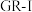 的化学式(价态不同的铁分开写并注明氧化数;忽略层间水分子)
的化学式(价态不同的铁分开写并注明氧化数;忽略层间水分子)______ 。
在
 保护和搅拌下,向
保护和搅拌下,向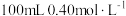 的浅绿色
的浅绿色 溶液中加入
溶液中加入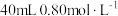 的NaOH溶液,得到
的NaOH溶液,得到 沉淀,保持通
沉淀,保持通 升温至40℃,将气体切换为空气。随着空气通入,悬浊体系由浅绿色变深,形成蓝绿色沉淀A(反应1),继续通入空气,沉淀颜色变化,最后转化为黄色固体B(反应2)。此时若停止通空气,向体系中补充适量NaOH并调控温度,B可以进一步与体系中的物种反应再变为
升温至40℃,将气体切换为空气。随着空气通入,悬浊体系由浅绿色变深,形成蓝绿色沉淀A(反应1),继续通入空气,沉淀颜色变化,最后转化为黄色固体B(反应2)。此时若停止通空气,向体系中补充适量NaOH并调控温度,B可以进一步与体系中的物种反应再变为 (反应3),也可转化为黑色磁性物质C(反应4)。B在150℃彻底脱水形成砖红色氧化物D,失重10.0%。
(反应3),也可转化为黑色磁性物质C(反应4)。B在150℃彻底脱水形成砖红色氧化物D,失重10.0%。A是一种名为
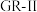 (Green Rust,绿锈,简称GR)的物质,其结构可从
(Green Rust,绿锈,简称GR)的物质,其结构可从 结构演变得到。
结构演变得到。 为层状结构,层板由两层采取密堆积排布的
为层状结构,层板由两层采取密堆积排布的 构成,
构成, 占据层板中密堆积形成的所有八面体空隙,层间通过氢键连接。若层板中部分
占据层板中密堆积形成的所有八面体空隙,层间通过氢键连接。若层板中部分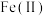 被氧化为
被氧化为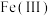 ,会导致其带正电荷,因而需在层间引入阴离子平衡电荷,同时也带入水分子,形成绿锈。晶体衍射和谱学表征显示,
,会导致其带正电荷,因而需在层间引入阴离子平衡电荷,同时也带入水分子,形成绿锈。晶体衍射和谱学表征显示,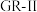 中
中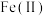 和
和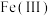 的原子比为
的原子比为 。
。(1)写出
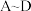 的化学式。A:
的化学式。A:(2)写出反应1~反应4的离子方程式
(3)有研究者通过差热分析确定
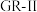 结构中层间水分子的数目。结果显示,在
结构中层间水分子的数目。结果显示,在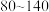 ℃之间出现一个热效应为
℃之间出现一个热效应为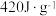 的吸热峰,对应于水分子的脱去。在此范围水的蒸发焓为
的吸热峰,对应于水分子的脱去。在此范围水的蒸发焓为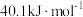 ,可近似当作此条件下上述脱水反应的摩尔焓变。通过计算确定A的化学式中所含水分子数n=
,可近似当作此条件下上述脱水反应的摩尔焓变。通过计算确定A的化学式中所含水分子数n=(4)若将起始反应物
 换成
换成 ,可形成类似层状结构的蓝绿色物质
,可形成类似层状结构的蓝绿色物质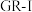 。鉴于
。鉴于 和
和 的大小、形状和电荷不同,当其进入层间时,3个
的大小、形状和电荷不同,当其进入层间时,3个 取代2个
取代2个 并导致层内阳离子电荷和层间堆积方式的调整。推出
并导致层内阳离子电荷和层间堆积方式的调整。推出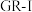 的化学式(价态不同的铁分开写并注明氧化数;忽略层间水分子)
的化学式(价态不同的铁分开写并注明氧化数;忽略层间水分子)
您最近一年使用:0次
解题方法
2 . 某合作学习小组在实验室进行了由食盐制备纯碱的实验探究。请回答下列实验方案中的有关问题:
(1)制备原理:饱和氯化钠与碳酸氢铵反应得碳酸氢钠晶体,碳酸氢钠分解得到纯碱。反应为___ (写化学方程式)。
制备碳酸氢钠有以下三种方案,其中最好的方案是___ (填方案代号)。
方案A:分别将二氧化碳和氨气通入饱和食盐水中;
方案B:将二氧化碳通入含大量氨的饱和食盐水中;
方案C:将氨气通入含二氧化碳的饱和食盐水中。
(2)制备流程:
配制含氨的饱和食盐水→配制二氧化碳→制备碳酸氢钠→制备碳酸钠
实验中使用的部分简易装置如图所示:

其中装置乙的作用为___ ,装置丙的作用为___ ;实验中在装置乙丙之间还应连接制备碳酸氢钠的装置,且反应温度控制在30-35℃,请在答题卡上方框内画出该装置的简易图示___ 。实验的最后一步是将碳酸氢钠晶体转移到___ 中,加热至无水蒸气逸出既得碳酸钠。
(3)实验探究:制备碳酸氢钠的温度要控制在30-35℃,其理由是____ 。
本方法制得的纯碱中可能含有氯化钠,请设计检验实验方案,完成表中内容。
(1)制备原理:饱和氯化钠与碳酸氢铵反应得碳酸氢钠晶体,碳酸氢钠分解得到纯碱。反应为
制备碳酸氢钠有以下三种方案,其中最好的方案是
方案A:分别将二氧化碳和氨气通入饱和食盐水中;
方案B:将二氧化碳通入含大量氨的饱和食盐水中;
方案C:将氨气通入含二氧化碳的饱和食盐水中。
(2)制备流程:
配制含氨的饱和食盐水→配制二氧化碳→制备碳酸氢钠→制备碳酸钠
实验中使用的部分简易装置如图所示:

其中装置乙的作用为
(3)实验探究:制备碳酸氢钠的温度要控制在30-35℃,其理由是
本方法制得的纯碱中可能含有氯化钠,请设计检验实验方案,完成表中内容。
| 实验步骤 | 实验现象与结论 |
您最近一年使用:0次
解题方法
3 . 下列实验操作完全正确的是
| 选项 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个装收容器,上层液体从分液漏斗上口倒出 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 最近,我国某高校一研究小组将0.383gAgCl,0.160gSe和0.21gNaOH装入充满蒸馏水的反应釜中加热到115°C,10小时后冷至室温,用水洗净可溶物后,得到难溶于水的金属色晶体A.在显微镜下观察,发现A的单晶竟是六角微型管(如下图所示),有望开发为特殊材料。现代物理方法证实A由银和硒两种元素组成,Se的质量几近原料的2/3;A的理论产量约0.39g。
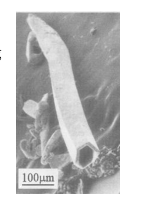
(1)写出合成A的化学方程式_______ ,标明A是什么_________ 。
(2)溶于水的物质有:_______ 。

(1)写出合成A的化学方程式
(2)溶于水的物质有:
您最近一年使用:0次
解题方法
5 . 氯化亚砜(SOCl2),一种无色液体,沸点79°C,重要有机试剂,用于将ROH转化为RCl。氯化亚砜遇水分解,需在无水条件下使用。
(1)试写出它与水完全反应的化学方程式:_______ ;
(2)设计一些简单的实验来验证你写的化学方程式是正确的________ 。(只需给出实验原理,无须描述实验仪器和操作。评分标准:设计的合理性一简捷、可靠、可操作及表述)
(1)试写出它与水完全反应的化学方程式:
(2)设计一些简单的实验来验证你写的化学方程式是正确的
您最近一年使用:0次
6 . 由银(74%)、铅(25%)、锑(1%)等制成的合金是一种优良的电镀新材料。对其中的银的分析,可采用络合滴定法,具体分析步骤概括如下:
试样 沉淀(A)
沉淀(A) 溶液(B)
溶液(B) 溶液(C)
溶液(C) 溶液(D)
溶液(D)
其中(I)加入HNO3(1:1),煮沸,再加入HCl(1:9),煮沸,过滤,依次用HCl(1:9)和水洗涤沉淀;(II)加入浓氨水,过滤,用5%氨水洗涤沉淀;(III)加入氨水-氯化铵缓冲溶液(pH=10),再加入一定量的镍氰化钾固体;(IV)加入紫脲酸铵指示剂(简记为In),用乙二胺四乙酸二钠(简写为Na2H2Y)标准溶液滴定至近终点时,加入氨水10mL(为了使其终点明显),继续滴定至溶液颜色由黄色变为紫红色为终点。已知有关数据如下:
表1
表2
(1)写出A和D中Ag存在形体的化学式:A_______ 、D_______ 。
(2)写出第III步骤的主反应方程式_______ ,第IV步骤滴定终点时的反应方程式_______ 。
(3)试样加HNO3溶解后,为什么要煮沸_______ ?加入HCl(1:9)后为什么还要煮沸_______ ?
(4)假定溶液C中Ag(I)的总浓度为0.010mol/L,游离NH3浓度为2mol/L,要求滴定误差控制在0.2%以内,试计算溶液C中Ni(II)总浓度至少为_______ ?
试样
 沉淀(A)
沉淀(A) 溶液(B)
溶液(B) 溶液(C)
溶液(C) 溶液(D)
溶液(D)其中(I)加入HNO3(1:1),煮沸,再加入HCl(1:9),煮沸,过滤,依次用HCl(1:9)和水洗涤沉淀;(II)加入浓氨水,过滤,用5%氨水洗涤沉淀;(III)加入氨水-氯化铵缓冲溶液(pH=10),再加入一定量的镍氰化钾固体;(IV)加入紫脲酸铵指示剂(简记为In),用乙二胺四乙酸二钠(简写为Na2H2Y)标准溶液滴定至近终点时,加入氨水10mL(为了使其终点明显),继续滴定至溶液颜色由黄色变为紫红色为终点。已知有关数据如下:
表1
| 配合物 | [AgY]3- | [NiY]2- | [Ag(CN)2]- | [Ni(CN)4]2- | [Ag(NH3)2]+ | [Ni(NH3)6]2+ |
| lgK稳 | 7.32 | 18.62 | 21.1 | 31.3 | 7.05 | 8.74 |
| 酸 | H4Y | H3Y- | H2Y2- | HY3- |
| lgK稳 | -2.0 | -2.67 | -6.16 | -10.26 |
(2)写出第III步骤的主反应方程式
(3)试样加HNO3溶解后,为什么要煮沸
(4)假定溶液C中Ag(I)的总浓度为0.010mol/L,游离NH3浓度为2mol/L,要求滴定误差控制在0.2%以内,试计算溶液C中Ni(II)总浓度至少为
您最近一年使用:0次
7 . 用EDTA配位滴定法可测定与Cu2+和Zn2+共存的Al3+的含量,以PAN为指示剂,测定的相对误差≤±0.1%。测定过程可表述如下(注:表中的配合物电荷数被省略;游离的EDTA的各种形体均被简写为Y):
附:配合物稳定常数的对数值lgK稳的数据:

附:配合物稳定常数的对数值lgK稳的数据:CuY 18. 8 ZnY 16.5 AlY 16. 1 AlF 19.7 Cu- PAN 16.1
19.7 Cu- PAN 16.1
(1)写出从D框状态到E框状态的反应式并配平_______ 。
(2)F框状态内还应存在何种物质_______ ?
(3)是否需确知所用EDTA溶液的准确浓度_______ ?V1是否需要准确读取并记录_______ ?简述原因_______ 。
(4)若从C框状态到D框状态时Cu2+溶液滴过量了,问:
①对最终的测定结果将引入正误差还是负误差?还是无影响_______ ?
②如你认为有影响,在实验方面应如何处理_______ ?
(5)设试液取量V0和V1、V2、V3均以mL为单位,MAl为Al的摩尔质量(g·mol-1),c(EDTA)、c(Cu)分别为EDTA和Cu2+溶液的浓度(mol·L-1),列出试液中Al含量(g·L-1)的计算式_______ 。
附:配合物稳定常数的对数值lgK稳的数据:

附:配合物稳定常数的对数值lgK稳的数据:CuY 18. 8 ZnY 16.5 AlY 16. 1 AlF
 19.7 Cu- PAN 16.1
19.7 Cu- PAN 16.1(1)写出从D框状态到E框状态的反应式并配平
(2)F框状态内还应存在何种物质
(3)是否需确知所用EDTA溶液的准确浓度
(4)若从C框状态到D框状态时Cu2+溶液滴过量了,问:
①对最终的测定结果将引入正误差还是负误差?还是无影响
②如你认为有影响,在实验方面应如何处理
(5)设试液取量V0和V1、V2、V3均以mL为单位,MAl为Al的摩尔质量(g·mol-1),c(EDTA)、c(Cu)分别为EDTA和Cu2+溶液的浓度(mol·L-1),列出试液中Al含量(g·L-1)的计算式
您最近一年使用:0次
8 . 一种鲜花保存剂(preservativeofcutflowers)B可按以下方法制备:把丙酮肟、溴乙酸、氢氧化钾混合在1,4-二氧六环(溶剂)中反应,酸化后用乙醚提取,蒸去乙醚后经减压蒸馏析离出中间产物A,A用1:1盐酸水溶液水解,水解液浓缩后加入异丙醇(降低溶解度),冷却,即得到晶态目标产物B,B的熔点152~153℃(分解),可溶于水,与AgNO3溶液形成AgCl沉淀。用银定量法以回滴方式(用NH4SCN回滴过量的AgNO3)测定目标产物B的相对分子质量,实验过程及实验数据如下:
①用250毫升容量瓶配制约0.05mol/L的AgNO3溶液,同时配置250mL浓度相近的NH4SCN溶液。
②准确称量烘干的NaCl207.9mg,用100毫升容量瓶定容。
③用10毫升移液管移取上述AgNO3溶液到50毫升锥瓶中,加入4mL4mol/LHNO3和1mL饱和铁铵矾溶液,用NH4SCN溶液滴定,粉红色保持不褪色时为滴定终点,三次实验的平均值6.30mL。
④用10毫升移液管移取NaCl溶液到50毫升锥瓶中,加入10mLAgNO3溶液、4mL4.mol/LHNO3和1mL饱和铁铵矾溶液,用回滴过量的AgNO3,三次实验结果平均为1.95mL。
⑤准确称量84.0mg产品B,转移到50毫升锥瓶中,加适量水使其溶解,加入10mLAgNO3溶液、4mL4mol/LHNO3和1mL饱和铁铵矾溶液,用NH4SCN溶液回滴,消耗了1.65mL。
⑥重复步骤⑤,称量的B为81.6mg,消耗的NH4SCN溶液为1.77mL;称量的B为76.8mg,消耗的NH4SCN溶液为2.02mL。
(1)按以上实验数据计算出产物B的平均相对分子质量_______ 。用质谱方法测得液相中B的最大正离子的相对式量为183。
(2)试写出中间产物A和目标产物B的结构式:A_______ 、B_______ 。
①用250毫升容量瓶配制约0.05mol/L的AgNO3溶液,同时配置250mL浓度相近的NH4SCN溶液。
②准确称量烘干的NaCl207.9mg,用100毫升容量瓶定容。
③用10毫升移液管移取上述AgNO3溶液到50毫升锥瓶中,加入4mL4mol/LHNO3和1mL饱和铁铵矾溶液,用NH4SCN溶液滴定,粉红色保持不褪色时为滴定终点,三次实验的平均值6.30mL。
④用10毫升移液管移取NaCl溶液到50毫升锥瓶中,加入10mLAgNO3溶液、4mL4.mol/LHNO3和1mL饱和铁铵矾溶液,用回滴过量的AgNO3,三次实验结果平均为1.95mL。
⑤准确称量84.0mg产品B,转移到50毫升锥瓶中,加适量水使其溶解,加入10mLAgNO3溶液、4mL4mol/LHNO3和1mL饱和铁铵矾溶液,用NH4SCN溶液回滴,消耗了1.65mL。
⑥重复步骤⑤,称量的B为81.6mg,消耗的NH4SCN溶液为1.77mL;称量的B为76.8mg,消耗的NH4SCN溶液为2.02mL。
(1)按以上实验数据计算出产物B的平均相对分子质量
(2)试写出中间产物A和目标产物B的结构式:A
您最近一年使用:0次
解题方法
9 . 近年来人们开发了一种由铝合金和硼纤维组成的铝合金基-硼纤维复合材料。该材料具有比铝合金更高的比强度和比模量,可用于航空、航天飞行器。有人设计了一种分析这种复合材料中硼含量的方法:用混酸溶解m克样品,配成体积为V0的试样溶液;通过强酸型阳离子交换树脂除尽溶液中的金属阳离子;以甲基红为指示剂,用NaOH溶液中和试样溶液;加入甘露醇,使硼酸(Ka=5.8×10-10)定量地转变为甘露醇-硼酸配合物(Ka=8.4×10-6),反应方程式为:
 +H3BO3=
+H3BO3=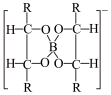 +H++3H2O
+H++3H2O
再加入适当指示剂,用NaOH溶液滴定到终点。主要分析流程图如下(图中只列出主要物质,其他少量物质的干扰可以不予考虑)。

(1)写出从A框到B框生成H3BO3的反应方程式以及H3BO3在水溶液中的电离方程式___ 、___ 。
(2)除去过量酸后的热溶液在冷却至室温过程中有时析出白色鳞片状晶体。写出该晶体的化学式并解释为什么晶体呈片状_____ 、_____ 。
(3)从C框到D框的滴定操作过程中,是否需要准确地中和H+____ ?简述原因_____ 。
(4)从原理上分析D框到E框这一步操作的目的______ 。
(5)如果E框中配合物和NaOH滴定剂的浓度均为0.10mol·L-1,请估算滴定到化学计量点时的pH___ ,并指出从E框到F框的滴定过程中,应该选用哪种指示剂___ ?滴定终点的颜色是什么____ ?
(6)V0、V1和V2的单位都为mL,MB为硼的摩尔质量(g·mol-1),c(NaOH)为NaOH溶液的浓度(mol·L-1),请给出被测溶液中硼含量(g·L-1)的计算式________ 。
 +H3BO3=
+H3BO3= +H++3H2O
+H++3H2O再加入适当指示剂,用NaOH溶液滴定到终点。主要分析流程图如下(图中只列出主要物质,其他少量物质的干扰可以不予考虑)。

(1)写出从A框到B框生成H3BO3的反应方程式以及H3BO3在水溶液中的电离方程式
(2)除去过量酸后的热溶液在冷却至室温过程中有时析出白色鳞片状晶体。写出该晶体的化学式并解释为什么晶体呈片状
(3)从C框到D框的滴定操作过程中,是否需要准确地中和H+
(4)从原理上分析D框到E框这一步操作的目的
(5)如果E框中配合物和NaOH滴定剂的浓度均为0.10mol·L-1,请估算滴定到化学计量点时的pH
| 指示剂 | 变色范围pH | 颜色 | pKHln | |
| 酸式 | 碱式 | |||
| 甲基橙 | 3.1~4.4 | 红 | 橙黄 | 3.4 |
| 甲基红 | 4.4~6.2 | 红 | 黄 | 5.0 |
| 酚红 | 6.7~8.4 | 黄 | 红 | 8.0 |
| 酚酞 | 8.2~10.0 | 无 | 紫红 | 9.4 |
您最近一年使用:0次
10 . 金在自然界中主要以分散的单质形式存在,需要先富集再提炼。富集后的精矿用混汞法、氰化法。等工艺提取金。混汞法是使矿浆中的金粒与汞生成金汞齐,然后蒸去汞得到海绵金(又称汞金)。氰化法是在氧化剂(如空气或氧气)存在下,用可溶性氰化物(如NaCN)溶液浸出矿石中的金(浸出产物为[Au(CN)2]- ),再用置换法或电沉积法从浸出液中回收金。
(1)写出用氰化物溶金反应和用Zn粉置换金的化学反应方程式_________ 。
(2)已知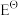 (O2/H2O)=1.229V,
(O2/H2O)=1.229V,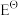 (Au+ /Au)=1, 69 V,
(Au+ /Au)=1, 69 V, 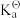 (HCN)=4.93 ×10-10,β2([Au(CN)2]-)= 2. 00× 1038,F=96.485 J·V-1·mol-1。设配制的NaCN水溶液的浓度为1.00 ×10-3 mol/L、生成的[ Au(CN)2]-配离子的浓度为1.00 ×10-4 mol/L、空气中O2的体积分数为0.210,计算298K时在空气中溶金反应的自由能变
(HCN)=4.93 ×10-10,β2([Au(CN)2]-)= 2. 00× 1038,F=96.485 J·V-1·mol-1。设配制的NaCN水溶液的浓度为1.00 ×10-3 mol/L、生成的[ Au(CN)2]-配离子的浓度为1.00 ×10-4 mol/L、空气中O2的体积分数为0.210,计算298K时在空气中溶金反应的自由能变_________ 。
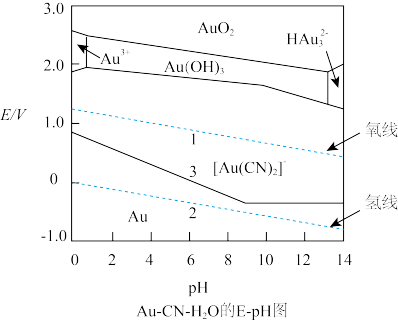
(3)当电极反应中有H+或OH-时,其电极电势E将受pH的影响,E-pH图体现了这种影响。E-pH图上有3种类型的线:电极反应的E与 pH有关,为有一定斜率的直线;电极反应的E与pH无关,是一条平行于横坐标的直线;非氧化还原反应,是一条平行于纵坐标的直线。
电对的E-pH线的,上方,是该电对的氧化型。的稳定区,E -pH线的下方,是还原型的稳定区;位于高位置线的氧化型易与低位置线的还原型反应;各曲线的交点所处的E和pH,是各电极的氧化型和还原型共存的条件。下图是氰化法溶金过程的Au-CN- H2O系统的E-pH图,试借助该图对溶金反应和溶金的工艺条件进行讨论_________ 。
(1)写出用氰化物溶金反应和用Zn粉置换金的化学反应方程式
(2)已知
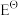 (O2/H2O)=1.229V,
(O2/H2O)=1.229V,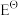 (Au+ /Au)=1, 69 V,
(Au+ /Au)=1, 69 V, 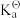 (HCN)=4.93 ×10-10,β2([Au(CN)2]-)= 2. 00× 1038,F=96.485 J·V-1·mol-1。设配制的NaCN水溶液的浓度为1.00 ×10-3 mol/L、生成的[ Au(CN)2]-配离子的浓度为1.00 ×10-4 mol/L、空气中O2的体积分数为0.210,计算298K时在空气中溶金反应的自由能变
(HCN)=4.93 ×10-10,β2([Au(CN)2]-)= 2. 00× 1038,F=96.485 J·V-1·mol-1。设配制的NaCN水溶液的浓度为1.00 ×10-3 mol/L、生成的[ Au(CN)2]-配离子的浓度为1.00 ×10-4 mol/L、空气中O2的体积分数为0.210,计算298K时在空气中溶金反应的自由能变(3)当电极反应中有H+或OH-时,其电极电势E将受pH的影响,E-pH图体现了这种影响。E-pH图上有3种类型的线:电极反应的E与 pH有关,为有一定斜率的直线;电极反应的E与pH无关,是一条平行于横坐标的直线;非氧化还原反应,是一条平行于纵坐标的直线。
电对的E-pH线的,上方,是该电对的氧化型。的稳定区,E -pH线的下方,是还原型的稳定区;位于高位置线的氧化型易与低位置线的还原型反应;各曲线的交点所处的E和pH,是各电极的氧化型和还原型共存的条件。下图是氰化法溶金过程的Au-CN- H2O系统的E-pH图,试借助该图对溶金反应和溶金的工艺条件进行讨论

您最近一年使用:0次



