名校
解题方法
1 . 下列化学用语表示错误的是
| A.基态镓原子的电子排布式为[Ar]4s24p1 |
B.60gSiO2中含有Si-O键数目为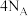 |
C.砷化氢(AsH3)分子的球棍模型: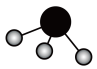 |
D.过氧化钠(Na2O2)的电子式: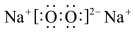 |
您最近半年使用:0次
名校
2 . 化学用语是化学专业术语。下列化学用语错误的是
A.基态Cu原子的价层电子排布式为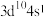 |
B. 分子的VSEPR模型为 分子的VSEPR模型为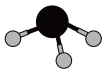 |
C.乙炔分子中 键的形成表示为 键的形成表示为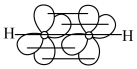 |
D.基态Ca原子核外电子占据的最高能级原子轨道示意图为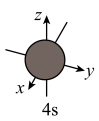 |
您最近半年使用:0次
2024-03-09更新
|
396次组卷
|
2卷引用:福建省厦门第一中学2023-2024学年高三下学期2月第一次月考化学试卷
3 . 下列化学用语或图示表达正确的是
A.乙烯的结构简式: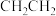 | B.碳化硅的分子式:SiC |
C.Cr的核外电子排布式: | D.乙醇的核磁共振氢谱图: |
您最近半年使用:0次
21-22高一上·浙江·阶段练习
4 . 化学用语是学习化学的基本工具,是高中化学的重要内容,请根据要求用合适的化学用语填空:
(1)从分子结构上来看,氮与碳有很多对应的物质(如CH4和NH3对应),请找出下列含碳化合物对应的含氮物质(填写化学式):H2CO3_____ ;C2H2_____ 。
(2)已知Fe元素在化合物里通常显+2或+3价,因此Fe3O4可写成氧化物形式FeO·Fe2O3,或盐的形式Fe(FeO2)2,它属于偏铁酸盐。Pb在化合物里显+2价或+4价,那么Pb3O4也可以写成_____ 或_____ 。(填写化学式)
(3)在法庭医学分析上常用马氏砷法来证明受害者是否为砒霜(As2O3)中毒。用锌和盐酸与试样混合在一起,若试样中有砒霜,就会发生反应生成砷化氢(AsH3)、锌盐溶液。写出该反应的化学方程式_____ 。
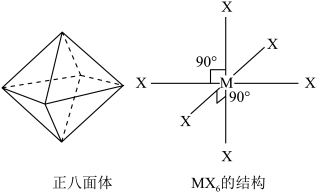
(4)某化合物MX6分子呈正八面体形式(如图所示)。由于六个X原子与M的连接完全对称,因此将任意一个X用Y原子替换均只能得到一种结构的MX5Y。按此思路,若将其中任意两个X原子用Y原子替换,请画出化学式为MX4Y2的各种结构_____ 。
(1)从分子结构上来看,氮与碳有很多对应的物质(如CH4和NH3对应),请找出下列含碳化合物对应的含氮物质(填写化学式):H2CO3
(2)已知Fe元素在化合物里通常显+2或+3价,因此Fe3O4可写成氧化物形式FeO·Fe2O3,或盐的形式Fe(FeO2)2,它属于偏铁酸盐。Pb在化合物里显+2价或+4价,那么Pb3O4也可以写成
(3)在法庭医学分析上常用马氏砷法来证明受害者是否为砒霜(As2O3)中毒。用锌和盐酸与试样混合在一起,若试样中有砒霜,就会发生反应生成砷化氢(AsH3)、锌盐溶液。写出该反应的化学方程式
(4)某化合物MX6分子呈正八面体形式(如图所示)。由于六个X原子与M的连接完全对称,因此将任意一个X用Y原子替换均只能得到一种结构的MX5Y。按此思路,若将其中任意两个X原子用Y原子替换,请画出化学式为MX4Y2的各种结构

您最近半年使用:0次
5 . 下列图示正确的是
A.中子数为16的硫原子: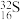 |
B.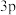 电子的电子云轮廓图: 电子的电子云轮廓图: |
C. 的形成过程: 的形成过程: |
D.测定 相对分子质量的质谱图: 相对分子质量的质谱图: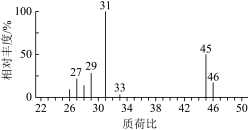 |
您最近半年使用:0次
2023-02-18更新
|
657次组卷
|
3卷引用:湖南省长沙市麓山国际实验学校2022-2023学年高三下学期3月月考化学试题
名校
解题方法
6 . 下列分子式只表示一种物质的是
A. | B. | C. | D.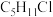 |
您最近半年使用:0次
2023-01-09更新
|
1467次组卷
|
4卷引用:安徽省马鞍山市红星中学2022-2023学年高一下学期5月月考化学试题
解题方法
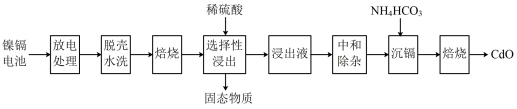
7 . 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知镍镉电池的电池总反应为: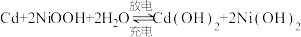 ,利用废旧镍镉电池回收铬的流程如下:
,利用废旧镍镉电池回收铬的流程如下:
已知:中和除杂后的溶液中主要含有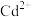 、
、 、
、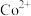 。
。
回答下列问题:
(1)NiOOH中,Ni的化合价为:______ 。
(2)写出“焙烧”过程中含镍物质变化的化学反应方程式:______ 。
(3)在“选择性浸出”一步中,40℃时,不同的金属氧化物在稀 中2小时后的浸出率随PH的变化如下图1所示,则:
中2小时后的浸出率随PH的变化如下图1所示,则:

①“选择性浸出”时,最适宜的pH为______ (填选项字母),写出在此pH下发生的主要离子方程式:______ 。
A.5 B.4 C.3 D.2
②浸出液中各元素含量如表1所示。Co的浓度比镍还小的原因可能是:______ 。
表1 浸出液组成
(4)沉铬时生成 的离子反应方程式:
的离子反应方程式:______ 。
(5)镍铬电池充电时, 移向
移向______ (填“明极”或“阳极”),写出阳极的电极反应式:______ 。
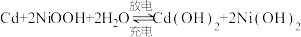 ,利用废旧镍镉电池回收铬的流程如下:
,利用废旧镍镉电池回收铬的流程如下:
已知:中和除杂后的溶液中主要含有
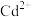 、
、 、
、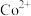 。
。回答下列问题:
(1)NiOOH中,Ni的化合价为:
(2)写出“焙烧”过程中含镍物质变化的化学反应方程式:
(3)在“选择性浸出”一步中,40℃时,不同的金属氧化物在稀
 中2小时后的浸出率随PH的变化如下图1所示,则:
中2小时后的浸出率随PH的变化如下图1所示,则:
①“选择性浸出”时,最适宜的pH为
A.5 B.4 C.3 D.2
②浸出液中各元素含量如表1所示。Co的浓度比镍还小的原因可能是:
| 元素Elements | Cd | Ni | Co | Fe |
浓度(Concentrations/( ) ) | 77.5 | 2.61 | 0.406 | 0.176 |
表1 浸出液组成
(4)沉铬时生成
 的离子反应方程式:
的离子反应方程式:(5)镍铬电池充电时,
 移向
移向
您最近半年使用:0次
2022-08-18更新
|
155次组卷
|
2卷引用:贵州省思南县梵净山中学2022-2023学年高三上学期11月月考化学试题
8 . 工业上利用氧化铝基废催化剂(主要成分为Al2O3,少量Pd)回收Al2(SO4)3及Pd 流程如图:

说明:上述流程中焙烧温度不宜过高,否则会导致硫酸铵固体的分解。
(1)焙烧时产生气体X的结构式为________ 。
(2)水浸分离中,滤渣Pd的颗粒比较大,一般可以采用的分离方法是_________ (填字母)
A.过滤 B.抽滤 C.倾析 D.渗析
(3)写出酸浸时发生反应的离子方式______ (已知氯钯酸为弱酸)
(4)某同学在实验室用如下图所示装置完成Pd的热还原实验,并计算滤渣中 (NH4)2PdCl6的百分含量(滤渣中的杂质不参与热还原反应)。

①写出热还原法过程中发生反应的化学方程式________ 。
②i.将石英玻璃管中(带开关;K1和K2)(设为装置A )称重,记为mi g。将滤渣 [(NH4)2PdCl6]装入石英玻璃管中,再次将装置A称重,记为m2 g。
ii.连接好装置后,按d→ → →b→ →e(填标号)顺序进行实验。_______
a.关闭K1和K2 b.熄灭酒精灯 c.点燃酒精灯,加热
d.打开K1和K2 e.称量A f.缓缓通入H2 g.冷却至室温
iii.重复上述操作步骤,直至A恒重,记为m3g。
③根据实验记录,计算滤渣中(NH4)2PdCl6的百分含量__________ [列式表示,其中(NH4)2PdCl6相对分子质量为355]。
④实验结束时,发现硬质试管右端有少量白色固体,可能是____ (填化学式),这种情况导致实验结果_________ (填“偏高”、“偏低”、“无影响”)

说明:上述流程中焙烧温度不宜过高,否则会导致硫酸铵固体的分解。
(1)焙烧时产生气体X的结构式为
(2)水浸分离中,滤渣Pd的颗粒比较大,一般可以采用的分离方法是
A.过滤 B.抽滤 C.倾析 D.渗析
(3)写出酸浸时发生反应的离子方式
(4)某同学在实验室用如下图所示装置完成Pd的热还原实验,并计算滤渣中 (NH4)2PdCl6的百分含量(滤渣中的杂质不参与热还原反应)。

①写出热还原法过程中发生反应的化学方程式
②i.将石英玻璃管中(带开关;K1和K2)(设为装置A )称重,记为mi g。将滤渣 [(NH4)2PdCl6]装入石英玻璃管中,再次将装置A称重,记为m2 g。
ii.连接好装置后,按d→ → →b→ →e(填标号)顺序进行实验。
a.关闭K1和K2 b.熄灭酒精灯 c.点燃酒精灯,加热
d.打开K1和K2 e.称量A f.缓缓通入H2 g.冷却至室温
iii.重复上述操作步骤,直至A恒重,记为m3g。
③根据实验记录,计算滤渣中(NH4)2PdCl6的百分含量
④实验结束时,发现硬质试管右端有少量白色固体,可能是
您最近半年使用:0次
2020-01-01更新
|
499次组卷
|
2卷引用:辽宁省实验中学2022届高三第一次阶段性考试化学试题
名校
9 . KMnO4是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿(主要成分MnO2,还有Fe2O3、Al2O3、SiO2等)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得KMnO4(反应条件已经省略)。
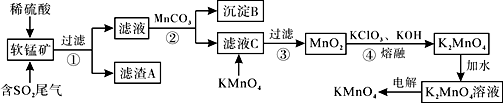
已知:Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1×10-33。回答下列问题:
(1)K2MnO4中Mn的化合价为___________ 。
(2)滤渣A的成分是_________ ,析出沉淀B时,首先析出的物质是_________ 。
(3)步骤2中加入MnCO3的作用为_______________ 。
(4)滤液C中加入KMnO4时发生反应的离子方程式是_________________ 。
(5)步骤4中反应的化学方程式是_______________ 。
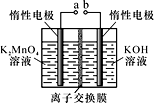
(6)电解制备KMnO4的装置如图所示。b与电源的______ 极相连,电解液中最好选择_______ 离子交换膜(填“阳”或“阴”)。电解时,阳极的电极反应式为_________ 。

已知:Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1×10-33。回答下列问题:
(1)K2MnO4中Mn的化合价为
(2)滤渣A的成分是
(3)步骤2中加入MnCO3的作用为
(4)滤液C中加入KMnO4时发生反应的离子方程式是
(5)步骤4中反应的化学方程式是
(6)电解制备KMnO4的装置如图所示。b与电源的

您最近半年使用:0次
2019-01-25更新
|
1214次组卷
|
2卷引用:安徽师范大学附属中学2021-2022学年高三上学期11月考试化学试题
名校
10 . 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
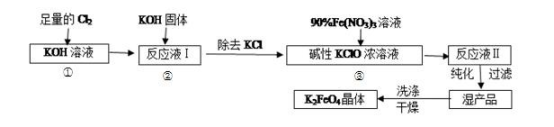

已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4FeO42+10H2O 4Fe(OH)3(胶体)+8OH-+3O2↑
4Fe(OH)3(胶体)+8OH-+3O2↑
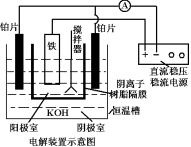
回答下列问题:实验室可利用如图装置完成流程①和②
(1)写出工业上制取 Cl2 的化学方程式_____ ;恒压滴液漏斗支管的作用_____ ,两水槽中的水为__________ (填“热水”或“冷水”).
(2)反应一段时间后,停止通氯气,再往仪器 a 中加入浓 KOH 溶液的目的是_____ ;
A.为下一步反应提供碱性的环境
B.使 KClO3 转化为 KClO
C.与溶液 I 中过量的Cl2继续反应,生成更多的KClO
D.KOH 固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出 K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子方程式为:_________________ 。
(4)用重结晶法提纯粗产品:将粗产品先用 KOH 稀溶液溶解,再加入饱和的 KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①洗涤粗品时选用异丙醇而不用水的理由是_____________ 。
②如何判断 K2FeO4 晶体已经洗涤干净________________ 。
(5)从环境保护的角度看,制备 K2FeO4 较好的方法为电解法,其装置如图电解过程中阳极的电极反应式为___________ 。
(6)FeO42-在水溶液中的存在形态如图所示。下列说法正确的是______________ 。
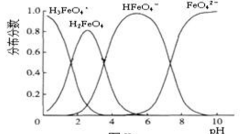
A.不论溶液的酸碱性如何变化,铁元素都有 4 种存在形态
B.向 pH=10的这种溶液中加硫酸至 pH=2,HFeO4-的分布分数逐渐 增大
C.向 pH=6 的这种溶液中加 KOH 溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42- +H2O



已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4FeO42+10H2O
 4Fe(OH)3(胶体)+8OH-+3O2↑
4Fe(OH)3(胶体)+8OH-+3O2↑回答下列问题:实验室可利用如图装置完成流程①和②
(1)写出工业上制取 Cl2 的化学方程式
(2)反应一段时间后,停止通氯气,再往仪器 a 中加入浓 KOH 溶液的目的是
A.为下一步反应提供碱性的环境
B.使 KClO3 转化为 KClO
C.与溶液 I 中过量的Cl2继续反应,生成更多的KClO
D.KOH 固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出 K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子方程式为:
(4)用重结晶法提纯粗产品:将粗产品先用 KOH 稀溶液溶解,再加入饱和的 KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①洗涤粗品时选用异丙醇而不用水的理由是
②如何判断 K2FeO4 晶体已经洗涤干净
(5)从环境保护的角度看,制备 K2FeO4 较好的方法为电解法,其装置如图电解过程中阳极的电极反应式为
(6)FeO42-在水溶液中的存在形态如图所示。下列说法正确的是

A.不论溶液的酸碱性如何变化,铁元素都有 4 种存在形态
B.向 pH=10的这种溶液中加硫酸至 pH=2,HFeO4-的分布分数逐渐 增大
C.向 pH=6 的这种溶液中加 KOH 溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42- +H2O
您最近半年使用:0次
2019-01-22更新
|
854次组卷
|
2卷引用:【全国百强校】天津市第一中学2019届高三上学期第三次月考化学试题



