1 . 有H2SO4和HCl的混合溶液20 mL,加入0.025 mol·L-1Ba(OH)2溶液时,生成沉淀的质量W(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C点混合液pH=7),求:
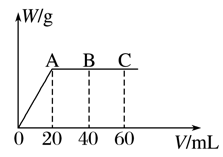
(1)原混合液中H2SO4物质的量浓度为____________ mol·L-1。
(2)原混合液中HCl的物质的量为________ mol。

(1)原混合液中H2SO4物质的量浓度为
(2)原混合液中HCl的物质的量为
您最近一年使用:0次
2 . 硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂。
(1)将Ce(SO4)2·4H2O(摩尔质量为404g/mol)在空气中加热,样品的固体残留率( )随温度的变化如图所示。
)随温度的变化如图所示。
当固体残留率为70.3%时,所得固体可能为______ (填字母)
A. Ce(SO4)2 B. Ce2(SO4)3 C. CeOSO4
(2)将一定质量的Ce(SO4)2·4H2O溶于50mL质量分数为60%、密度为1.47g/cm3的硫酸中,
再用水定容至l000mL,所得溶液中c(H+)=_______ mol/L
(3)利用Ce(SO4)2标准溶液测定FeC2O4·2H2O(摩尔质量为180g/mol)和Fe(C2O4)3·4H2O(摩尔质量为448g/mol)固体混合物中FeC2O4·2H2O含量的方法如下:
步骤l:称量1.1240g固体混合物,溶于硫酸,向溶液中加入100.00mL 0.2000mol/L的Ce(SO4)2溶液。物质转化关系如下: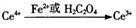
步骤2:将反应后的溶液加水稀释并定容至250.00mL,取25.00mL于锥形瓶中,滴加指示剂,用0.01000mol/LFeSO4标准溶液滴定过量的Ce4+,终点时消耗FeSO4标准溶液20.00mL。
计算固体混合物中FeC2O4·2H2O的质量分数,写出计算过程_______ 。
(1)将Ce(SO4)2·4H2O(摩尔质量为404g/mol)在空气中加热,样品的固体残留率(
 )随温度的变化如图所示。
)随温度的变化如图所示。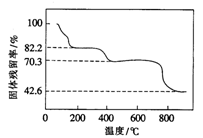
当固体残留率为70.3%时,所得固体可能为
A. Ce(SO4)2 B. Ce2(SO4)3 C. CeOSO4
(2)将一定质量的Ce(SO4)2·4H2O溶于50mL质量分数为60%、密度为1.47g/cm3的硫酸中,
再用水定容至l000mL,所得溶液中c(H+)=
(3)利用Ce(SO4)2标准溶液测定FeC2O4·2H2O(摩尔质量为180g/mol)和Fe(C2O4)3·4H2O(摩尔质量为448g/mol)固体混合物中FeC2O4·2H2O含量的方法如下:
步骤l:称量1.1240g固体混合物,溶于硫酸,向溶液中加入100.00mL 0.2000mol/L的Ce(SO4)2溶液。物质转化关系如下:
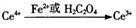
步骤2:将反应后的溶液加水稀释并定容至250.00mL,取25.00mL于锥形瓶中,滴加指示剂,用0.01000mol/LFeSO4标准溶液滴定过量的Ce4+,终点时消耗FeSO4标准溶液20.00mL。
计算固体混合物中FeC2O4·2H2O的质量分数,写出计算过程
您最近一年使用:0次
3 . 分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份。
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]:n(NH4Cl)为___________ 。
(2)另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=_____ (溶液体积变化忽略不计)。
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]:n(NH4Cl)为

(2)另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=
您最近一年使用:0次
2017-04-14更新
|
1728次组卷
|
16卷引用:浙江省2017届高三新高考选考科目考试化学试题
浙江省2017届高三新高考选考科目考试化学试题2017届浙江省高三4月普通高校招生选考科目考试化学试卷浙江省2018版考前特训(2017年10月)压轴特训:4 第29题 化学计算题专练(已下线)【备战2019年浙江新高考-考点】——考点02 物质的量浙江省湖州市高中联盟2017-2018学年高一下学期期中联考化学试题浙江省湖州市高中联盟2018-2019学年高一下学期期中化学试题(已下线)【新东方】高中化学098浙江省金华市曙光学校2019-2020学年高一下学期返校测试化学试题高一必修第一册(鲁科2019)第3章 第3节 氮的循环 高考帮(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第二节 氮及其化合物山西省晋中市现代双语学校2020-2021学年高一下学期第一次月考化学试题(已下线)【浙江新东方】高中化学20210513-022【2021】【高一下】(已下线)【浙江新东方】在线化学100高一下(已下线)专题18.化学计算-十年(2012-2021)高考化学真题分项汇编(浙江专用)苏教2020版化学必修第二册专题7第二单元 重要含氮化工原料课后习题(已下线)题型59 氨与铵盐的性质
解题方法
4 . 用11.92gNaClO配成100mL溶液,向其中加入0.01mol Na2Sx恰好完全反应,生成Na2SO4和NaCl。
(1)NaClO溶液的物质的量浓度_________ mol·L-1。
(2)化学式Na2Sx中的X=____________ 。
(1)NaClO溶液的物质的量浓度
(2)化学式Na2Sx中的X=
您最近一年使用:0次
2017-04-03更新
|
1573次组卷
|
7卷引用:2017届浙江省绍兴市高三3月教学质量调测考试化学试卷2
解题方法
5 . 自然界中,金属硫化物矿床常因发生表生氧化及次生富集作用,产生辉铜矿(Cu2S)与铜蓝(CuS)。
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将四份质量不同的某Cu2S和CuS混合物样品分别与100mL 5mol/L的稀硝酸充分反应,样品质量与产生气体的体积(已折合成标准状况)如下表所示:
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
53.用质量分数为0.63、密度为1.42g/cm3的浓硝酸配置100mL、5mol/L的稀硝酸,需浓硝酸的体积为_____________ 。(保留1位小数)
54.甲实验结束后,溶液中c(NO3-) =__________________ 。
55.混合物样品中Cu2S、CuS的物质的量之比是多少?_______ (写出计算过程)
56.乙实验结束后,溶液中氢离子的浓度是多少?________ (写出计算过程)
57.计算丙实验中产生气体的体积(V)。________ (写出计算过程)
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将四份质量不同的某Cu2S和CuS混合物样品分别与100mL 5mol/L的稀硝酸充分反应,样品质量与产生气体的体积(已折合成标准状况)如下表所示:
| 实验编号 | 甲 | 乙 | 丙 |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
53.用质量分数为0.63、密度为1.42g/cm3的浓硝酸配置100mL、5mol/L的稀硝酸,需浓硝酸的体积为
54.甲实验结束后,溶液中c(NO3-) =
55.混合物样品中Cu2S、CuS的物质的量之比是多少?
56.乙实验结束后,溶液中氢离子的浓度是多少?
57.计算丙实验中产生气体的体积(V)。
您最近一年使用:0次
2010·海南·一模
6 . (1)49gH2SO4的物质的量是______ ,将其配制成200mL溶液,所得溶液的物质的量浓度为______ ,其中含SO42-_____ 个,该溶液能与标准状况下的氨气_____ L恰好完全反应生成(NH4)2SO4。
(2)由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol/ L, c(SO42-)=0.8 mol/ L,则c(K+)为_____ 。
(3)将标准状况下a L HCl(g)溶于1000 g水中,得到盐酸的密度为bg/ cm3,则该盐酸的物质的量浓度是______ 。
(2)由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol/ L, c(SO42-)=0.8 mol/ L,则c(K+)为
(3)将标准状况下a L HCl(g)溶于1000 g水中,得到盐酸的密度为bg/ cm3,则该盐酸的物质的量浓度是
您最近一年使用:0次
名校
解题方法
7 . 取100 mL等物质的量浓度的盐酸和硫酸混合溶液,当加入100 mL 3.0 mol·L-1的Ba(OH)2溶液时,溶液显中性。请计算:
(1)原混合液中H+的物质的量浓度为________ mol·L-1。
(2)当加入的Ba(OH)2体积为75 mL时,产生的沉淀质量为________ g。
(1)原混合液中H+的物质的量浓度为
(2)当加入的Ba(OH)2体积为75 mL时,产生的沉淀质量为
您最近一年使用:0次
2016-04-15更新
|
479次组卷
|
5卷引用:2016届浙江省温州市高三3月模拟(选考)化学试卷
2016届浙江省温州市高三3月模拟(选考)化学试卷2015-2016学年宁夏育才中学高一下期末化学试卷浙江省温州中学2016-2017学年高二下学期期中考试化学试题(已下线)【备战2019年浙江新高考-考点】——考点03 物质的量浓度及溶液的配制浙江省淳安县汾口中学2019-2020学年高二下学期期中考试化学试题
8 . 在标准状况下,进行甲、乙、丙三组实验,三组实验各取30mL同浓度的盐酸,加入同一种镁、铝混合物粉末,产生气体,有关数据列表如下:
(1)甲、乙两组实验中,哪一组盐酸是不足量的?_____________,理由是_____________。
(2)盐酸的物质的量浓度_____________。
(3)混合粉末中Mg的物质的量为_______________,Mg、Al的物质的量之比为__________。
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 765 | 1020 |
| 气体体积/mL | 560 | 672 | 672 |
(1)甲、乙两组实验中,哪一组盐酸是不足量的?_____________,理由是_____________。
(2)盐酸的物质的量浓度_____________。
(3)混合粉末中Mg的物质的量为_______________,Mg、Al的物质的量之比为__________。
您最近一年使用:0次
9 . 实验室中经常需配制一定浓度的NaOH溶液,现将22.0g NaOH固体溶于水配成100.0mL溶液,其密度为1.2g.mL﹣1.
(1)该溶液中NaOH的质量分数约为 .
(2)从该溶液中取出10.0mL,其中NaOH的物质的量浓度为 ,含NaOH的物质的量为 .
(3)将取出的10.0mL溶液加水稀释到100.0mL,稀释后溶液中NaOH的物质的量浓度为 .
(1)该溶液中NaOH的质量分数约为 .
(2)从该溶液中取出10.0mL,其中NaOH的物质的量浓度为 ,含NaOH的物质的量为 .
(3)将取出的10.0mL溶液加水稀释到100.0mL,稀释后溶液中NaOH的物质的量浓度为 .
您最近一年使用:0次
10 . (1)将7.8gNa2O2加入100g水中,充分反应后得到密度为1.02g/cm3的溶液。
①溶液的质量分数为____________ (保留3位小数)。
②溶液的物质的量浓度为______________ mol/L(保留2位小数)。
(2)有KCl、NaCl、Na2CO3的混合物,其中钠元素的质量分数为0.3150,氯为0.2708,为求算Na2CO3的质量分数,某同学列了以下关系式:(31.50÷23)+(100-31.50-27.08-x)÷39=(27.08÷35.5)+x÷60×2,解得x=28.25,则Na2CO3的质量分数为____________ (保留3位小数)。
(3)含不溶杂质的NaNO3样品,加入一定量蒸馏水使其充分溶解,情况如下:
NaNO3溶解度(g/100g水)如下:
①实验中加入的水为______________________ g;
②原样品中NaNO3为______________________ g。
(4)在450℃、1.50×107Pa条件下,Na2O与O2反应生成NaO 2,NaO 2可用于应急呼吸面罩:4NaO2+2CO 2=2Na2CO3+3O2、4NaO2+2H2O (g)+4CO2=4NaHCO3+3O2;某呼吸面罩中放置了500g NaO2,吸收CO2和H2O(g),每产生18.48L(换算为标准状况)O2时,固体的质量就增加13.30g。计算生成的Na2CO3和NaHCO3物质的量之比_____________ 。
①溶液的质量分数为
②溶液的物质的量浓度为
(2)有KCl、NaCl、Na2CO3的混合物,其中钠元素的质量分数为0.3150,氯为0.2708,为求算Na2CO3的质量分数,某同学列了以下关系式:(31.50÷23)+(100-31.50-27.08-x)÷39=(27.08÷35.5)+x÷60×2,解得x=28.25,则Na2CO3的质量分数为
(3)含不溶杂质的NaNO3样品,加入一定量蒸馏水使其充分溶解,情况如下:
| 温度(℃) | 10 | 40 | 75 |
| 剩余固体质量(g) | 201 | 132 | 72 |
NaNO3溶解度(g/100g水)如下:
| 温度(℃) | 10 | 40 | 70 |
| 溶解度 | 81 | 104 | 150 |
①实验中加入的水为
②原样品中NaNO3为
(4)在450℃、1.50×107Pa条件下,Na2O与O2反应生成NaO 2,NaO 2可用于应急呼吸面罩:4NaO2+2CO 2=2Na2CO3+3O2、4NaO2+2H2O (g)+4CO2=4NaHCO3+3O2;某呼吸面罩中放置了500g NaO2,吸收CO2和H2O(g),每产生18.48L(换算为标准状况)O2时,固体的质量就增加13.30g。计算生成的Na2CO3和NaHCO3物质的量之比
您最近一年使用:0次



