1 .  是重要的化工原料,也是应用广泛的化工产品。
是重要的化工原料,也是应用广泛的化工产品。 与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:
与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:
(1)某 中含有
中含有 ,该混合气体通入2.00LNaOH溶液中,
,该混合气体通入2.00LNaOH溶液中, 被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度(用C表示)范围为
被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度(用C表示)范围为___________ 。
(2) 和KO2有下列反应:
和KO2有下列反应:

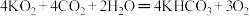
若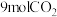 在密封舱内和
在密封舱内和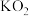 完全反应后生成
完全反应后生成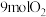 ,求反应前密封舱内
,求反应前密封舱内 的物质的量并列式计算
的物质的量并列式计算_____ 。
 是重要的化工原料,也是应用广泛的化工产品。
是重要的化工原料,也是应用广泛的化工产品。 与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:
与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:(1)某
 中含有
中含有 ,该混合气体通入2.00LNaOH溶液中,
,该混合气体通入2.00LNaOH溶液中, 被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度(用C表示)范围为
被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度(用C表示)范围为(2)
 和KO2有下列反应:
和KO2有下列反应:
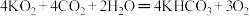
若
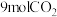 在密封舱内和
在密封舱内和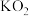 完全反应后生成
完全反应后生成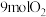 ,求反应前密封舱内
,求反应前密封舱内 的物质的量并列式计算
的物质的量并列式计算
您最近一年使用:0次
2014·上海·零模
解题方法
2 . 苯分子等芳香烃化合物里的氢原子被硫酸分子里的磺酸基(—SO3H)所取代的反应,称为磺化反应。浓硫酸有时也用SO3代替浓硫酸,其优点是____________________ 、____________________________________ 。(至少写出两点),用浓硫酸吸收SO3可得发烟硫酸(H2SO4·SO3)。某化工厂用1.5m3 98.3%的浓硫酸(密度为1.84g/mL)吸收SO3形成发烟硫酸,再与水混合,可得到95%的硫酸(密度为1.79g/mL)_____________ m3(保留2位小数)。
您最近一年使用:0次
2014·上海奉贤·二模
3 . 硝酸工业尾气中氮氧化物(NO 和NO2)是主要的大气污染物之一,可用氨氧混合气体进行选择性还原处理。其主要反应原理如下:4NO+4NH3+O2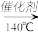 4N2+6H2O 6NO2+8NH3
4N2+6H2O 6NO2+8NH3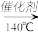 7N2+12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO NO2的物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
7N2+12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO NO2的物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
(1)尾气中氮氧化物的平均相对原子量为_____________ ;尾气中NO的含量为_____ mg/m3。
(2)要处理5m3的尾气,需要氨氧混合气的体积为_______ L。
另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积25%NaOH溶液(密度1.28g/cm3)完全吸收。
(3)NaOH溶液的物质的量浓度为_____________ mol/L,体积为_____ mL。
(4)已知反应后溶液含有0.35molNaNO2。若将尾气NO 和NO2的平均组成用NOx表示,则x=______
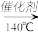 4N2+6H2O 6NO2+8NH3
4N2+6H2O 6NO2+8NH3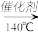 7N2+12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO NO2的物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
7N2+12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO NO2的物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。(1)尾气中氮氧化物的平均相对原子量为
(2)要处理5m3的尾气,需要氨氧混合气的体积为
另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积25%NaOH溶液(密度1.28g/cm3)完全吸收。
(3)NaOH溶液的物质的量浓度为
(4)已知反应后溶液含有0.35molNaNO2。若将尾气NO 和NO2的平均组成用NOx表示,则x=
您最近一年使用:0次
4 . 磷及部分重要化合物的相互转化如图所示。
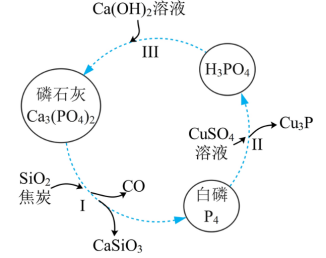
(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为______ 。
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有______ 。
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
(3)磷灰石中,碳元素的质量分数为______ %(保留两位小数)。
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4______ g(保留两位小数)。
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值______ 。

(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
| 成分 | CaO | P2O5 | SO3 | CO2 |
| 质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(3)磷灰石中,碳元素的质量分数为
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值
您最近一年使用:0次
名校
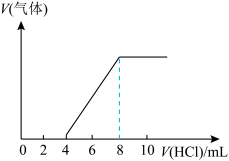
5 . 将一定量的Na2CO3和NaHCO3的混合物加热,充分反应至固体质量不再减少,生成CO2气体的体积为2.24L,反应后的固体残渣与100mLHCl溶液恰好完全反应,又生成CO2气体4.48L(气体体积均在标准状况下测定)。试求:
(1)原混合物中Na2CO3和NaHCO3的物质的量各为多少_________ ?
(2)所用HCl溶液的物质的量浓度_________ 。
(1)原混合物中Na2CO3和NaHCO3的物质的量各为多少
(2)所用HCl溶液的物质的量浓度
您最近一年使用:0次
2018-09-09更新
|
329次组卷
|
2卷引用:山西省2017年普通高中毕业会考化学试题样题
6 . 某浓硫酸的物质的量浓度为18.4mol/L,密度为1.84g/cm3。试计算:
(1)浓硫酸中溶质的质量分数______ 。
(2)配制100mL3.68mol/L的H2SO4溶液,需浓硫酸多少毫升______ ?
(1)浓硫酸中溶质的质量分数
(2)配制100mL3.68mol/L的H2SO4溶液,需浓硫酸多少毫升
您最近一年使用:0次
解题方法
7 . 工业制玻璃时,发生的主要反应的化学方程式为: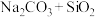

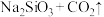
完成下列填空:
(1)钠原子核外具有______ 种不同能量的电子,钠元素在周期表中的位置为____________ 。
(2)在上述反应中,反应物和生成物的晶体类型共有_____ 种,写出气体产物的电子式_______________ 。
(3)上述物质中的非金属元素原子半径由大到小顺序为___________ (用元素符号表示),下列能判断它们的非金属性强弱的依据是:________ (选填编号)。
a. 气态氢化物的熔沸点 b. 最高价氧化物对应水化物的酸性
c. 气态氢化物的热稳定性 d. 三种元素两两形成的化合物中电子对偏向
(4)常温下,相同物质的量浓度的 和
和 溶液中,
溶液中,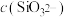
_____ 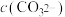 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(5)向10mL一定浓度的 溶液中逐滴加入0.1mol/L的稀盐酸,加入盐酸的体积与产生气体的体积有如图关系。由此可知原
溶液中逐滴加入0.1mol/L的稀盐酸,加入盐酸的体积与产生气体的体积有如图关系。由此可知原 溶液的物质的量浓度为
溶液的物质的量浓度为__________ 。在滴入盐酸的整个过程中,溶液中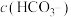 的变化情况是
的变化情况是______________ 。
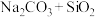

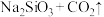
完成下列填空:
(1)钠原子核外具有
(2)在上述反应中,反应物和生成物的晶体类型共有
(3)上述物质中的非金属元素原子半径由大到小顺序为
a. 气态氢化物的熔沸点 b. 最高价氧化物对应水化物的酸性
c. 气态氢化物的热稳定性 d. 三种元素两两形成的化合物中电子对偏向
(4)常温下,相同物质的量浓度的
 和
和 溶液中,
溶液中,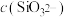
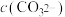 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(5)向10mL一定浓度的
 溶液中逐滴加入0.1mol/L的稀盐酸,加入盐酸的体积与产生气体的体积有如图关系。由此可知原
溶液中逐滴加入0.1mol/L的稀盐酸,加入盐酸的体积与产生气体的体积有如图关系。由此可知原 溶液的物质的量浓度为
溶液的物质的量浓度为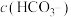 的变化情况是
的变化情况是
您最近一年使用:0次
名校
8 . 氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:
(1)过程Ⅰ:加NaOH溶液,调节pH至11后,并鼓入大量空气。用离子方程式表示加NaOH溶液的作用是______________ ;用化学平衡理论解释鼓入大置空气的目的__________________ 。
(2) II中加入适量NaClO溶液,控制pH在3~4,将NH4+转化为无毒物质。则反应的离子方程式是__________________ 。
(3)分别称取2.39 g (NH4)2SO4和NH4Cl固体混合物两份。
①将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]:n(NH4Cl)为__________ 。
②另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=_______ (溶液体积变化忽略不计)。
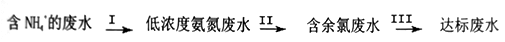
(1)过程Ⅰ:加NaOH溶液,调节pH至11后,并鼓入大量空气。用离子方程式表示加NaOH溶液的作用是
(2) II中加入适量NaClO溶液,控制pH在3~4,将NH4+转化为无毒物质。则反应的离子方程式是
(3)分别称取2.39 g (NH4)2SO4和NH4Cl固体混合物两份。
①将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]:n(NH4Cl)为
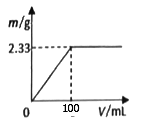
②另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=
您最近一年使用:0次
解题方法
9 . 氰化钠被广泛用于电镀、金的提取以及有机合成中,但含氰废水属于高毒类,必须对其进行处理。
(1)向NaCN溶液中通入CO2能发生反应:NaCN+H2O+CO2=HCN+NaHCO3,说明酸性:HCN_______ H2CO3(填“>”或“<”)。
(2)含CN-浓度较低的废水可直接用FeSO4·7H2O处理,得到一种蓝色沉淀M,M的摩尔质量为592 g·mol-1,则M的化学式为_______ 。
(3)pH在7.5〜10之间且铜作催化剂的条件下,用SO2-空气处理含氰废水会生成NH3、碳酸氢盐及硫酸盐,已知参与反应的SO2与O2的物质的量之比为1∶1,则该反应的离子方程式为_______ 。
(4)工业上常用碱性氯化法处理含氰废水,其原理如下图所示:
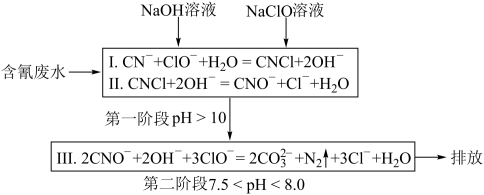
①第一阶段的中间体CNCl中碳元素的化合价为_______ 。
②某工厂含氰废水中NaCN的含量为14.7 mg·L-1,处理10m3这样的废水,理论上需要5 mol·L-1 NaClO溶液_______ L。
(1)向NaCN溶液中通入CO2能发生反应:NaCN+H2O+CO2=HCN+NaHCO3,说明酸性:HCN
(2)含CN-浓度较低的废水可直接用FeSO4·7H2O处理,得到一种蓝色沉淀M,M的摩尔质量为592 g·mol-1,则M的化学式为
(3)pH在7.5〜10之间且铜作催化剂的条件下,用SO2-空气处理含氰废水会生成NH3、碳酸氢盐及硫酸盐,已知参与反应的SO2与O2的物质的量之比为1∶1,则该反应的离子方程式为
(4)工业上常用碱性氯化法处理含氰废水,其原理如下图所示:

①第一阶段的中间体CNCl中碳元素的化合价为
②某工厂含氰废水中NaCN的含量为14.7 mg·L-1,处理10m3这样的废水,理论上需要5 mol·L-1 NaClO溶液
您最近一年使用:0次
2017-10-15更新
|
455次组卷
|
2卷引用:湖南三湘名校教育联盟2018届高三第一次大联考化学试题
解题方法
10 . 工业上制取氯酸钾的主要步骤为:
I.将Cl2通入石灰浆,在75℃左右充分反应,然后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KClO3固体。
请回答下列问题:
(1)步骤I中总反应的化学方程式为6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
①标出反应中电子转移的方向和数目______________ 。
②滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2]____ l∶5 (填“> ”“< ”、或“=” ) ,理由是____________________________________ 。
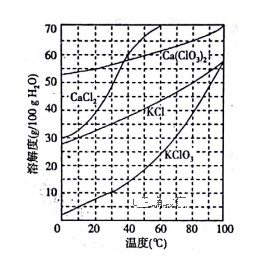
(2)下图是有关物质的溶解度曲线。步骤II中,若溶液中KClO3的含量为147g·L-1,则KClO3得物质的量浓度为_______________ 。从该溶液中尽可能多地析出KClO3 固体的方法是______________ 。
I.将Cl2通入石灰浆,在75℃左右充分反应,然后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KClO3固体。
请回答下列问题:
(1)步骤I中总反应的化学方程式为6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
①标出反应中电子转移的方向和数目
②滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2]
(2)下图是有关物质的溶解度曲线。步骤II中,若溶液中KClO3的含量为147g·L-1,则KClO3得物质的量浓度为

您最近一年使用:0次
2017-10-11更新
|
180次组卷
|
3卷引用:安徽省滁州市2018届高三9月联合质量检测化学试题



