名校
1 . 甲酸铜晶体[ ,难溶于冷水、乙醇]又称安息香酸铜,是一种有机化工原料。实验室制备
,难溶于冷水、乙醇]又称安息香酸铜,是一种有机化工原料。实验室制备 步骤如下:
步骤如下:
步骤 .称取12.5g
.称取12.5g  和9.5g
和9.5g  混合均匀研细,在快速搅拌条件下,将混合物分多次缓慢加至100mL已经近沸的蒸馏水中(此时停止加热),混合物加完后,再加热近沸几分钟。静置、过滤、洗涤,得到
混合均匀研细,在快速搅拌条件下,将混合物分多次缓慢加至100mL已经近沸的蒸馏水中(此时停止加热),混合物加完后,再加热近沸几分钟。静置、过滤、洗涤,得到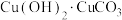 ;
;
步骤 .将
.将 所得
所得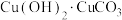 放入烧杯中,加入20mL蒸馏水,搅拌下加热至50℃,逐滴加入适量的HCOOH,使沉淀完全溶解,趁热过滤,蒸发滤液为原来体积的三分之一,用冰水浴冷却析晶。减压过滤,用少量乙醇洗涤、烘干后得到10.7g
放入烧杯中,加入20mL蒸馏水,搅拌下加热至50℃,逐滴加入适量的HCOOH,使沉淀完全溶解,趁热过滤,蒸发滤液为原来体积的三分之一,用冰水浴冷却析晶。减压过滤,用少量乙醇洗涤、烘干后得到10.7g  。
。
回答下列问题:
(1)实验室研细 和
和 的混合物所用的仪器名称为
的混合物所用的仪器名称为___________ 。
(2)若将混合物一次性加入100mL已经近沸的蒸馏水中,则产生的后果是___________ 。
(3)写出步骤 生成
生成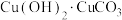 的离子方程式:
的离子方程式:___________ , 和
和 恰好完全反应时,
恰好完全反应时,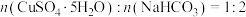 ,本实验
,本实验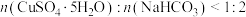 的原因是
的原因是___________ (任写一种)。
(4)简述步骤 检验
检验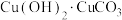 洗涤干净的操作:
洗涤干净的操作:___________ 。
(5)本实验 产率为
产率为___________ (保留三位有效数字)。
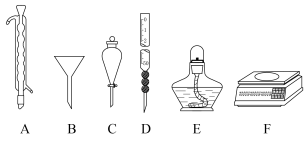
(6)下列仪器本实验用不到的是___________ (填字母)。
 ,难溶于冷水、乙醇]又称安息香酸铜,是一种有机化工原料。实验室制备
,难溶于冷水、乙醇]又称安息香酸铜,是一种有机化工原料。实验室制备 步骤如下:
步骤如下:步骤
 .称取12.5g
.称取12.5g  和9.5g
和9.5g  混合均匀研细,在快速搅拌条件下,将混合物分多次缓慢加至100mL已经近沸的蒸馏水中(此时停止加热),混合物加完后,再加热近沸几分钟。静置、过滤、洗涤,得到
混合均匀研细,在快速搅拌条件下,将混合物分多次缓慢加至100mL已经近沸的蒸馏水中(此时停止加热),混合物加完后,再加热近沸几分钟。静置、过滤、洗涤,得到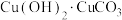 ;
;步骤
 .将
.将 所得
所得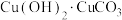 放入烧杯中,加入20mL蒸馏水,搅拌下加热至50℃,逐滴加入适量的HCOOH,使沉淀完全溶解,趁热过滤,蒸发滤液为原来体积的三分之一,用冰水浴冷却析晶。减压过滤,用少量乙醇洗涤、烘干后得到10.7g
放入烧杯中,加入20mL蒸馏水,搅拌下加热至50℃,逐滴加入适量的HCOOH,使沉淀完全溶解,趁热过滤,蒸发滤液为原来体积的三分之一,用冰水浴冷却析晶。减压过滤,用少量乙醇洗涤、烘干后得到10.7g  。
。回答下列问题:
(1)实验室研细
 和
和 的混合物所用的仪器名称为
的混合物所用的仪器名称为(2)若将混合物一次性加入100mL已经近沸的蒸馏水中,则产生的后果是
(3)写出步骤
 生成
生成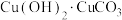 的离子方程式:
的离子方程式: 和
和 恰好完全反应时,
恰好完全反应时,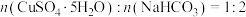 ,本实验
,本实验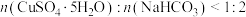 的原因是
的原因是(4)简述步骤
 检验
检验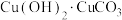 洗涤干净的操作:
洗涤干净的操作:(5)本实验
 产率为
产率为(6)下列仪器本实验用不到的是
您最近一年使用:0次
名校
2 . 锗是一种重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。如图为工业上利用湿法炼锌渣(主要含有 、
、 、
、 、
、 、
、 )制备高纯锗的工艺流程:
)制备高纯锗的工艺流程: 为两性化合物。②
为两性化合物。② 易水解,在浓盐酸中溶解度低。
易水解,在浓盐酸中溶解度低。
③常温下,部分金属阳离子转化为氢氧化物沉淀的pH见表。
④有机试剂丹宁沉淀金属离子的沉淀率见表。
(1)“浸出”时加热的目的是_______ ,该过程发生的主要反应为_______ ;浸出渣的主要成分是_______ (填化学式)。
(2)浸出后加入 溶液的作用是
溶液的作用是_______ (用离子方程式表示)。滤饼1中主要成分为一种,常温下调节溶液的pH范围为_______ 。如果不加 溶液,pH就需要调节到更大的数值,这样会造成
溶液,pH就需要调节到更大的数值,这样会造成_______ 的不良后果。
(3)“滤液2”中主要含有的金属阳离子是_______ (填离子符号)。
(4) 与纯水反应的化学方程式为
与纯水反应的化学方程式为_______ 。
(5)若含锗3.65%的湿法炼锌渣的质量为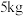 ,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为
,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为_______ 。
 、
、 、
、 、
、 、
、 )制备高纯锗的工艺流程:
)制备高纯锗的工艺流程: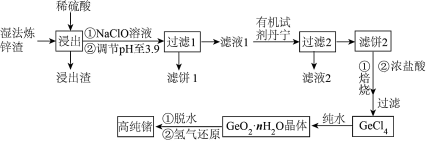
 为两性化合物。②
为两性化合物。② 易水解,在浓盐酸中溶解度低。
易水解,在浓盐酸中溶解度低。③常温下,部分金属阳离子转化为氢氧化物沉淀的pH见表。
| 离子 |  |  |  | 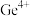 |
| 开始沉淀pH | 7.5 | 2.2 | 6.2 | 8.2 |
| 完全沉淀pH | 9.0 | 3.2 | 8.2 | 11.2 |
| 离子 |  |  |  | 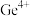 |
| 沉淀率(%) | 0 | 99 | 0 | 97~98.5 |
(2)浸出后加入
 溶液的作用是
溶液的作用是 溶液,pH就需要调节到更大的数值,这样会造成
溶液,pH就需要调节到更大的数值,这样会造成(3)“滤液2”中主要含有的金属阳离子是
(4)
 与纯水反应的化学方程式为
与纯水反应的化学方程式为(5)若含锗3.65%的湿法炼锌渣的质量为
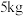 ,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为
,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为
您最近一年使用:0次
2024-04-21更新
|
256次组卷
|
2卷引用:四川省绵阳南山中学2024届高三下学期三诊热身考试理综-化学试题
解题方法
3 . 12-钨磷酸(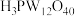 ,分子量:2880)是杂多化合物的代表物之一,实验室可通过乙醚萃取法合成。涉及的部分物质性质见下表:
,分子量:2880)是杂多化合物的代表物之一,实验室可通过乙醚萃取法合成。涉及的部分物质性质见下表:
【制备步骤】
Ⅰ.12-钨磷酸钠(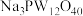 )溶液的制备
)溶液的制备
取 (分子量:330)和
(分子量:330)和 (分子量:178)于烧杯中,溶于80mL热水,边加热边搅拌下,向溶液中以细流加入14 mL浓盐酸,继续加热30 s。
(分子量:178)于烧杯中,溶于80mL热水,边加热边搅拌下,向溶液中以细流加入14 mL浓盐酸,继续加热30 s。
Ⅱ.12-钨磷酸的制备
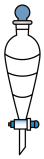
将烧杯中液体一并转移至分液漏斗中,加入205 mL乙醚及6 mL 6 mol/L的盐酸(均过量),振荡后静置,液体分三层,分出最下层液体于仪器 X 中,在通风橱内,置于热水浴中加热蒸除少量乙醚,得白色12-钨磷酸固体8.64 g。
(1)请用离子方程式表示步骤Ⅰ中12-钨磷酸钠的制备原理___________ ;
(2)“仪器X”为___________ ;
(3)步骤Ⅱ中,振荡分液漏斗制备12-钨磷酸时,需不时拧开分液漏斗活塞进行放气,这样操作的目的是___________ ;
(4)步骤Ⅱ中“液体分为三层”,最上层液体的主要成分为___________ (填代号);
a.乙醚 b.12-钨磷酸钠溶液 c.水 d.NaCl溶液
(5)步骤Ⅱ蒸除乙醚时,采用水浴加热而不采用明火加热的目的是___________ ;
(6)制备出的12-钨磷酸常因有灰尘、纸屑等有机纤维杂质落入而形成蓝色的“杂多蓝”,出现这一现象时,加入适量过氧化氢或溴水可使其恢复。上述实验现象可体现出12-钨磷酸常温下具有较强的___________ (填“氧化性”或“还原性”);
(7)根据上述实验数据计算,该实验的产率为___________ (设所得白色固体均为无水12-钨磷酸,结果保留两位有效数字);
(8)通过对X-射线衍射结果分析,得到12-钨磷酸根离子结构如下图,请回答:___________ ;
②12-钨磷酸根离子中存在___________ 种处于不同化学环境的氧原子。
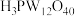 ,分子量:2880)是杂多化合物的代表物之一,实验室可通过乙醚萃取法合成。涉及的部分物质性质见下表:
,分子量:2880)是杂多化合物的代表物之一,实验室可通过乙醚萃取法合成。涉及的部分物质性质见下表:| 物质 | 性质 |
| 乙醚 | 无色液体,密度比水小且难溶于水,沸点34.5℃ |
| 12-钨磷酸 | 白色固体,能溶于水,常温下极易与乙醚形成密度大于水且难溶于水的油状醚合物 |
Ⅰ.12-钨磷酸钠(
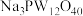 )溶液的制备
)溶液的制备取
 (分子量:330)和
(分子量:330)和 (分子量:178)于烧杯中,溶于80mL热水,边加热边搅拌下,向溶液中以细流加入14 mL浓盐酸,继续加热30 s。
(分子量:178)于烧杯中,溶于80mL热水,边加热边搅拌下,向溶液中以细流加入14 mL浓盐酸,继续加热30 s。Ⅱ.12-钨磷酸的制备
将烧杯中液体一并转移至分液漏斗中,加入205 mL乙醚及6 mL 6 mol/L的盐酸(均过量),振荡后静置,液体分三层,分出最下层液体于
(1)请用离子方程式表示步骤Ⅰ中12-钨磷酸钠的制备原理
(2)“仪器X”为
(3)步骤Ⅱ中,振荡分液漏斗制备12-钨磷酸时,需不时拧开分液漏斗活塞进行放气,这样操作的目的是
(4)步骤Ⅱ中“液体分为三层”,最上层液体的主要成分为
a.乙醚 b.12-钨磷酸钠溶液 c.水 d.NaCl溶液
(5)步骤Ⅱ蒸除乙醚时,采用水浴加热而不采用明火加热的目的是
(6)制备出的12-钨磷酸常因有灰尘、纸屑等有机纤维杂质落入而形成蓝色的“杂多蓝”,出现这一现象时,加入适量过氧化氢或溴水可使其恢复。上述实验现象可体现出12-钨磷酸常温下具有较强的
(7)根据上述实验数据计算,该实验的产率为
(8)通过对X-射线衍射结果分析,得到12-钨磷酸根离子结构如下图,请回答:
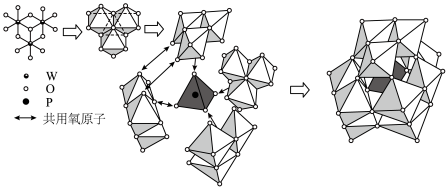
②12-钨磷酸根离子中存在
您最近一年使用:0次
4 . 将一定量的Fe、 、CuO的混合物放入100mL
、CuO的混合物放入100mL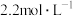 的
的 溶液中,充分反应后生成896ml。气体(标准状况下),得到不溶固体1.28g,过滤后,滤液中的金属离子只有
溶液中,充分反应后生成896ml。气体(标准状况下),得到不溶固体1.28g,过滤后,滤液中的金属离子只有 (假设滤液体积仍为100mL)。向滤液中滴加
(假设滤液体积仍为100mL)。向滤液中滴加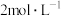 NaOH溶液,直至40mL时开始出现沉淀。下列说法错误的是
NaOH溶液,直至40mL时开始出现沉淀。下列说法错误的是
 、CuO的混合物放入100mL
、CuO的混合物放入100mL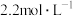 的
的 溶液中,充分反应后生成896ml。气体(标准状况下),得到不溶固体1.28g,过滤后,滤液中的金属离子只有
溶液中,充分反应后生成896ml。气体(标准状况下),得到不溶固体1.28g,过滤后,滤液中的金属离子只有 (假设滤液体积仍为100mL)。向滤液中滴加
(假设滤液体积仍为100mL)。向滤液中滴加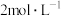 NaOH溶液,直至40mL时开始出现沉淀。下列说法错误的是
NaOH溶液,直至40mL时开始出现沉淀。下列说法错误的是| A.CuO的质量为1.6g |
B.未滴加NaOH溶液前滤液中 的物质的量浓度为 的物质的量浓度为 |
C.溶液中 和 和 消耗铁的物质的量之比为2:1 消耗铁的物质的量之比为2:1 |
| D.Fe在溶液中共参与了三个反应 |
您最近一年使用:0次
5 . 聚合硫酸铁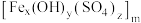 (铁元素化合价为
(铁元素化合价为 )是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:
)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:
①称取一定质量的聚合硫酸铁,配成 的溶液.
的溶液.
②准确量取 溶液,加入盐酸酸化的
溶液,加入盐酸酸化的 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体
溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体 .
.
③准确量取 溶液,加入足量的
溶液,加入足量的 溶液至沉淀完全,过滤、洗涤、灼烧至恒重,得到红棕色固体
溶液至沉淀完全,过滤、洗涤、灼烧至恒重,得到红棕色固体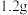 .
.
该聚合硫酸铁组成中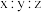 的值为
的值为
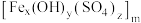 (铁元素化合价为
(铁元素化合价为 )是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:
)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:①称取一定质量的聚合硫酸铁,配成
 的溶液.
的溶液.②准确量取
 溶液,加入盐酸酸化的
溶液,加入盐酸酸化的 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体
溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体 .
.③准确量取
 溶液,加入足量的
溶液,加入足量的 溶液至沉淀完全,过滤、洗涤、灼烧至恒重,得到红棕色固体
溶液至沉淀完全,过滤、洗涤、灼烧至恒重,得到红棕色固体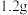 .
.该聚合硫酸铁组成中
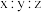 的值为
的值为A.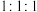 | B.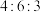 | C.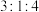 | D. |
您最近一年使用:0次
名校
6 . 现有一份“将二氧化硫转化为硫酸铵”的资料,摘录如下:
一个典型实例:初步处理后的废气含0.20%的二氧化硫和10%的氧气(体积分数)。在400℃时废气以5 m3·h-1的速率通过五氧化二钒催化剂层与20 L·h-1的速率的氨气混合,再喷水,此时气体温度由400℃降至200℃,在热的结晶装置中得到硫酸铵晶体(气体体积均已折算为标准状况)。利用上述资料,用氨来除去工业废气中的二氧化硫,回答下列问题:
(1)按反应中的理论值,二氧化硫和氧气的物质的量之比为2∶1,该资料中这个比值是___________ ,简述不采用2∶1的理由是___________ 。
(2)通过计算,说明为什么废气以5 m3·h-1的速率与20 L·h-1速率的氨气混合___________ 。
(3)若某厂每天排放1×104 m3这种废气,按上述方法该厂每月(按30天计)可得硫酸铵___________ 吨,消耗氨气___________ 吨。
一个典型实例:初步处理后的废气含0.20%的二氧化硫和10%的氧气(体积分数)。在400℃时废气以5 m3·h-1的速率通过五氧化二钒催化剂层与20 L·h-1的速率的氨气混合,再喷水,此时气体温度由400℃降至200℃,在热的结晶装置中得到硫酸铵晶体(气体体积均已折算为标准状况)。利用上述资料,用氨来除去工业废气中的二氧化硫,回答下列问题:
(1)按反应中的理论值,二氧化硫和氧气的物质的量之比为2∶1,该资料中这个比值是
(2)通过计算,说明为什么废气以5 m3·h-1的速率与20 L·h-1速率的氨气混合
(3)若某厂每天排放1×104 m3这种废气,按上述方法该厂每月(按30天计)可得硫酸铵
您最近一年使用:0次
名校
解题方法
7 . 完成下列两小题的计算:
(1)现有14.4gCO和CO2的混合气体,在标准状况下其体积为8.96L。
①该混合气体的平均摩尔质量为______ ,混合气体中碳原子的个数为______ (用NA表示阿伏加德罗常数)。
②将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
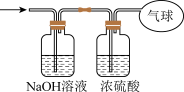
气球中收集到的气体的摩尔质量为______ ,气球的体积为______ 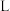 。
。
(2) 固体中含有部分
固体中含有部分 。取该固体
。取该固体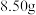 充分加热,产生的气体依次通过浓硫酸(增重
充分加热,产生的气体依次通过浓硫酸(增重 )和碱石灰(增重
)和碱石灰(增重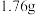 )。请计算:
)。请计算:
①加热分解产生的气体中 在标准状况下的体积为
在标准状况下的体积为______ L。
②固体中 的质量为
的质量为______ g。
③固体中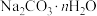 的
的 值为
值为______ 。
(1)现有14.4gCO和CO2的混合气体,在标准状况下其体积为8.96L。
①该混合气体的平均摩尔质量为
②将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。

气球中收集到的气体的摩尔质量为
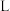 。
。(2)
 固体中含有部分
固体中含有部分 。取该固体
。取该固体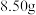 充分加热,产生的气体依次通过浓硫酸(增重
充分加热,产生的气体依次通过浓硫酸(增重 )和碱石灰(增重
)和碱石灰(增重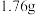 )。请计算:
)。请计算:①加热分解产生的气体中
 在标准状况下的体积为
在标准状况下的体积为②固体中
 的质量为
的质量为③固体中
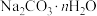 的
的 值为
值为
您最近一年使用:0次
2024-01-10更新
|
141次组卷
|
2卷引用:江西省宜春市丰城市第九中学2023-2024学年高一下学期4月月考化学试题
解题方法
8 . 称取8.00g氧化铜(CuO)和氧化铁(Fe2O3)的固体混合物,加入98g质量分数20%的硫酸充分溶解。往所得溶液中加入11.20g铁粉,充分反应后得到FeSO4溶液(溶液中不含Fe3+、Cu2+)与6.08g固体。则反应后溶液中溶质FeSO4的质量为_______ g;固体混合物中氧化铜的质量为_________ g。
您最近一年使用:0次
名校
解题方法
9 . 乙酰苯胺俗称退热冰,是常用的化工原料和重要的化学试剂。某实验小组拟用一定量的乙酸和苯胺制备一定量的乙酰苯胺,具体实验步骤如下:
步骤1:安装装置,检查好气密性后向100mL三颈烧瓶中加入5.0mL苯胺、7.4mL乙酸(足量)和0.1g锌粉,加入沸石后,加热微沸回流,控制温度计温度为105C左右,反应40~60min。
步骤2:冷却后取下三颈烧瓶,搅拌下趁热倒入100mL冷水中,剧烈搅拌,冷却至室温,抽滤,压干。用5~10mL冷水洗涤,抽滤,压干,得到粗品。
步骤3:粗产品用150mL热水溶解,稍冷后,加入约0.2g活性炭,搅拌下加热煮沸1~2min,趁热抽滤,将滤液自然冷却至室温,晶体析出,抽滤,压干,干燥,称重。
已知:
回答下列问题
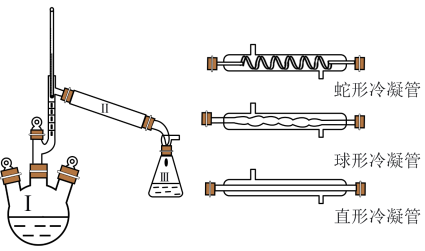
(1)Ⅱ处空白位置应选择的仪器为___________ (填“蛇形冷凝管”“球形冷凝管”或“直形冷凝管”);反应开始后发现忘加沸石,正确的操作为___________ 。
(2)步骤1中,发生反应的化学方程式是___________ ;温度计控温在105℃的原因是___________ 。
(3)步骤2中,用冷水进行洗涤的原因是___________ 。
(4)步骤3中,趁热抽滤的目的是___________ 。
(5)步骤3中,得到纯净乙酰苯胺6.3g,则实验产率为___________ (结果保留2位有效数字)。

步骤1:安装装置,检查好气密性后向100mL三颈烧瓶中加入5.0mL苯胺、7.4mL乙酸(足量)和0.1g锌粉,加入沸石后,加热微沸回流,控制温度计温度为105C左右,反应40~60min。
步骤2:冷却后取下三颈烧瓶,搅拌下趁热倒入100mL冷水中,剧烈搅拌,冷却至室温,抽滤,压干。用5~10mL冷水洗涤,抽滤,压干,得到粗品。
步骤3:粗产品用150mL热水溶解,稍冷后,加入约0.2g活性炭,搅拌下加热煮沸1~2min,趁热抽滤,将滤液自然冷却至室温,晶体析出,抽滤,压干,干燥,称重。
已知:
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(g/mL) | 溶解性 | |
| 乙酸 | 60 | 16.6 | 117.9 | 1.05 | 能溶于水、乙醇、乙醚 |
| 苯胺 | 93 | -6 | 184 | 1.022 | 微溶于水,易溶于乙醇、乙醚 |
| 乙酰苯胺 | 135 | 114 | 304 | 1.12 | 微溶于冷水,能溶于热水 |
(1)Ⅱ处空白位置应选择的仪器为
(2)步骤1中,发生反应的化学方程式是
(3)步骤2中,用冷水进行洗涤的原因是
(4)步骤3中,趁热抽滤的目的是
(5)步骤3中,得到纯净乙酰苯胺6.3g,则实验产率为
您最近一年使用:0次
名校
10 . 根据要求,完成下列各题:
(1)把含有 和
和 的混合溶液VL分成两等份,一份加入含a mol
的混合溶液VL分成两等份,一份加入含a mol 的溶液,恰好使
的溶液,恰好使 完全沉淀:另一份加入含bmol NaOH的溶液,恰好使
完全沉淀:另一份加入含bmol NaOH的溶液,恰好使 完全转化为沉淀,则原混合溶液中
完全转化为沉淀,则原混合溶液中 的数目为
的数目为___________ 。
(2)某气态氧化物化学式为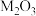 ,在标准状况下,1.52g该氧化物的体积是448mL,则M的摩尔质量为
,在标准状况下,1.52g该氧化物的体积是448mL,则M的摩尔质量为___________ 。
(3)标准状况下,把11.2L 通入一定量的过氧化钠固体中,充分反应后收集到8.96L气体,则这8.96L气体的质量是
通入一定量的过氧化钠固体中,充分反应后收集到8.96L气体,则这8.96L气体的质量是___________ g。
(4)现有下列10种物质:①铜②熔融NaCl③盐酸④液氯⑤ 晶体⑥胆矾⑦碳酸钙⑧
晶体⑥胆矾⑦碳酸钙⑧ ⑨氢氧化铁胶体⑩乙醇;上述物质中属于电解质的有
⑨氢氧化铁胶体⑩乙醇;上述物质中属于电解质的有___________ ,属于非电解质的有___________ ,能导电的有___________ 。(填序号)
(1)把含有
 和
和 的混合溶液VL分成两等份,一份加入含a mol
的混合溶液VL分成两等份,一份加入含a mol 的溶液,恰好使
的溶液,恰好使 完全沉淀:另一份加入含bmol NaOH的溶液,恰好使
完全沉淀:另一份加入含bmol NaOH的溶液,恰好使 完全转化为沉淀,则原混合溶液中
完全转化为沉淀,则原混合溶液中 的数目为
的数目为(2)某气态氧化物化学式为
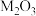 ,在标准状况下,1.52g该氧化物的体积是448mL,则M的摩尔质量为
,在标准状况下,1.52g该氧化物的体积是448mL,则M的摩尔质量为(3)标准状况下,把11.2L
 通入一定量的过氧化钠固体中,充分反应后收集到8.96L气体,则这8.96L气体的质量是
通入一定量的过氧化钠固体中,充分反应后收集到8.96L气体,则这8.96L气体的质量是(4)现有下列10种物质:①铜②熔融NaCl③盐酸④液氯⑤
 晶体⑥胆矾⑦碳酸钙⑧
晶体⑥胆矾⑦碳酸钙⑧ ⑨氢氧化铁胶体⑩乙醇;上述物质中属于电解质的有
⑨氢氧化铁胶体⑩乙醇;上述物质中属于电解质的有
您最近一年使用:0次
2023-12-23更新
|
155次组卷
|
2卷引用:2024届河南省焦作市博爱县第一中学高三一模化学试题



