名校
解题方法
1 . 根据所学知识,按要求填写下列空格。
(1)约含 个氧原子的
个氧原子的 的物质的量为
的物质的量为___________  ,与上述
,与上述 中所含原子总数相同的
中所含原子总数相同的 标准状况下体积是
标准状况下体积是___________ L;
(2) 硫酸铝溶液中,
硫酸铝溶液中,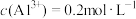 ,则
,则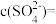
___________  ;将该溶液稀释至
;将该溶液稀释至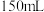 ,稀释后溶液中的
,稀释后溶液中的 的物质的量为
的物质的量为___________  。
。
(3) 某金属硝酸盐
某金属硝酸盐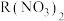 中含有
中含有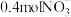 ,则
,则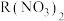 的摩尔质量为
的摩尔质量为___________ , 的相对原子质量为
的相对原子质量为___________ 。
(4)现有标准状况下 和
和 混合气体为
混合气体为 ,其质量为
,其质量为 ,则此混合气体中,
,则此混合气体中, 和
和 的物质的量之比为
的物质的量之比为___________ ,C和O原子个数比为___________ 。
(1)约含
 个氧原子的
个氧原子的 的物质的量为
的物质的量为 ,与上述
,与上述 中所含原子总数相同的
中所含原子总数相同的 标准状况下体积是
标准状况下体积是(2)
 硫酸铝溶液中,
硫酸铝溶液中,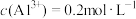 ,则
,则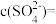
 ;将该溶液稀释至
;将该溶液稀释至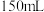 ,稀释后溶液中的
,稀释后溶液中的 的物质的量为
的物质的量为 。
。(3)
 某金属硝酸盐
某金属硝酸盐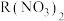 中含有
中含有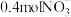 ,则
,则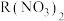 的摩尔质量为
的摩尔质量为 的相对原子质量为
的相对原子质量为(4)现有标准状况下
 和
和 混合气体为
混合气体为 ,其质量为
,其质量为 ,则此混合气体中,
,则此混合气体中, 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2 . 配制250mL0.125mol/L的NaOH溶液
(1)通过计算需要称量NaOH_______ g。进溶解、冷却后,需转移到_______ mL的容量瓶中,再洗掉烧杯、玻璃棒再将洗涤液转移到容量瓶中,最后,缓缓地把蒸馏水注入容量瓶,直到液面接近刻度_______ 处,改用_______ (仪器)加水到刻度线,使溶液的_______ 正好跟刻度线相切。塞好瓶塞,反复摇匀。
(2)配制稀的氢氧化钠溶液,也可用稀释法。如,取10mL 6mol/L的NaOH溶液加水稀释至100mL,溶液的物质的量浓度变为_______ mol/L。
(1)通过计算需要称量NaOH
(2)配制稀的氢氧化钠溶液,也可用稀释法。如,取10mL 6mol/L的NaOH溶液加水稀释至100mL,溶液的物质的量浓度变为
您最近一年使用:0次
名校
解题方法
3 . 下列说法正确的是
| A.某气体X相对氢气的密度是16,则该气体的摩尔质量为32 |
B.V L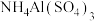 溶液中含a g 溶液中含a g  ,取此溶液 ,取此溶液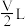 用水稀释为5V L,则稀释后溶液中 用水稀释为5V L,则稀释后溶液中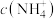 为 为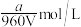 (不考虑水解) (不考虑水解) |
C.常温常压下,同质量的气体X和气体Y,体积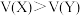 ,则摩尔质量 ,则摩尔质量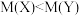 |
D.m g气体Y含分子数为b,则n g该气体在标准状况下体积为( 为阿伏加德罗常数的值) 为阿伏加德罗常数的值)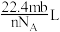 |
您最近一年使用:0次
2021-10-17更新
|
174次组卷
|
2卷引用:江西省抚州市临川区第十中学2022届高三月考化学试卷
解题方法
4 . 实验室用14mol/L浓硫酸配制90mL 2.0 mol/L稀硫酸。
(1)量筒量取浓硫酸的体积约是_______ mL。
(2)选用容量瓶的规格是_______(填字母)。
(3)除了上题的容量瓶外,该实验还需要的玻璃仪器有量筒、烧杯、_____ 。
(4)容量瓶上标有_______(填字母,下同)。
①温度 ②浓度 ③容积 ④压强 ⑤刻度线
(5)下列操作会导致所得溶液浓度偏低的是_______。
(1)量筒量取浓硫酸的体积约是
(2)选用容量瓶的规格是_______(填字母)。
| A.50 mL | B.100 mL | C.250 mL | D.500 mL |
(4)容量瓶上标有_______(填字母,下同)。
①温度 ②浓度 ③容积 ④压强 ⑤刻度线
| A.①③⑤ | B.①③④ | C.②④ | D.②④⑤ |
| A.配制中未用蒸馏水洗涤烧杯和玻璃棒 |
| B.定容时俯视容量瓶刻度线 |
| C.稀释后未冷却至室温即转移至容量瓶 |
| D.摇匀后发现液面低于刻度线再加水 |
您最近一年使用:0次
解题方法
5 . 实验是化学的基础,配制一定物质的量浓度溶液是必修1的重要实验,按要求填写下列空白。
(1)用固体配制溶液:某同学按下列步骤配制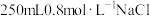 溶液。
溶液。
①实验室提供了以下仪器:烧杯、 量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是
量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是_______ 。在所缺少的仪器上无需有的标记是_______ (填字母序号)。
A.浓度B.温度C.刻度线D.容量
②实验步骤:
A.计算所需 的质量并用托盘天平称量
的质量并用托盘天平称量 的质量为
的质量为_______ g。
B.将 加入
加入 烧杯中,并加入适量水完全溶解后,将烧杯中溶液转移至一定容积的容量瓶中,为了防止溶液溅出,应采取的措施是
烧杯中,并加入适量水完全溶解后,将烧杯中溶液转移至一定容积的容量瓶中,为了防止溶液溅出,应采取的措施是_______ 。
C.向容量瓶中加蒸馏水至刻度线,在进行此操作时当加水至刻度线1~2厘米处应如何操作:_______ 。
③取出该 溶液
溶液 加水稀释到
加水稀释到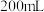 ,稀释后溶液中
,稀释后溶液中 的物质的量浓度是
的物质的量浓度是_______ 。
(2)用浓溶液配制稀溶液:实验室现需要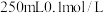 的盐酸溶液,准备用密度为
的盐酸溶液,准备用密度为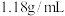 ,质量分数为36.5%浓盐酸来配制。
,质量分数为36.5%浓盐酸来配制。
①浓盐酸的物质的量浓度为_______  。
。
②配制 的盐酸溶液,用量筒量取浓盐酸的体积约为
的盐酸溶液,用量筒量取浓盐酸的体积约为_______  。
。
(3)误差分析:配制 溶液和稀盐酸时,以下操作会使结果偏高的是_______(填字母序号)。
溶液和稀盐酸时,以下操作会使结果偏高的是_______(填字母序号)。
(1)用固体配制溶液:某同学按下列步骤配制
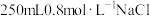 溶液。
溶液。①实验室提供了以下仪器:烧杯、
 量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是
量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是A.浓度B.温度C.刻度线D.容量
②实验步骤:
A.计算所需
 的质量并用托盘天平称量
的质量并用托盘天平称量 的质量为
的质量为B.将
 加入
加入 烧杯中,并加入适量水完全溶解后,将烧杯中溶液转移至一定容积的容量瓶中,为了防止溶液溅出,应采取的措施是
烧杯中,并加入适量水完全溶解后,将烧杯中溶液转移至一定容积的容量瓶中,为了防止溶液溅出,应采取的措施是C.向容量瓶中加蒸馏水至刻度线,在进行此操作时当加水至刻度线1~2厘米处应如何操作:
③取出该
 溶液
溶液 加水稀释到
加水稀释到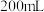 ,稀释后溶液中
,稀释后溶液中 的物质的量浓度是
的物质的量浓度是(2)用浓溶液配制稀溶液:实验室现需要
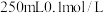 的盐酸溶液,准备用密度为
的盐酸溶液,准备用密度为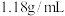 ,质量分数为36.5%浓盐酸来配制。
,质量分数为36.5%浓盐酸来配制。①浓盐酸的物质的量浓度为
 。
。②配制
 的盐酸溶液,用量筒量取浓盐酸的体积约为
的盐酸溶液,用量筒量取浓盐酸的体积约为 。
。(3)误差分析:配制
 溶液和稀盐酸时,以下操作会使结果偏高的是_______(填字母序号)。
溶液和稀盐酸时,以下操作会使结果偏高的是_______(填字母序号)。| A.量取浓盐酸时仰视读数 |
| B.混匀后液面低于刻度线,加水补齐 |
| C.定容时俯视容量瓶瓶颈的刻度线 |
D.未洗涤溶解 的烧杯 的烧杯 |
您最近一年使用:0次
21-22高一上·江苏苏州·期中
名校
解题方法
6 . 根据所学知识,回答下列问题:
(1)下列几种物质,其中属于电解质的是___________ ,属于弱电解质的是___________ (填序号)
①CO2②H2O③盐酸④KOH⑤BaSO4⑥NH3⑦冰醋酸⑧NaHCO3⑨酒精⑩H2S
(2)配制250mL0.1mol·L-1的盐酸,应用量筒量取密度为1.25g·mL-1,质量分数为36.5%浓盐酸体积___________ mL。
(3)高铁酸钾(K2FeO4)是种多功能绿色水处理剂,其中铁元素的化合价为+6价。制备高铁酸钾的反应体系中有六种微粒:FeO 、Fe(OH)3、Cl-、ClO-、OH-、H2O。
、Fe(OH)3、Cl-、ClO-、OH-、H2O。
①该反应在碱性条件下进行,请写出制备高铁酸钾的离子反应方程式___________ 。
②若该反应过程中转移了0.3mol电子,则还原产物的物质的量为___________ 。
(1)下列几种物质,其中属于电解质的是
①CO2②H2O③盐酸④KOH⑤BaSO4⑥NH3⑦冰醋酸⑧NaHCO3⑨酒精⑩H2S
(2)配制250mL0.1mol·L-1的盐酸,应用量筒量取密度为1.25g·mL-1,质量分数为36.5%浓盐酸体积
(3)高铁酸钾(K2FeO4)是种多功能绿色水处理剂,其中铁元素的化合价为+6价。制备高铁酸钾的反应体系中有六种微粒:FeO
 、Fe(OH)3、Cl-、ClO-、OH-、H2O。
、Fe(OH)3、Cl-、ClO-、OH-、H2O。①该反应在碱性条件下进行,请写出制备高铁酸钾的离子反应方程式
②若该反应过程中转移了0.3mol电子,则还原产物的物质的量为
您最近一年使用:0次
名校
解题方法
7 . 填空。
(1)同温同压下,等质量的 和
和 气体的体积比为
气体的体积比为___________ ,所含O原子数目之比为___________ 。
(2)配制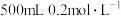 的稀HCl溶液,需要量取
的稀HCl溶液,需要量取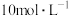 的浓HCl
的浓HCl___________ mL。
(3)2.4gC与一定量的 充分反应后得到混合气体的质量为6.4g,则混合气体中
充分反应后得到混合气体的质量为6.4g,则混合气体中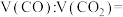
___________ 。
(1)同温同压下,等质量的
 和
和 气体的体积比为
气体的体积比为(2)配制
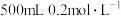 的稀HCl溶液,需要量取
的稀HCl溶液,需要量取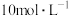 的浓HCl
的浓HCl(3)2.4gC与一定量的
 充分反应后得到混合气体的质量为6.4g,则混合气体中
充分反应后得到混合气体的质量为6.4g,则混合气体中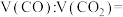
您最近一年使用:0次
20-21高一上·江苏镇江·阶段练习
名校
8 . 实验室用密度为1.19 g/mL、质量分数为36.5%的浓盐酸配制500 mL 0.100 mol/L盐酸。回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为_______ 。
(2)①该实验中需要用量筒量取上述浓盐酸的体积为_______
②该配制实验中所需要的主要玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、_______ 。
③定容时,向容量瓶中加蒸馏水至液面接近刻度线_______ 处,改用_______ 逐滴滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
(3)配制过程中,下列操作中会导致结果偏高的是_______ (填序号)。
①量取浓盐酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时有少量水
③稀释后立即移液
④移液时不小心有少量液体溅出
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)已知软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。
MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。
求①参加反应的HCl的质量_____
②反应后溶液中MnCl2的物质的量浓度_____ (反应前后溶液的体积不变)
(5)实验室为确定一瓶稀NaOH的浓度,用上述所配的盐酸溶液中和25.00mL该NaOH溶液,当酸与碱恰好完全反应时,消耗盐酸溶液22.50mL。试求该NaOH的物质的量浓度_____ 。
(1)该浓盐酸中HCl的物质的量浓度为
(2)①该实验中需要用量筒量取上述浓盐酸的体积为
②该配制实验中所需要的主要玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、
③定容时,向容量瓶中加蒸馏水至液面接近刻度线
(3)配制过程中,下列操作中会导致结果偏高的是
①量取浓盐酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时有少量水
③稀释后立即移液
④移液时不小心有少量液体溅出
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)已知软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)
 MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。
MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。求①参加反应的HCl的质量
②反应后溶液中MnCl2的物质的量浓度
(5)实验室为确定一瓶稀NaOH的浓度,用上述所配的盐酸溶液中和25.00mL该NaOH溶液,当酸与碱恰好完全反应时,消耗盐酸溶液22.50mL。试求该NaOH的物质的量浓度
您最近一年使用:0次
名校
9 . 回答下列问题:
(1)某同学将标准状况下44.8 L的HCl气体溶于水,配成500 mL的溶液。所配成的盐酸溶液的物质的量浓度为___________ ,稀释到2 L,此时盐酸溶液物质的量浓度为___________ 。
(2)在400mL 2 的
的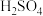 溶液中,溶质的质量是
溶液中,溶质的质量是___________ ,此溶液中的 的物质的量浓度为
的物质的量浓度为___________ 。
(3)在氨水溶液中,有多种微粒, 的摩尔质量为
的摩尔质量为___________ ,1mol  含有的电子数目为
含有的电子数目为___________ ,1mol  含有的质子数目为
含有的质子数目为___________ 。
(1)某同学将标准状况下44.8 L的HCl气体溶于水,配成500 mL的溶液。所配成的盐酸溶液的物质的量浓度为
(2)在400mL 2
 的
的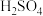 溶液中,溶质的质量是
溶液中,溶质的质量是 的物质的量浓度为
的物质的量浓度为(3)在氨水溶液中,有多种微粒,
 的摩尔质量为
的摩尔质量为 含有的电子数目为
含有的电子数目为 含有的质子数目为
含有的质子数目为
您最近一年使用:0次
解题方法
10 . 现需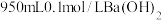 溶液,称取氢氧化钡晶体[
溶液,称取氢氧化钡晶体[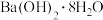 ](
](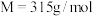 )配制。下列说法正确的是
)配制。下列说法正确的是
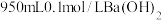 溶液,称取氢氧化钡晶体[
溶液,称取氢氧化钡晶体[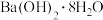 ](
](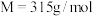 )配制。下列说法正确的是
)配制。下列说法正确的是A.应称量氢氧化钡晶体质量为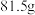 |
| B.容量瓶需用自来水、蒸馏水洗涤,干燥后才可用 |
| C.定容时俯视刻度线导致所配溶液物质的量浓度偏小 |
D.取所配溶液并加等体积水稀释,得到 溶液 溶液 |
您最近一年使用:0次



