1 . 氯及其化合物在生产生活中有重要的作用。
(1)已知某品牌的84消毒液和洁厕灵的部分标签如图所示:
①王女士在清洁马桶时,在倒入上述洁厕灵后将上述84消毒液也倒入其中,随后突然晕倒,送往医院抢救无效死亡。该过程发生反应的离子方程式为_______ 。
②已知“有效氯”的基本含义是指一定质量的这种消毒剂与多少质量的氯气的氧化能力相当,其数值可以用此时氯气的质量对消毒剂质量的百分比表示。例如,100g某84消毒液与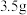 氯气的氧化能力相当,该产品的“有效氯”就是
氯气的氧化能力相当,该产品的“有效氯”就是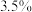 。
。
上述500mL“××牌84消毒液”中含有的 的质量为
的质量为_______ g(“有效氯”含量按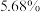 、溶液密度按
、溶液密度按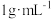 计算);现需要将原消毒液与水按
计算);现需要将原消毒液与水按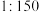 比例稀释后用于织物消毒。则稀释后的溶液中
比例稀释后用于织物消毒。则稀释后的溶液中 的浓度为
的浓度为_______ 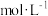 (忽略混合后溶液体积变化,保留两位有效数字)。
(忽略混合后溶液体积变化,保留两位有效数字)。
(2) 越来越多地取代以次氯酸盐为有效成分的漂白剂和消毒剂。其制取方法有多种,如图是其中的一种制取方法:
越来越多地取代以次氯酸盐为有效成分的漂白剂和消毒剂。其制取方法有多种,如图是其中的一种制取方法:
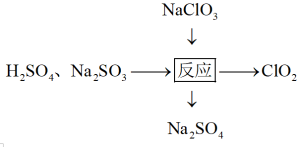
写出该反应的化学方程式并用单线桥表示电子转移的方向和数目_______ ,该反应的还原剂为_______ 。
(1)已知某品牌的84消毒液和洁厕灵的部分标签如图所示:
| ××牌洁厕灵 规格:1L 有效成分:盐酸,表面活性剂,香精 | ××牌84消毒液 规格:  有效成分:  (“有效氯”含量:  ) ) |
①王女士在清洁马桶时,在倒入上述洁厕灵后将上述84消毒液也倒入其中,随后突然晕倒,送往医院抢救无效死亡。该过程发生反应的离子方程式为
②已知“有效氯”的基本含义是指一定质量的这种消毒剂与多少质量的氯气的氧化能力相当,其数值可以用此时氯气的质量对消毒剂质量的百分比表示。例如,100g某84消毒液与
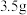 氯气的氧化能力相当,该产品的“有效氯”就是
氯气的氧化能力相当,该产品的“有效氯”就是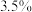 。
。上述500mL“××牌84消毒液”中含有的
 的质量为
的质量为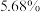 、溶液密度按
、溶液密度按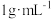 计算);现需要将原消毒液与水按
计算);现需要将原消毒液与水按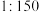 比例稀释后用于织物消毒。则稀释后的溶液中
比例稀释后用于织物消毒。则稀释后的溶液中 的浓度为
的浓度为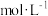 (忽略混合后溶液体积变化,保留两位有效数字)。
(忽略混合后溶液体积变化,保留两位有效数字)。(2)
 越来越多地取代以次氯酸盐为有效成分的漂白剂和消毒剂。其制取方法有多种,如图是其中的一种制取方法:
越来越多地取代以次氯酸盐为有效成分的漂白剂和消毒剂。其制取方法有多种,如图是其中的一种制取方法:
写出该反应的化学方程式并用单线桥表示电子转移的方向和数目
您最近一年使用:0次
2022-01-25更新
|
245次组卷
|
2卷引用:山东省威海市2021-2022学年高一上学期期末考试化学试题
名校
2 . 将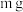 某二价金属氯化物溶于水中配成
某二价金属氯化物溶于水中配成 溶液,从中取出一半,再加水稀释到
溶液,从中取出一半,再加水稀释到 ,此时
,此时 的物质的量浓度为
的物质的量浓度为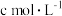 ,则此氯化物中金属原子的相对原子质量为
,则此氯化物中金属原子的相对原子质量为
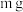 某二价金属氯化物溶于水中配成
某二价金属氯化物溶于水中配成 溶液,从中取出一半,再加水稀释到
溶液,从中取出一半,再加水稀释到 ,此时
,此时 的物质的量浓度为
的物质的量浓度为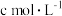 ,则此氯化物中金属原子的相对原子质量为
,则此氯化物中金属原子的相对原子质量为A.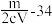 | B.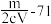 | C.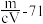 | D. |
您最近一年使用:0次
2021-11-06更新
|
725次组卷
|
5卷引用:四川省成都市蓉城名校联盟2021-2022学年高一上学期期中联考化学试题
四川省成都市蓉城名校联盟2021-2022学年高一上学期期中联考化学试题四川省遂宁市射洪中学2021-2022学年高一上学期第三次(12月)月考化学试题重庆市杨家坪中学2021-2022学年高一上学期第二次月考化学试题第三节 物质的量 第3课时 物质的量浓度(已下线)第12讲?物质的量浓度? -【暑假自学课】2024年新高一化学暑假提升精品讲义(人教版2019必修第一册)
2023高三·全国·专题练习
3 . 现有浓H3PO4质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的H3PO4溶液,则需浓H3PO4_______ mL(保留一位小数)。
您最近一年使用:0次
4 . 孔雀石铜矿(含Cu、Fe、Al等元素)是工业上提取铁、铜等金属的原材料,某工厂由孔雀石铜矿制备单质铜和绿矾( )的工艺流程如下:
)的工艺流程如下:
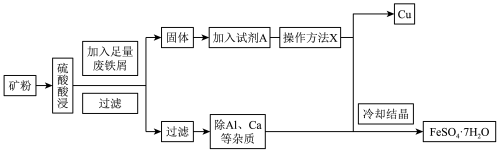
回答下列问题:
(1)试剂A为___________ ,此步骤涉及反应的离子方程式是___________ ,1molA参与上述反应转移电子的物质的量为___________ 。
(2)操作X是___________ 。
(3)实验室需要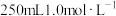 稀硫酸,化学小组用98%浓硫酸(
稀硫酸,化学小组用98%浓硫酸(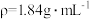 )配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。
)配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。
(4)将稀释后的硫酸转移到容量瓶之前需___________ 。若将稀释后的硫酸立即转移到容量瓶将使所配溶液的物质的量浓度___________ 。(填“偏高”“偏低”或“无影响”)
 )的工艺流程如下:
)的工艺流程如下:
回答下列问题:
(1)试剂A为
(2)操作X是
(3)实验室需要
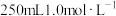 稀硫酸,化学小组用98%浓硫酸(
稀硫酸,化学小组用98%浓硫酸(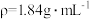 )配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。
)配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。| A.①③⑤⑦⑥ | B.②③⑦⑤⑥ | C.④③⑤⑦⑥ | D.①③⑦⑤⑥ |
您最近一年使用:0次
名校
5 . 某小组设计如下实验研究实验室中的甲酸。已知:25℃时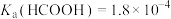
(1)配制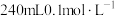 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为_______ mL。
(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴_______ 溶液,用 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是_______ (填字母)。
A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
(4)小组同学用_______ 测出25℃时该甲酸溶液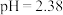 ,则水电离产生的
,则水电离产生的 数量级为
数量级为_______ 。
(5)25℃时甲酸与醋酸钠溶液反应: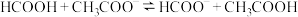 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数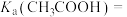
_______ 。
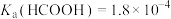
(1)配制
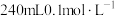 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴
 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
| A.滴定前应检查滴定管是否漏水,进行洗涤、润洗 |
| B.将标准溶液装入滴定管时,应借助玻璃棒或漏斗等玻璃仪器转移 |
| C.进行滴定操作时,眼睛要始终注视着滴定管内液面的变化 |
| D.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 |
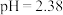 ,则水电离产生的
,则水电离产生的 数量级为
数量级为(5)25℃时甲酸与醋酸钠溶液反应:
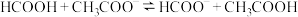 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数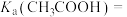
您最近一年使用:0次
2022-11-12更新
|
247次组卷
|
2卷引用:湖北省荆、荆、襄、宜四地七校考试联盟2022-2023学年高二上学期期中联考化学试题
名校
6 . 填空。
(1)工业上用_______ 和_______ 作为原料来制取漂白粉,反应的化学方程式为_______ 。漂白粉的有效成分是_______ ,漂白粉溶于水后,滴加少量盐酸可加快漂白和杀菌的速度,此过程中发生反应的化学方程式_______ 。
(2)从200 mL、5 mol/L Na2CO3溶液中取出20 mL溶液,其溶质的物质的量是_______ 。将取出的溶液稀释至100 mL,其Na+的物质的量浓度是_______ 。
(3)有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.2 mol/L, 的物质的量浓度为0.5 mol/L,则此溶液中K+的物质的量浓度为
的物质的量浓度为0.5 mol/L,则此溶液中K+的物质的量浓度为_______ 。
(4)在标准状况下,CO和CO2的混合气体共11.2 L,质量为18.8 g,其中含有_______ 个CO分子,该混合气体中CO与CO2的密度之比为_______ 。
(1)工业上用
(2)从200 mL、5 mol/L Na2CO3溶液中取出20 mL溶液,其溶质的物质的量是
(3)有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.2 mol/L,
 的物质的量浓度为0.5 mol/L,则此溶液中K+的物质的量浓度为
的物质的量浓度为0.5 mol/L,则此溶液中K+的物质的量浓度为(4)在标准状况下,CO和CO2的混合气体共11.2 L,质量为18.8 g,其中含有
您最近一年使用:0次
22-23高一上·全国·课时练习
解题方法
7 . 配制步骤
(1)配制100 mL 1.00 mol·L-1氯化钠溶液
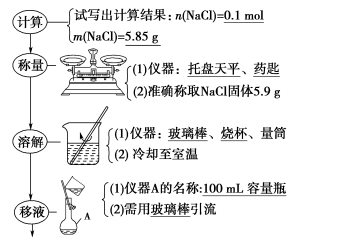
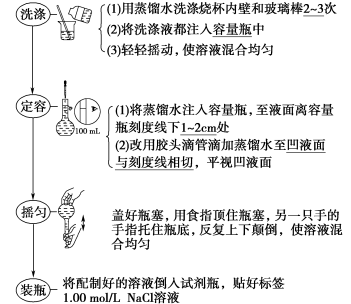
(2)用浓溶液稀释配制稀溶液
浓溶液稀释前后,溶液中溶质的物质的量不变,即得等式为:_______ 。
(3)注意事项:
①回答仪器应注明容量瓶规格,如500ml容量瓶。
②混合溶液不能直接体积相加和。
(1)配制100 mL 1.00 mol·L-1氯化钠溶液


(2)用浓溶液稀释配制稀溶液
浓溶液稀释前后,溶液中溶质的物质的量不变,即得等式为:
(3)注意事项:
①回答仪器应注明容量瓶规格,如500ml容量瓶。
②混合溶液不能直接体积相加和。
您最近一年使用:0次
名校
8 . 共和国勋章获得者钟南山院士强调,要注意疫情防控常态化,坚持做好日常消毒工作。常见的消毒剂有漂白粉、84消毒液(有效成分NaClO)、双氧水等。
Ⅰ.已知某“84消毒液”瓶体部分标签如下所示:84消毒液:(有效成分)NaClO;(规格)1000mL;(质量分数)25%;(密度)1.19g/cm3
(1)该“84消毒液”的物质的量浓度为_______  (计算结果保留两位有效数字)。
(计算结果保留两位有效数字)。
(2)“84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。写出反应的离子方程式:_______ ;
(3)实验室用 的浓盐酸配制
的浓盐酸配制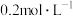 的盐酸240mL;得浓盐酸的体积为
的盐酸240mL;得浓盐酸的体积为_______ mL;使用的定量仪器有_______ 。
(4)84消毒液若与双氧水溶液混合减弱或失去杀菌消毒功能(反应产物之一是 ),解释原因
),解释原因_______ 。
Ⅱ.实验室制备84消毒液的装置如图1所示:
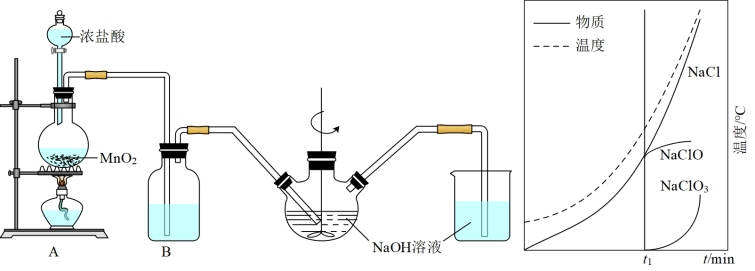
(5)装置B中盛放的试剂是_______ ;简述该装置对制取NaClO的作用_______ 。
(6)三颈烧瓶中生成各物质的物质的量和溶液的温度随时间的变化如图2所示。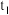 分钟后所发生主要反应的化学方程式为
分钟后所发生主要反应的化学方程式为_______ 。
Ⅰ.已知某“84消毒液”瓶体部分标签如下所示:84消毒液:(有效成分)NaClO;(规格)1000mL;(质量分数)25%;(密度)1.19g/cm3
(1)该“84消毒液”的物质的量浓度为
 (计算结果保留两位有效数字)。
(计算结果保留两位有效数字)。(2)“84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。写出反应的离子方程式:
(3)实验室用
 的浓盐酸配制
的浓盐酸配制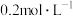 的盐酸240mL;得浓盐酸的体积为
的盐酸240mL;得浓盐酸的体积为(4)84消毒液若与双氧水溶液混合减弱或失去杀菌消毒功能(反应产物之一是
 ),解释原因
),解释原因Ⅱ.实验室制备84消毒液的装置如图1所示:

(5)装置B中盛放的试剂是
(6)三颈烧瓶中生成各物质的物质的量和溶液的温度随时间的变化如图2所示。
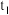 分钟后所发生主要反应的化学方程式为
分钟后所发生主要反应的化学方程式为
您最近一年使用:0次
名校
解题方法
9 . 关于如图所示过程的说法正确的是
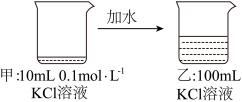

| A.甲比乙中溶质的质量分数小 | B.乙中 |
| C.乙比甲中KCl的溶解度大 | D.乙中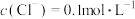 |
您最近一年使用:0次
2023-01-05更新
|
245次组卷
|
3卷引用:北京市东城区2022-2023学年高一上学期期末统一检测化学试卷
名校
解题方法
10 . 回答下列问题
(1)0.5 mol水中含有___________ 个氢原子。
(2)9g水与___________ g硫酸所含的分子数相等。
(3)欲配置500mL 0.6mol/L的NaOH溶液,需3mol/L的NaOH溶液___________ mL。
(4)标准状况下,和4mol 含有相同氢原子数的
含有相同氢原子数的 的体积为
的体积为___________ 。
(5)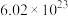 个
个 与
与___________ mol  质量相等。
质量相等。
(1)0.5 mol水中含有
(2)9g水与
(3)欲配置500mL 0.6mol/L的NaOH溶液,需3mol/L的NaOH溶液
(4)标准状况下,和4mol
 含有相同氢原子数的
含有相同氢原子数的 的体积为
的体积为(5)
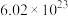 个
个 与
与 质量相等。
质量相等。
您最近一年使用:0次



