名校
解题方法
1 . 84消毒液、ClO2是常见的含氯消毒剂。
资料:84消毒液中含氟微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映物质的氧化一还原性,ORP值越大,氧化性越强。通常情况下,应将84消毒液原液稀释后使用;一般不用于衣服等纺织品的洗涤消毒。
(1)制备ClO2的一种反应为:2NaClO3+2NaCl+2H2SO4=2ClO2↑+Cl2↑+2Na2SO4+2H2O,用单线桥法标出其电子转移的方向和数目_______ 。
(2)取含次氯酸钠0.2mol·L-1的消毒液1mL,加水稀释至200mL,则稀释后次氯酸钠的物质的量浓度为_______ mol·L-1。
(3)为研究84消毒液的性质与使用条件,进行下列实验:
【实验1】向两支试管中分别加入2mL84消毒液,在试管l中加入2mL水,试管2中加入2mL白醋,再分别放入相同的红色纸片。观察到试管2中纸片褪色更快。
①实验中在试管l中加入2mL水的目的是_______ 。
②试管2中纸片褪色更快的原因是_______ 。
③如果实验中加浓盐酸,会有黄绿色气体产生,反应的离子方程式是_______ 。
【实验2】测定84消毒液在不同温度时ORP随时间的变化情况,结果如图所示。
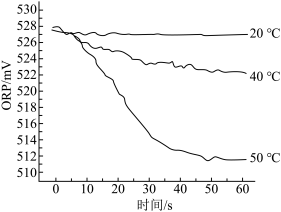
④实验表明,随温度升高,ORP值下降。50℃时ORP值下降较快的原因是_______ 。
资料:84消毒液中含氟微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映物质的氧化一还原性,ORP值越大,氧化性越强。通常情况下,应将84消毒液原液稀释后使用;一般不用于衣服等纺织品的洗涤消毒。
(1)制备ClO2的一种反应为:2NaClO3+2NaCl+2H2SO4=2ClO2↑+Cl2↑+2Na2SO4+2H2O,用单线桥法标出其电子转移的方向和数目
(2)取含次氯酸钠0.2mol·L-1的消毒液1mL,加水稀释至200mL,则稀释后次氯酸钠的物质的量浓度为
(3)为研究84消毒液的性质与使用条件,进行下列实验:
【实验1】向两支试管中分别加入2mL84消毒液,在试管l中加入2mL水,试管2中加入2mL白醋,再分别放入相同的红色纸片。观察到试管2中纸片褪色更快。
①实验中在试管l中加入2mL水的目的是
②试管2中纸片褪色更快的原因是
③如果实验中加浓盐酸,会有黄绿色气体产生,反应的离子方程式是
【实验2】测定84消毒液在不同温度时ORP随时间的变化情况,结果如图所示。

④实验表明,随温度升高,ORP值下降。50℃时ORP值下降较快的原因是
您最近一年使用:0次
2 . 已知,有一质量分数为40%的NaOH溶液,密度为1.42g/mL,求:
(1)该NaOH溶液的物质的量浓度为___________ ;
(2)取上述NaOH溶液50mL,加水稀释至355mL,稀释后的NaOH溶液的物质的量浓度为___________ ;
(3)将一定量的Na、Fe混合物投入足量水中,充分反应,共收集到气体44.8L(标准状况下),若将同质量、同组分的Na、Fe混合物投入足量盐酸中,充分反应,共收集到气体56.0L(标准状况下)。问:Na和Fe分别多少克___________ ?(该题请写出相应的计算过程,没过程不得分。)
(1)该NaOH溶液的物质的量浓度为
(2)取上述NaOH溶液50mL,加水稀释至355mL,稀释后的NaOH溶液的物质的量浓度为
(3)将一定量的Na、Fe混合物投入足量水中,充分反应,共收集到气体44.8L(标准状况下),若将同质量、同组分的Na、Fe混合物投入足量盐酸中,充分反应,共收集到气体56.0L(标准状况下)。问:Na和Fe分别多少克
您最近一年使用:0次
解题方法
3 . 实验室用14mol/L浓硫酸配制90mL 2.0 mol/L稀硫酸。
(1)量筒量取浓硫酸的体积约是_______ mL。
(2)选用容量瓶的规格是_______(填字母)。
(3)除了上题的容量瓶外,该实验还需要的玻璃仪器有量筒、烧杯、_____ 。
(4)容量瓶上标有_______(填字母,下同)。
①温度 ②浓度 ③容积 ④压强 ⑤刻度线
(5)下列操作会导致所得溶液浓度偏低的是_______。
(1)量筒量取浓硫酸的体积约是
(2)选用容量瓶的规格是_______(填字母)。
| A.50 mL | B.100 mL | C.250 mL | D.500 mL |
(4)容量瓶上标有_______(填字母,下同)。
①温度 ②浓度 ③容积 ④压强 ⑤刻度线
| A.①③⑤ | B.①③④ | C.②④ | D.②④⑤ |
| A.配制中未用蒸馏水洗涤烧杯和玻璃棒 |
| B.定容时俯视容量瓶刻度线 |
| C.稀释后未冷却至室温即转移至容量瓶 |
| D.摇匀后发现液面低于刻度线再加水 |
您最近一年使用:0次
4 . 回答下列问题。
(1)下列物质中:①SO2;②液态氯化氢;③CH4;④熔融NaOH;⑤NH4Cl固体;⑥氨水。属于混合物的是___________ (填序号,下同);能导电的是___________ ;属于电解质的是___________ ;属于非电解质的是___________ 。分别写出④和⑤的电离方程式:___________ 。
(2)2020年在抗击“新冠病毒”的战役中各种消毒试剂成为耀眼的明星,下面是几种常见的消毒药品:84消毒液(NaClO)、双氧水(H2O2)、臭氧(O3)、过氧乙酸(CH3COOOH)、氯气(Cl2)等。回答下面问题:
①过氧乙酸(CH3COOOH)的摩尔质量是___________ 。38gCH3COOOH中含有的O原子数为___________ NA,含有的H原子的物质的量为___________ 。
②过氧化氢(H2O2)极易分解,在MnO2催化作用下能完全分解为水和氧气,写出其化学方程式___________ 。过氧化氢的水溶液叫双氧水,2mol/L的双氧水500mL完全分解生成氧气的体积为___________ L(标准状态),转移电子数为___________ NA
③在相同状态下质量相同的臭氧和氯气,他们的物质的量之比为___________ ,原子个数之比为___________ ,密度之比为___________ 。
④84消毒液的有效成分为NaClO,同时还含有少量的NaCl,某84消毒液有效氯含量为3.55%,密度1.0g/mL,将此溶液稀释200倍后进行使用,此时c(NaClO) =___________ mol/L。
(1)下列物质中:①SO2;②液态氯化氢;③CH4;④熔融NaOH;⑤NH4Cl固体;⑥氨水。属于混合物的是
(2)2020年在抗击“新冠病毒”的战役中各种消毒试剂成为耀眼的明星,下面是几种常见的消毒药品:84消毒液(NaClO)、双氧水(H2O2)、臭氧(O3)、过氧乙酸(CH3COOOH)、氯气(Cl2)等。回答下面问题:
①过氧乙酸(CH3COOOH)的摩尔质量是
②过氧化氢(H2O2)极易分解,在MnO2催化作用下能完全分解为水和氧气,写出其化学方程式
③在相同状态下质量相同的臭氧和氯气,他们的物质的量之比为
④84消毒液的有效成分为NaClO,同时还含有少量的NaCl,某84消毒液有效氯含量为3.55%,密度1.0g/mL,将此溶液稀释200倍后进行使用,此时c(NaClO) =
您最近一年使用:0次
名校
解题方法
5 . 计算并回答下列问题:
(1)amol P和bmol Cl2恰好完全反应生成PCl3和PCl5的混合物,则混合物中PCl3和PCl5的物质的量之比为___________
(2)将标准状况下a L HCl溶解于m g的水中,得到盐酸溶液的物质的量浓度为b mol/L,则该盐酸溶液的密度为___________ g/cm3
(3)25℃时将Wg胆矾溶解在m g的水中,恰好得到饱和溶液,则该温度下,CuSO4的溶解度为___________ g
(4)将12mol/L的盐酸(密度为1.19g/ cm3)50mL稀释至6mol/L的盐酸(密度为1.10g/ cm3),需加水___________ mL
(5)某不纯的烧碱样品,含Na2CO3 3.8%、Na2O 5.8%、NaOH 90.4%。取M克样品,溶于40mL 2mol/L的盐酸中,并用2mol/L的NaOH溶液来中和剩余的盐酸至中性,把反应后的溶液蒸干后可得到固体质量是___________ g
(1)amol P和bmol Cl2恰好完全反应生成PCl3和PCl5的混合物,则混合物中PCl3和PCl5的物质的量之比为
(2)将标准状况下a L HCl溶解于m g的水中,得到盐酸溶液的物质的量浓度为b mol/L,则该盐酸溶液的密度为
(3)25℃时将Wg胆矾溶解在m g的水中,恰好得到饱和溶液,则该温度下,CuSO4的溶解度为
(4)将12mol/L的盐酸(密度为1.19g/ cm3)50mL稀释至6mol/L的盐酸(密度为1.10g/ cm3),需加水
(5)某不纯的烧碱样品,含Na2CO3 3.8%、Na2O 5.8%、NaOH 90.4%。取M克样品,溶于40mL 2mol/L的盐酸中,并用2mol/L的NaOH溶液来中和剩余的盐酸至中性,把反应后的溶液蒸干后可得到固体质量是
您最近一年使用:0次
名校
6 . Ⅰ.共和国勋章获得者钟南山院士强调,要注意疫情防控常态化,坚持做好日常消毒工作。含氯消毒剂在卫生防疫方面起着重要的作用。常见的含氯消毒剂有漂白粉、84消毒液等。
(1)漂白粉和84消毒液具有杀菌消毒功能,主要是因为两者均含有___________ (填离子符号)。
(2)以下实验能鉴别Ca(ClO)2溶液和NaClO溶液的是___________ (填字母序号)。
A.焰色反应 B.加入Na2CO3溶液 C.加入NaCl稀溶液
(3)84消毒液与双氧水溶液混合会发生反应,减弱杀菌消毒功能。该反应生成三种常见物质,其中一种是O2,写出反应的化学方程式:___________ 。
Ⅱ.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。回答下列问题:
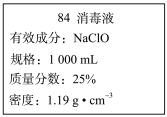
(4)该“84消毒液”的物质的量浓度约为___________ mol·L-1(计算结果保留两位有效数字)。
(5)某同学取50 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中所含钠离子的物质的量n(Na+)=___________ mol。
(6) “84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。实验室用12.5 mol·L-1的浓盐酸配制0.2 mol·L-1的盐酸240 mL。
①配制240 mL 0.2 mol·L-1的盐酸应量取浓盐酸的体积为___________ mL,应选用___________ mL的容量瓶。
②下列操作对所配溶液的浓度有何影响?(填“偏大”“偏小”或“无影响”)
A.定容时,俯视刻度线,浓度___________ ;
B.用量筒量取浓盐酸时俯视观察凹液面,浓度___________ ;
C.容量瓶在使用前未干燥,里面有少量蒸馏水,浓度___________ 。
(1)漂白粉和84消毒液具有杀菌消毒功能,主要是因为两者均含有
(2)以下实验能鉴别Ca(ClO)2溶液和NaClO溶液的是
A.焰色反应 B.加入Na2CO3溶液 C.加入NaCl稀溶液
(3)84消毒液与双氧水溶液混合会发生反应,减弱杀菌消毒功能。该反应生成三种常见物质,其中一种是O2,写出反应的化学方程式:
Ⅱ.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。回答下列问题:

(4)该“84消毒液”的物质的量浓度约为
(5)某同学取50 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中所含钠离子的物质的量n(Na+)=
(6) “84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。实验室用12.5 mol·L-1的浓盐酸配制0.2 mol·L-1的盐酸240 mL。
①配制240 mL 0.2 mol·L-1的盐酸应量取浓盐酸的体积为
②下列操作对所配溶液的浓度有何影响?(填“偏大”“偏小”或“无影响”)
A.定容时,俯视刻度线,浓度
B.用量筒量取浓盐酸时俯视观察凹液面,浓度
C.容量瓶在使用前未干燥,里面有少量蒸馏水,浓度
您最近一年使用:0次
2021-12-21更新
|
278次组卷
|
3卷引用:广西钦州市第一中学2021-2022学年高一上学期期中考试化学试题
名校
解题方法
7 . 下列关于物质的量浓度的说法正确的是
A.配制物质的量浓度为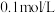 的 的 溶液 溶液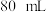 时,用托盘天平称取 时,用托盘天平称取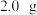 胆矾 胆矾 |
B.将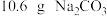 溶解在 溶解在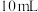 水中,再稀释成 水中,再稀释成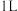 溶液,从中取出 溶液,从中取出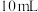 ,这 ,这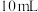 溶液的物质的量浓度为 溶液的物质的量浓度为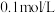 |
| C.配制稀盐酸用量筒量取浓盐酸时俯视刻度线,则所配溶液的浓度将偏高 |
D.实验室配制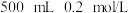 的 的 溶液,称量时若将 溶液,称量时若将 固体置于托盘天平右盘,将导致所配溶液浓度偏小 固体置于托盘天平右盘,将导致所配溶液浓度偏小 |
您最近一年使用:0次
名校
解题方法
8 . 某化学兴趣小组取4.6g Na投入99.6g滴有无色酚酞的水中,充分反应后得到密度为1.04g·cm-3的NaOH溶液。根据所学知识,按要求回答下列问题:
(1)该过程中发生反应的化学方程式为___________ 。
(2)该过程中生成的气体在标准状况下的体积为___________ L;反应过程中转移的电子数约为___________ 。
(3)所得NaOH溶液的物质的量浓度为___________ mol·L-1;从中取出5mL后,剩余NaOH溶液中c(Na+)=___________ mol·L-1。
(4)用量筒量取___________ mL上述所得NaOH溶液,可配得100mL 0.5mol·L-1 NaOH溶液。
(1)该过程中发生反应的化学方程式为
(2)该过程中生成的气体在标准状况下的体积为
(3)所得NaOH溶液的物质的量浓度为
(4)用量筒量取
您最近一年使用:0次
解题方法
9 . 已知20℃硝酸钾饱和溶液质量分数为24%,密度为1.1 g/cm3,下列说法正确的是
| A.20℃时硝酸钾在水中溶解度为24 g |
| B.20℃时硝酸钾溶液的物质的量浓度一定为2.61 mol/L |
| C.20℃,1 L硝酸钾饱和溶液中含有K+约2.61 mol |
| D.20℃时等体积硝酸钾饱和溶液与蒸馏水混合所得稀溶液溶质质量分数为12% |
您最近一年使用:0次
2021-12-07更新
|
234次组卷
|
5卷引用:江西省七校2021-2022学年高三上学期第一次联考化学试题
江西省七校2021-2022学年高三上学期第一次联考化学试题(已下线)解密02 物质的量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)安徽省肥东县圣泉中学2020-2021学年高一上学期期中考试化学试题(已下线)解密02 物质的量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)2.2.2 物质的量浓度相关计算(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)
名校
10 . 硫酸是一种重要的工业原料。
(1)稀硫酸具有酸性,其电离方程式为:___________ ;稀硫酸可以和 反应生成正盐和水,其反应的离子方程式为:
反应生成正盐和水,其反应的离子方程式为:___________ ;常用稀硫酸清洗铁锈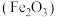 ,其反应的离子方程式为:
,其反应的离子方程式为:___________ 。
(2)某学生计划用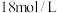 的浓硫酸配制
的浓硫酸配制 的稀硫酸500mL,需要量取浓硫酸的体积为
的稀硫酸500mL,需要量取浓硫酸的体积为___________ mL;除量筒、烧杯、试剂瓶外,还缺少的玻璃仪器有___________ 。
(3)有两份硫酸溶液,根据下表信息,回答有关问题:
①等质量两份溶液混合,则所得混合液中溶质的质量分数
___________ (用含有 和
和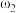 的代数式表示);
的代数式表示);
②已知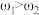 ,
,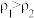 。取等体积的两份溶液混合,设所得混合液中溶质的质量分数为
。取等体积的两份溶液混合,设所得混合液中溶质的质量分数为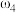 ,则
,则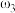
___________ 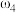 (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。
(4)在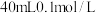 的
的 溶液中,加入足量
溶液中,加入足量 的
的 溶液使
溶液使 完全沉淀,将反应后的溶液过滤,用少量蒸馏水洗涤沉淀2-3次,将洗涤液和滤液合并后,取一半,加入
完全沉淀,将反应后的溶液过滤,用少量蒸馏水洗涤沉淀2-3次,将洗涤液和滤液合并后,取一半,加入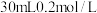 的NaOH溶液恰好反应呈中性,通过计算可知
的NaOH溶液恰好反应呈中性,通过计算可知 溶液体积为
溶液体积为___________ mL。
(5)在两份相同体积相同浓度的 溶液中,分别逐滴滴入物质的量浓度相等的
溶液中,分别逐滴滴入物质的量浓度相等的 、
、 溶液,其导电能力随滴入溶液体积变化的曲线如下图所示:
溶液,其导电能力随滴入溶液体积变化的曲线如下图所示:
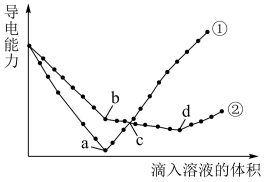
其中 和
和 反应的曲线为
反应的曲线为_____ 。(填①或②);滴定至b点时,溶液中主要存在的离子有___________ 。
(6)为方便计算,有人将98%浓硫酸表示成下列形式,其中合理的是_____ (填字母选项)。
A.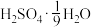 B.
B.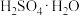
C.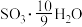 D.
D.
浓硫酸在加热条件下能和铜反应: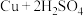 (浓)
(浓)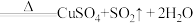 ,该反应中氧化剂和还原剂物质的量之比为
,该反应中氧化剂和还原剂物质的量之比为_____ 。
(1)稀硫酸具有酸性,其电离方程式为:
 反应生成正盐和水,其反应的离子方程式为:
反应生成正盐和水,其反应的离子方程式为: ,其反应的离子方程式为:
,其反应的离子方程式为:(2)某学生计划用
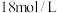 的浓硫酸配制
的浓硫酸配制 的稀硫酸500mL,需要量取浓硫酸的体积为
的稀硫酸500mL,需要量取浓硫酸的体积为(3)有两份硫酸溶液,根据下表信息,回答有关问题:
| 溶质的质量分数 | 溶液的密度 | |
| 第一份溶液 | 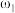 | 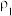 |
| 第二份溶液 | 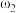 | 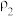 |
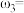
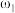 和
和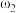 的代数式表示);
的代数式表示);②已知
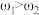 ,
,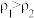 。取等体积的两份溶液混合,设所得混合液中溶质的质量分数为
。取等体积的两份溶液混合,设所得混合液中溶质的质量分数为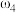 ,则
,则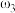
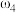 (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。(4)在
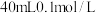 的
的 溶液中,加入足量
溶液中,加入足量 的
的 溶液使
溶液使 完全沉淀,将反应后的溶液过滤,用少量蒸馏水洗涤沉淀2-3次,将洗涤液和滤液合并后,取一半,加入
完全沉淀,将反应后的溶液过滤,用少量蒸馏水洗涤沉淀2-3次,将洗涤液和滤液合并后,取一半,加入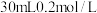 的NaOH溶液恰好反应呈中性,通过计算可知
的NaOH溶液恰好反应呈中性,通过计算可知 溶液体积为
溶液体积为(5)在两份相同体积相同浓度的
 溶液中,分别逐滴滴入物质的量浓度相等的
溶液中,分别逐滴滴入物质的量浓度相等的 、
、 溶液,其导电能力随滴入溶液体积变化的曲线如下图所示:
溶液,其导电能力随滴入溶液体积变化的曲线如下图所示:
其中
 和
和 反应的曲线为
反应的曲线为(6)为方便计算,有人将98%浓硫酸表示成下列形式,其中合理的是
A.
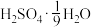 B.
B.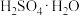
C.
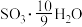 D.
D.
浓硫酸在加热条件下能和铜反应:
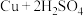 (浓)
(浓)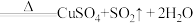 ,该反应中氧化剂和还原剂物质的量之比为
,该反应中氧化剂和还原剂物质的量之比为
您最近一年使用:0次



