名校
解题方法
1 . 还原反应在工农业生产和日常生活中有广泛运用
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是___________ ;
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有___________ 。 (填“氧化性”或“还原性”);
(3)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是___________ 。(填“氧化作用”或“还原作用”);
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是___________ ;
(5)Fe3+在工业上有重要用途。例如印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,生成CuCl2和FeCl2,写出离子方程式___________ 。
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有
(3)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是
(5)Fe3+在工业上有重要用途。例如印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,生成CuCl2和FeCl2,写出离子方程式
您最近一年使用:0次
2024-02-29更新
|
53次组卷
|
2卷引用:海南省海口市第一中学2023-2024学年高一上学期期末考试化学试题(重点班)
名校
2 . 如图列出了 十种元素在周期表中的位置:
十种元素在周期表中的位置:
(1)上述元素中,形成化合物最多的元素是___________ (填序号),M层电子数最多的是___________ (填元素名称),最高价氧化物对应的水化物酸性最强的是___________ (填酸的化学式)。
(2)由①、③、⑨三种元素形成的离子化合物的化学式为___________ 。
(3)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(4)元素④与⑤形成淡黄色化合物的电子式:___________ ,该化合物中含有的作用力有___________ 。
(5)⑤、⑦的最高价氧化物对应水化物相互反应的离子方程式为___________ 。
(6)请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系:___________ 。
 十种元素在周期表中的位置:
十种元素在周期表中的位置:
(1)上述元素中,形成化合物最多的元素是
(2)由①、③、⑨三种元素形成的离子化合物的化学式为
(3)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是
(4)元素④与⑤形成淡黄色化合物的电子式:
(5)⑤、⑦的最高价氧化物对应水化物相互反应的离子方程式为
(6)请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系:
您最近一年使用:0次
2024-02-22更新
|
81次组卷
|
2卷引用:安徽省阜阳市第三中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
3 . NaClO、 、
、 为常见高效的消毒剂和漂白剂。
为常见高效的消毒剂和漂白剂。
(1) 是国际上公认的安全绿色消毒剂。可用氯酸钠和H2O2溶液在酸性条件下制备,反应的化学方程式为
是国际上公认的安全绿色消毒剂。可用氯酸钠和H2O2溶液在酸性条件下制备,反应的化学方程式为 (未配平)。该反应中
(未配平)。该反应中 与
与 的化学计量数之比为
的化学计量数之比为___________ (不考虑 的分解)。
的分解)。
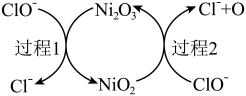
(2)①“84”消毒液的有效成分为NaClO。工业上常用碱性NaClO废液吸收 ,部分催化过程如图所示。“过程1”中
,部分催化过程如图所示。“过程1”中 是
是___________ (填“氧化剂”或“还原剂”),当 和
和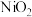 以物质的量之比1∶2发生“过程2”的反应,该反应的离子方程式为
以物质的量之比1∶2发生“过程2”的反应,该反应的离子方程式为___________ 。
②NaClO可在碱性条件下将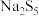 氧化为
氧化为 ,而自身被还原为NaCl,则
,而自身被还原为NaCl,则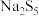 与NaClO的个数比为
与NaClO的个数比为___________ 。
(3)以氯酸钠、硫酸和二氧化硫为原料制备 ,进而再利用
,进而再利用 与
与 溶液反应制备亚氯酸钠(
溶液反应制备亚氯酸钠( ),具体流程如下:
),具体流程如下:
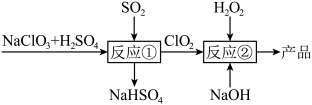
反应①的离子方程式为___________ ;理论上,该流程中参与反应的 与
与 的物质的量之比为
的物质的量之比为___________ 。
 、
、 为常见高效的消毒剂和漂白剂。
为常见高效的消毒剂和漂白剂。(1)
 是国际上公认的安全绿色消毒剂。可用氯酸钠和H2O2溶液在酸性条件下制备,反应的化学方程式为
是国际上公认的安全绿色消毒剂。可用氯酸钠和H2O2溶液在酸性条件下制备,反应的化学方程式为 (未配平)。该反应中
(未配平)。该反应中 与
与 的化学计量数之比为
的化学计量数之比为 的分解)。
的分解)。(2)①“84”消毒液的有效成分为NaClO。工业上常用碱性NaClO废液吸收
 ,部分催化过程如图所示。“过程1”中
,部分催化过程如图所示。“过程1”中 是
是 和
和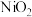 以物质的量之比1∶2发生“过程2”的反应,该反应的离子方程式为
以物质的量之比1∶2发生“过程2”的反应,该反应的离子方程式为
②NaClO可在碱性条件下将
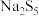 氧化为
氧化为 ,而自身被还原为NaCl,则
,而自身被还原为NaCl,则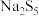 与NaClO的个数比为
与NaClO的个数比为(3)以氯酸钠、硫酸和二氧化硫为原料制备
 ,进而再利用
,进而再利用 与
与 溶液反应制备亚氯酸钠(
溶液反应制备亚氯酸钠( ),具体流程如下:
),具体流程如下:
反应①的离子方程式为
 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
4 . 化学的特征是从微观层次认识物质,以符号形式描述物质。下列反应的离子方程式书写正确的是
| 选项 | 反应 | 离子方程式 |
| A | 少量的 通入澄清石灰水中 通入澄清石灰水中 |  |
| B |  溶液中加入稀氨水 溶液中加入稀氨水 |  |
| C | 稀硫酸和氢氧化钡溶液反应 |  |
| D | 向 溶液中通入少量的 溶液中通入少量的 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . I.请回答。
(1)按照有机物的命名规则,下列命名正确的是___________ 。
A.3-乙基己烷 B.2-乙基戊烷, C.1,2-二甲基丁烷 D.4-甲基戊烷
写出该物质的结构简式:___________ 。
Ⅱ.如图所示,U形管的左端用橡胶塞封闭,充有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解可以忽略不计。将封闭有甲烷和氯气混合气体的装置放置在有漫射光的地方让混合气体缓慢反应一段时间。___________ (A升高;B降低;C不变);右端玻璃管的作用是___________ 。
(3)若水中含有Na2SiO3,则在U形管左端会观察到现象是___________ ;若水中含有AgNO3,则水中反应离子方程式___________ 。
(4)若题目中甲烷与氯气的体积比为1:1,则得到的产物为___________(填字母)。
(5)若把1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,试推测可观察到的现象是___________ 。
①黄绿色逐渐消失 ②试管壁上有黄色油珠出现
③水位在试管内上升到一定高度 ④水槽内有少量晶体析出
⑤液面上有白雾
(1)按照有机物的命名规则,下列命名正确的是
A.3-乙基己烷 B.2-乙基戊烷, C.1,2-二甲基丁烷 D.4-甲基戊烷
写出该物质的结构简式:
Ⅱ.如图所示,U形管的左端用橡胶塞封闭,充有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解可以忽略不计。将封闭有甲烷和氯气混合气体的装置放置在有漫射光的地方让混合气体缓慢反应一段时间。
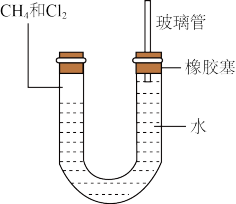
(3)若水中含有Na2SiO3,则在U形管左端会观察到现象是
(4)若题目中甲烷与氯气的体积比为1:1,则得到的产物为___________(填字母)。
| A.CH3Cl、HCl | B.CCl4、HCl |
| C.CH3Cl、CH2Cl2 | D.CH3Cl、CH2Cl2、CHCl3、CCl4、HCl |
(5)若把1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,试推测可观察到的现象是
①黄绿色逐渐消失 ②试管壁上有黄色油珠出现
③水位在试管内上升到一定高度 ④水槽内有少量晶体析出
⑤液面上有白雾
您最近一年使用:0次
2024-02-20更新
|
369次组卷
|
2卷引用:上海市曹杨第二中学2023-2024学年高二上学期化学期末卷
名校
解题方法
6 . 为探究 溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制 的
的 溶液,测其
溶液,测其 约为0.7,即
约为0.7,即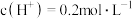 。
。
①用化学用语解释 溶液呈酸性的原因:
溶液呈酸性的原因:___________ 。
②下列实验方案中,能使 溶液
溶液 升高的是
升高的是___________ (填字母序号)。
a.加水稀释 b.加入 固体 c.滴加浓KSCN溶液 d.加入
固体 c.滴加浓KSCN溶液 d.加入 固体
固体
(2)小组同学利用上述 溶液探究其与足量锌粉的反应。实验操作及现象如表:
溶液探究其与足量锌粉的反应。实验操作及现象如表:
已知: 的性质与Al相似,能发生反应:
的性质与Al相似,能发生反应:
①红褐色沉淀是:___________ (化学式),其溶度积常数表达式Ksp=___________ ,结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:___________ 。
②用离子方程式解释反应后溶液为浅绿色的原因:___________ 。
③分离出黑色固体,经下列实验证实了其中含有的主要物质。
i.黑色固体可以被磁铁吸引;
ii.向黑色固体中加入足量的 溶液,产生气泡;
溶液,产生气泡;
iii.将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv.向iii反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是___________ 。
b.小组同学认为上述实验无法确定黑色固体中是否含有 ,理由是
,理由是___________ 。
(3)为进一步探究上述 溶液中
溶液中 和
和 氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
小组同学得出结论:在 溶液中,
溶液中, 的氧化性比
的氧化性比 更强。
更强。
 溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
溶液中的离子平衡和离子反应,某小组同学进行了如下实验。(1)配制
 的
的 溶液,测其
溶液,测其 约为0.7,即
约为0.7,即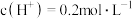 。
。①用化学用语解释
 溶液呈酸性的原因:
溶液呈酸性的原因:②下列实验方案中,能使
 溶液
溶液 升高的是
升高的是a.加水稀释 b.加入
 固体 c.滴加浓KSCN溶液 d.加入
固体 c.滴加浓KSCN溶液 d.加入 固体
固体(2)小组同学利用上述
 溶液探究其与足量锌粉的反应。实验操作及现象如表:
溶液探究其与足量锌粉的反应。实验操作及现象如表:| 操作 | 现象 |
向反应瓶中加入 锌粉,然后加入 锌粉,然后加入 的 的 溶液,搅拌 溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
 的性质与Al相似,能发生反应:
的性质与Al相似,能发生反应:
①红褐色沉淀是:
②用离子方程式解释反应后溶液为浅绿色的原因:
③分离出黑色固体,经下列实验证实了其中含有的主要物质。
i.黑色固体可以被磁铁吸引;
ii.向黑色固体中加入足量的
 溶液,产生气泡;
溶液,产生气泡;iii.将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv.向iii反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是
b.小组同学认为上述实验无法确定黑色固体中是否含有
 ,理由是
,理由是(3)为进一步探究上述
 溶液中
溶液中 和
和 氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
氧化性的相对强弱,继续实验并观察到反应开始时现象如表:| 操作 | 现象 |
将 的 的 溶液与 溶液与 锌粉混合 锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
将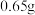 锌粉混合 锌粉混合 | 溶液中立即产生大量气泡 |
 溶液中,
溶液中, 的氧化性比
的氧化性比 更强。
更强。
您最近一年使用:0次
名校
7 . 镍氢电池是一种新型绿色电池,利用废旧镍氢电池的金属电极芯[主要成分为 、
、 及少量铁、铝的氧化物等]生产硫酸镍﹑碳酸钴,其工艺流程如图所示。
及少量铁、铝的氧化物等]生产硫酸镍﹑碳酸钴,其工艺流程如图所示。

已知:
① 和
和 都能与盐酸发生氧化还原反应。
都能与盐酸发生氧化还原反应。
②常温下,部分金属阳离子以氢氧化物的形式沉淀时溶液的pH见表:
提示:当离子浓度小于 时,认为该种离子沉淀完全。
时,认为该种离子沉淀完全。
回答下列问题:
(1)“步骤①”用稀硫酸浸取金属电极芯前,需先粉碎金属电极芯,粉碎的目的是_______________ 。常温下,0.05 的稀硫酸的pH=
的稀硫酸的pH=__________ ,若将该稀硫酸的温度升高到40℃,pH将__________ (填“增大”、“减小”或“不变”)。
(2)“步骤②”调pH的范围为__________ 。
(3)常温下, ,则m=
,则m=__________ 。
(4)“步骤④”中从环保角度分析不采用盐酸的原因是_______________________ 。
(5)“步骤⑤”制 的离子方程式为
的离子方程式为___________________________________ 。
(6) 在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料[
在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料[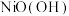 ]。该反应的离子方程式为
]。该反应的离子方程式为______________________________________ 。
 、
、 及少量铁、铝的氧化物等]生产硫酸镍﹑碳酸钴,其工艺流程如图所示。
及少量铁、铝的氧化物等]生产硫酸镍﹑碳酸钴,其工艺流程如图所示。
已知:
①
 和
和 都能与盐酸发生氧化还原反应。
都能与盐酸发生氧化还原反应。②常温下,部分金属阳离子以氢氧化物的形式沉淀时溶液的pH见表:
金属阳离子 |
|
|
|
|
|
|
开始沉淀时pH | 6.3 | 1.5 | 3.4 | 7.2 | — | 7.0 |
完全沉淀时pH | 8.3 | 2.8 | 4.7 | 9.1 | 1.1 | 9.0 |
 时,认为该种离子沉淀完全。
时,认为该种离子沉淀完全。回答下列问题:
(1)“步骤①”用稀硫酸浸取金属电极芯前,需先粉碎金属电极芯,粉碎的目的是
 的稀硫酸的pH=
的稀硫酸的pH=(2)“步骤②”调pH的范围为
(3)常温下,
 ,则m=
,则m=(4)“步骤④”中从环保角度分析不采用盐酸的原因是
(5)“步骤⑤”制
 的离子方程式为
的离子方程式为(6)
 在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料[
在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料[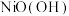 ]。该反应的离子方程式为
]。该反应的离子方程式为
您最近一年使用:0次
2023-12-05更新
|
303次组卷
|
4卷引用:期末押题卷02-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
(已下线)期末押题卷02-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)广东省清远市阳山县南阳中学2023-2024学年高二上学期第二次月考(期中)化学试题贵州省部分学校2023-2024学年高二上学期11月期中考试化学试题安徽省安庆市怀宁县高河中学2023-2024学年高二上学期第三次月考化学试题
解题方法
8 . 能正确表示下列反应的离子方程式是
| A.硫酸铝溶液中加入过量氨水:A13++3OH-=Al(OH)3↓ |
| B.冷的氢氧化钠溶液中通入氯气:Cl2+2OH-=ClO-+Cl-+H2O |
C.NaHSO4溶液与Ba(OH)2溶液混合: +Ba2+=BaSO4↓ +Ba2+=BaSO4↓ |
| D.Fe(OH)3溶解于盐酸中:OH-+H+=H2O |
您最近一年使用:0次
名校
解题方法
9 . 下列离子方程式书写正确的是
A.氢氧化钙溶液与过量的 溶液反应: 溶液反应: |
B.将铜片插入到稀 溶液中: 溶液中: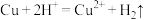 |
C.酸性 溶液中滴加 溶液中滴加 溶液: 溶液: |
D. 和 和 溶液反应至 溶液反应至 恰好沉淀: 恰好沉淀: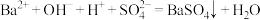 |
您最近一年使用:0次
名校
10 . 某学习小组将氯气和空气按体积比1∶3混合,通入含水 的碳酸钠中制备
的碳酸钠中制备 ,然后用水吸收
,然后用水吸收 制备次氯酸溶液。
制备次氯酸溶液。
ⅰ. 在饱和食盐水中溶解度很小,能与含水
在饱和食盐水中溶解度很小,能与含水 的碳酸钠反应生成
的碳酸钠反应生成 。
。
ⅱ. 极易溶于水生成
极易溶于水生成 ;
; 的沸点为
的沸点为 ,
, 以上分解为
以上分解为 和
和 。
。
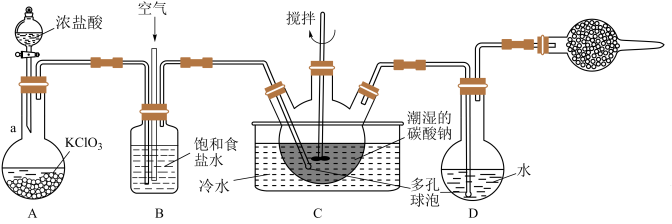
(1)仪器 的名称是
的名称是_________ ,A中发生反应的离子方程式为_________ 。
(2)实验中须控制 与空气(不参与反应)的体积比为
与空气(不参与反应)的体积比为 ,装置
,装置 的作用
的作用__________________ (答出2条即可)
(3)装置 中生成
中生成 ,反应的化学方程式为
,反应的化学方程式为__________________ 。
(4)将制得的 溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:①
溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:① 与
与 发生中和反应,②
发生中和反应,②____________ 。设计实验探究溶液红色褪去的原因___________________________ 。
(5)测定装置D中 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为______  (
( 可被
可被 还原成
还原成 )。
)。
 的碳酸钠中制备
的碳酸钠中制备 ,然后用水吸收
,然后用水吸收 制备次氯酸溶液。
制备次氯酸溶液。ⅰ.
 在饱和食盐水中溶解度很小,能与含水
在饱和食盐水中溶解度很小,能与含水 的碳酸钠反应生成
的碳酸钠反应生成 。
。ⅱ.
 极易溶于水生成
极易溶于水生成 ;
; 的沸点为
的沸点为 ,
, 以上分解为
以上分解为 和
和 。
。
(1)仪器
 的名称是
的名称是(2)实验中须控制
 与空气(不参与反应)的体积比为
与空气(不参与反应)的体积比为 ,装置
,装置 的作用
的作用(3)装置
 中生成
中生成 ,反应的化学方程式为
,反应的化学方程式为(4)将制得的
 溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:①
溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:① 与
与 发生中和反应,②
发生中和反应,②(5)测定装置D中
 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为 (
( 可被
可被 还原成
还原成 )。
)。
您最近一年使用:0次
2023-08-22更新
|
746次组卷
|
5卷引用:专题04 钠、氯及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
(已下线)专题04 钠、氯及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册) 山东省淄博实验中学2022-2023学年高一上学期期末考试化学试题黑龙江省大庆铁人中学2023-2024学年高一上学期期末考试化学试题海南省白沙学校2023-2024学年高一上学期期末考试化学试题四川省射洪中学校2023-2024学年高一(强基班)上学期第三次月考化学试题








