名校
解题方法
1 . 为从粗食盐水中除去 、
、 、
、 等离子,以制得精盐水,某同学设计如下方案:
等离子,以制得精盐水,某同学设计如下方案:
 、
、 、
、 等离子,以制得精盐水,某同学设计如下方案:
等离子,以制得精盐水,某同学设计如下方案: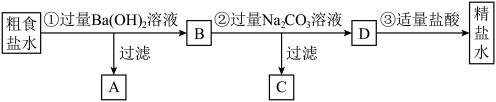
A. 中主要有 中主要有 和 和 ,也可能有一些 ,也可能有一些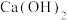 |
B.②中加入过量 溶液的主要目的是为了除去 溶液的主要目的是为了除去 、 、 |
C. 中主要只有 中主要只有 、 、 、 、 这3种离子 这3种离子 |
D.③中发生的反应只有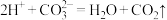 |
您最近一年使用:0次
2024-01-27更新
|
214次组卷
|
29卷引用:北京市昌平区2019-2020学年高一上学期期末考试化学试题
北京市昌平区2019-2020学年高一上学期期末考试化学试题北京市房山区2020-2021学年高一上学期期末考试化学试题北京市第二中学2022-2023学年高一上学期11月月考化学试题北京师范大学第二附属中学2023-2024学年高一下学期3月化学测试题辽宁省营口市2020-2021学年高一上学期期末考试化学试题专题3 第三单元 海洋化学资源的综合利用-高中化学苏教2019版必修第一册河南省濮阳市油田第一中学2021年高一上学期第一次月考化学试题云南省昆明市第三中学2021-2022学年高一下学期期中考试化学试题江苏省盐城市2021-2022学年高一下学期期末考试化学试题湖北省武汉市第十一中学2022-2023学年高一上学期10月月考化学试题浙江省嘉善中学2022-2023学年高一上学期10月份检测化学试题四川省成都外国语学校2022-2023学年高一上学期期中考试化学试题福建省厦门市第十中学2022-2023学年高一上学期期中考试化学试题天津市和平区2022-2023学年高一上学期期末考试化学试题陕西省西安市鄠邑区2022-2023学年高一下学期期中考试化学试题山西省实验中学2023-2024学年高一上学期第一次月考化学试题河南省焦作市博爱县第一中学2023-2024学年高三上学期9月月考化学试题福建省厦门市翔安第一中学2023-2024学年高三上学期10月月考化学试题福建省三明第一中学2023-2024学年高一上学期期中考试化学试题四川省宜宾市叙州区第二中学校2023-2024学年高二上学期10月月考化学试题河南省焦作市博爱县第一中学2023-2024学年高二上学期10月月考化学试题福建省厦门市湖滨中学2023-2024学年高一上学期期中考试化学试题福建省福清西山学校2023-2024学年高一上学期12月月考化学试题福建省三明市五校2023-2024学年高一上学期期中联考化学试题湖南省衡阳市衡阳县2023-2024学年高一上学期1月期末考试化学试题黑龙江省鸡西市密山市2023-2024学年高二上学期9月月考化学试题四川省绵阳市三台中学2023-2024学年高一下学期3月月考化学试题5.1.3 硫酸根离子检验、粗盐的提纯 随堂练习安徽省合肥市第一六八中2023-2024学年高一下学期期中考试化学试题
名校
解题方法
2 . PbO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱。下列反应在水溶液中不可能发生的是
| A.Cu+2Fe3+=Cu2++2Fe2+ | B.10Cl-+2MnO +16H+=2Mn2++5Cl2↑+8H2O +16H+=2Mn2++5Cl2↑+8H2O |
| C.2Fe2++Cl2=2Fe3++2Cl- | D.5Pb2++2MnO +2H2O=5PbO2+2Mn2++4H+ +2H2O=5PbO2+2Mn2++4H+ |
您最近一年使用:0次
2024-01-06更新
|
158次组卷
|
62卷引用:北京市朝阳区中国人民大学附属中学朝阳学校2019-2020学年高一上学期10月月考化学试卷
北京市朝阳区中国人民大学附属中学朝阳学校2019-2020学年高一上学期10月月考化学试卷2016届河北省冀州中学高三上学期期中测试化学试卷2016届广西钦州市钦南区高三上学期期中质量调研测试化学试卷2016-2017学年新疆生产建设兵团二中高一上期中化学卷2016-2017学年安徽省六安市第一中学高一下学期开学考试化学试卷内蒙古包头市第一中学2017-2018学年高一上学期期中考试化学试题河北省衡水市安平中学2017-2018学年高一上学期期中考试(普通班)化学试题四川省石室中学2017-2018学年高一上学期半期考试化学试题云南省玉溪市新平县第一中学2018-2019学年高二入学分班考试化学试题【全国百强校】陕西省西安市长安区第一中学2018-2019学年高一上学期期中考试化学试题吉林省白城市第一中学2018-2019学年高二下学期期末考试化学试题湖南省衡阳县第四中学2019-2020学年高一(菁华班)10月月考化学试题辽宁省阜新市海州高级中学2019-2020学年高一10月月考化学试题吉林省蛟河市友好学校2019-2020学年高一上学期期中联考化学试题(已下线)【新东方】高中化学5037河北省承德第一中学2019-2020学年高一上学期期中考试化学试题云南省普洱市孟连县第一中学2019—2020学年高一上学期期末考试化学试题(已下线)衔接点07 氧化剂和还原剂-2020年【衔接教材·暑假作业】初高中衔接化学(已下线)4.2.2 氧化还原方程式的配平练习(2)——《高中新教材同步备课》(苏教版 必修第一册)人教版(2019)高一必修第一册第一章 物质及其变化 第三节 氧化还原反应 课时2 氧化剂和还原剂人教版(2019)高一必修第一册 第一章 第三节综合训练鲁科版(2019)高一必修第一册第2章 元素与物质世界 第3节 氧化还原反应 综合训练黑龙江省双鸭山市第一中学2020-2021学年高一10月月考化学试题(已下线)【新东方】【2020】【高一上】【第一次月考】【JTX】【化学】河北省石家庄市辛集市第二中学2020-2021学年高一上学期10月月考化学试题山东省济南市商河县第一中学2020-2021学年高一上学期10月月考化学试题黑龙江省绥化市第一中学2020-2021学年高一上学期第二次月考化学试题四川省江油市第一中学2020-2021学年高一上学期期中考试化学试题广东省广州市天河区广州中学2020-2021学年高一上学期期中考试化学试题四川省绵阳三台县芦溪中学2020-2021学年高一上学期第三次月考化学试题重庆实验中学2020-2021学年高一上学期第一阶段测试化学试题吉林省辽源五中2020-2021学年高一上学期期中考试化学试题新疆乌鲁木齐市第八中学2019-2020学年高一上学期第二次月考化学试题(已下线)衔接点07 氧化剂和还原剂-2021年初升高化学无忧衔接第3课时 氧化还原反应的基本规律和配平(课后)——课前、课中、课后同步专题精编(人教版2019必修第一册)宁夏银川唐徕回民中学2021-2022学年高一11月月考化学试题广东省深圳市福田区外国语高级中学2021-2022学年高一上学期期中考试化学试题湖北省巴东一中2020-2021学年高一上学期第五次月考化学试题(已下线)衔接点12 氧化剂和还原剂-2022年初升高化学无忧衔接?黑龙江哈尔滨师范大学附属中学2021-2022学年高二下学期期末测试化学试题河北省石家庄市第四中学2022-2023学年高一上学期10月月考化学试题安徽省六安第一中学2022-2023学年高一上学期期中考试化学试题湖北省襄阳市第五中学2021-2022学年高一上学期10月考试化学试题湖南省怀化市中方县第一中学2022-2023学年高一上学期9月份月考化学试题广东省广州市第六中学2022-2023学年高一上学期 (线上)期中考试化学试题广东省广州市番禺区洛城中学2022-2023学年高一上学期第一次月考化学试题海南省海口市第一中学2022-2023学年高一上学期期中考试化学试题江西省万载中学创新班2022-2023学年高一下学期期中考试化学试题广东省惠州市实验中学2022-2023学年高一上学期期中考试化学试题作业(六) 氧化剂和还原剂广东省江门市培英高级中学2023-2024学年高一上学期期中考试化学试题宁夏石嘴山市第三中学2023-2024学年高一9月月考化学试题浙江省钱塘联盟2023-2024学年高一上学期期中联考化学试卷陕西省汉中市校际2023-2024学年高一上学期期中联考化学试题江西省南昌市第一中学2022-2023学年高一上学期11月期中考试化学试题广东省江门市第一中学2023-2024学年高一上学期第二次段考化学试题江西省宜春市上高二中2023-2024学年高一上学期第三次月考化学试题 湖南省永州市蓝山县第二中学2023-2024学年高一上学期第三次月考化学试卷四川省广安市岳池中学2023-2024学年高一上学期期中考试化学试题湖南省泸溪县第二中学2023-2024学年高一上学期第一次月考化学试题湖南省衡阳市耒阳市正源学校2023-2024学年高一下学期3月月考化学试题山西省大同市浑源县第七中学校2023-2024学年高一上学期第二次月考化学试题
3 . 在两份相同的 溶液中,分别滴入物质的量浓度相等的
溶液中,分别滴入物质的量浓度相等的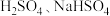 溶液,其导电能力随滴入溶液体积变化的曲线如下图所示.下列分析不正确的是
溶液,其导电能力随滴入溶液体积变化的曲线如下图所示.下列分析不正确的是
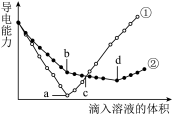
 溶液中,分别滴入物质的量浓度相等的
溶液中,分别滴入物质的量浓度相等的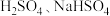 溶液,其导电能力随滴入溶液体积变化的曲线如下图所示.下列分析不正确的是
溶液,其导电能力随滴入溶液体积变化的曲线如下图所示.下列分析不正确的是
A.①代表滴加 溶液的变化曲线 溶液的变化曲线 | B. 点,两溶液中含有相同量的 点,两溶液中含有相同量的 |
C. 点,溶液中大量存在的离子是 点,溶液中大量存在的离子是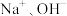 | D.a、d两点对应的溶液均显中性 |
您最近一年使用:0次
2023-12-03更新
|
320次组卷
|
101卷引用:2016年全国普通高等学校招生统一考试化学(北京卷精编版)
2016年全国普通高等学校招生统一考试化学(北京卷精编版)(已下线)北京四中2018届上学期高三年级期中考试化学试卷2016年全国普通高等学校招生统一考试化学(北京卷参考版)北京市中国人民大学附属中学2018-2019学年高一上学期期中考试化学试题2015-2016学年浙江省绍兴一中高一下期末化学试卷2017届甘肃省兰州一中高三上学期9月月考化学试卷2017届内蒙古临河区巴彦淖尔一中高三上9月月考化学卷2016-2017学年湖南省长沙一中高二上第一次月考化学卷2017届福建省仙游一中高三上第一次月考化学试卷2017届山东省新泰市高三上学期第一次阶段考化学试卷2017届广西桂林十八中高三上10月月考化学试卷2016-2017学年湖南省长郡中学高二上期中化学卷2016-2017学年辽宁东北育才学校高二上阶段考二化学卷2016-2017学年江西省南昌市八一中学等五校高二上联考二化学试卷四川省成都市第七中学2017届高三周测(4月15日)理科综合化学试题山东省泰安市第一中学2016-2017学年高一下学期学情检测化学试题四川省成都外国语学校2016-2017学年高一下期期末考试(理)化学试题江苏省启东中学2017-2018学年高一(创新班)上学期期初考试化学试题新疆生产建设兵团第二中学2016-2017学年高二下学期第四次月考化学试题陕西省西安市第一中学2018届高三上学期第二次模拟考试化学试题湖北省荆州中学2018届高三上学期第三次双周考(11月)化学试卷新疆生产建设兵团第二中学2017-2018学年高一上学期期中考试化学试题福建省福州市八县(市)协作校2018届高三上学期期中联考化学试题江西省抚州市临川区第一中学2017-2018学年高二12月月考化学试题湖南省长沙市第一中学2017-2018学年高一上学期第二次阶段性检测化学试题湖南省长沙市一中2017-2018学年高一上学期第二次模块考试化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.3 离子反应广西桂林市第十八中学2017-2018学年高一下学期开学考试化学试题(已下线)《考前20天终极攻略》6月4日 专项四 化学坐标曲线图分析(已下线)解密11 弱电解质的电离和溶液的酸碱性——备战2018年高考化学之高频考点解密(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检测(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检验 练安徽省白泽湖中学2017届高三上学期期中考试化学试题高二人教版选修4 第三章 第二节 水的电离和溶液的酸碱性【全国百强校】甘肃省天水市一中2018-2019学年高二(理)上学期第二学段考试化学试题(已下线)2019高考备考二轮复习精品资料-专题4 离子反应(教学案)吉林省白城市第一中学2018-2019学年高二下学期期末考试化学试题第一章 章末检测(2)《高中新教材同步备课》(人教版 必修第一册)云南省双柏县一中2020届高三上学期开学考试化学试题河北安平中学2019-2020学年高二上学期第二次月考化学试题浙江省宁波市北仑中学2019-2020学年高二上学期期中考试化学(2-10班)试题上海市普陀区2020届高三上学期一模化学试题吉林省长春市兴华中学2019-2020学年高一上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——酸碱中和滴定(已下线)【新东方】2020--98(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训2020届成都市第七中学高中毕业班四月份教学质量监测卷理科综合化学部分河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分湖北省武汉市华中师范大学第一附属中学2020届高三下学期四月份网络教学质量监测理科综合化学试题(已下线)第3单元 离子反应(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)第01章 物质及其变化(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)第一章章末检测(1)——《高中新教材同步备课》(人教版 必修第一册)河南省漯河市临颍县南街高级中学2020届高三阶段性测试化学试题吉林省白山市长白朝鲜族自治县实验中学2020-2021学年高一上学期第一次月考化学试题山西省太原师范学院附属中学师苑中学2020-2021学年高一上学期第一次月考化学试题江西省于都中学2020-2021学年高一上学期第一次月考化学试题内蒙古赤峰二中2020-2021学年高一上学期第一次月考化学试题(已下线)【浙江新东方】33湖南省长沙市南雅中学2020—2021学年高一上学期第一次月考化学试题四川省成都新津为明学校2020-2021学年高二上学期期中测试化学试题海南省华中师范大学琼中附属中学2020-2021学年高一上学期期中考试化学试题内蒙古包头市回民中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高一上】【期中】【HD-LP404】【化学】(已下线)【浙江新东方】89.浙江省台州市2019—2020学年高一上学期期末质量评估考试化学试题重庆市凤鸣山中学校2021届高三10月月考化学试题甘肃省白银市第十中学2019-2020学年高一上学期期中考试化学试题陕西省西安市第一中学2020-2021学年高一上学期12月月考化学试题 北京市丰台区丰台第二中学2022-2023学年上学期高三10月月考化学试题北京市中国人民大学附属中学2022-2023学年高三上学期统练6化学试题北京市顺义区第一中学2023届高三下学期2月月考化学试题北京工业大学附属中学2022-2023学年高三上学期开学测试化学试题北京市第一六一中学2022-2023学年高一上学期12月月考化学试题北京理工大学附属中学2023-2024学年高一上学期期中考试化学试题专题3 第二单元综合拔高练-高中化学苏教2019版必修第一册河南省林州市第一中学2021-2022学年高一上学期开学检测(普通班)化学试题云南景东彝族自治县第一中学2021-2022学年高二上学期开学考试化学试题山东省滨州市惠民县第二中学致远高中部2021-2022学年高三10月月考化学试题山西省大同市平城中学校2021-2022学年高一上学期10月月考化学试题云南景东彝族自治县第一中学2021-2022学年高二上学期开学检测化学试题辽宁省渤海大学附属高级中学2021-2022学年高三上学期第三次考试化学试题云南省玉溪市民族中学2021-2022年高三下学期适应性考试(七)化学试题河南省洛阳市伊川县第一高中2021-2022学年高一上学期第二次月考化学试题湖南省长郡中学2021-2022学年高一下学期期末考试化学试题黑龙江省鹤岗市第一中学2021-2022学年高二下学期期末考试化学试题山西省河津市第二中学2022-2023学年高一上学期9月月考 化学试题安徽省合肥市第六中学2022-2023学年高一上学期第一次测试化学试题新疆阿瓦提县第四中学2022-2023学年高一上学期9月份测试化学B试题(已下线)专题04 电离方程式、电解质溶液的导电性-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型134 导电能力与酸碱中和滴定图像甘肃省张掖市高台县第一中学2022-2023学年高二下学期2月月考化学试题(已下线)第2讲 离子反应 离子方程式(已下线)T10-离子反应山东省聊城市第二中学2023-2024学年高二上学期开学考试化学试题辽宁省朝阳市辽宁名校统考2023-2024学年高一上学期10月月考化学试题甘肃省天水市2023-2024学年高一上学期10月期中检测化学试题云南省昆明市第八中学2023-2024学年高一上学期9月月考化学试卷题浙江省台州市第一中学2022-2023学年高一上学期11月期中考试化学试题河南省南阳市第一中学校2023-2024学年高一上学期第二次月考化学试题 吉林省长春市东北师大附中2023-2024学年高一上学期期末考试化学试题吉林省长春市东北师范大学附属中学2023-2024学年高一上学期期末化学试题
名校
解题方法
4 . 根据如图所示的转化关系判断,下列说法正确的是(反应条件已略去)


A.生成等质量 时,①和②反应消耗 时,①和②反应消耗 |
B.反应③和④消耗等量的Al时,生成的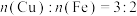 |
| C.反应③中氧化剂与还原剂的物质的量之比为2∶3 |
D.反应⑤的离子方程式为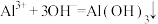 |
您最近一年使用:0次
2023-11-29更新
|
149次组卷
|
8卷引用:北京市石景山区2018届高三第一学期期末考试化学试题
名校
解题方法
5 . 滴有酚酞的 溶液显红色,在该溶液中分别滴加X溶液后有下列现象。下列说法不正确的是
溶液显红色,在该溶液中分别滴加X溶液后有下列现象。下列说法不正确的是
 溶液显红色,在该溶液中分别滴加X溶液后有下列现象。下列说法不正确的是
溶液显红色,在该溶液中分别滴加X溶液后有下列现象。下列说法不正确的是| 序号 | 装置 | X溶液 | 现象 |
| I | 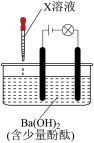 | 盐酸 | 溶液红色褪去,无沉淀,灯泡亮度没有明显变化 |
| Ⅱ |  | 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化 | |
| Ⅲ |  | 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗 |
A.实验I中溶液红色褪去,说明发生了反应 |
B.实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在有大量的 与 与 |
C.实验Ⅲ中溶液红色褪去,生成白色沉淀,灯泡逐渐变暗,说明发生了反应: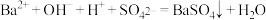 |
D.将实验Ⅱ中 溶液换成 溶液换成 溶液,现象与原实验Ⅱ中的现象相同 溶液,现象与原实验Ⅱ中的现象相同 |
您最近一年使用:0次
2023-11-17更新
|
118次组卷
|
26卷引用:【区级联考】北京市朝阳区2018-2019学年高一上学期期末考试化学试题
【区级联考】北京市朝阳区2018-2019学年高一上学期期末考试化学试题北京市第三十五中学2020-2021学年高一上学期期中考试化学试题(已下线)2019年9月26日 《每日一题》必修1—— 离子方程式的书写及正误判断安徽省滁州市定远县育才学校2019-2020学年高一(普通班)上学期第三次月考化学试题人教版(2019)高一必修第一册 全书综合训练(二)鲁科版(2019)高一必修第一册 综合训练(二)吉林省吉林市第二中学2020-2021学年高一上学期9月月考化学试题宁夏银川一中2020-2021学年高一上学期期中考试化学试题重庆市渝西中学2020-2021学年高一上学期第一次月考化学试题山东省青岛第五十八中学2020-2021学年高一上学期期中考试化学试题山西省沁县中学2020-2021学年高一上学期第一次月考化学试题吉林省延边第二中学2020-2021学年高一上学期第一次考试月考化学试题北京市第九中学2023-2024学年高一上学期10月月考化学试题(已下线)1.2.2 离子反应-2021-2022学年高一化学课后培优练(人教版2019必修第一册)云南省玉溪第一中学2021-2022学年高一上学期第一次月考化学试题吉林省长春北师大附属学校2021-2022学年高一上学期第一次月考化学试题辽宁省庄河市高级中学2021-2022学年高一10月月考化学试题广东省河源市河源中学2021-2022学年高一上学期10月段考化学试题四川省绵阳东辰国际学校2021-2022学年高一上学期第一次月考试化学试题本章复习提升湖南省长沙市雅礼中学2022-2023学年高一上学期第一次月考化学试题山东省聊城第一中学2022-2023学年高一上学期11月期中考试化学试题 章末检测卷(二) 元素与物质世界山东省济宁邹城市第二中学2023-2024学年高一上学期10月月考化学试题广东省佛山市顺德区乐从中学2023-2024学年高一上学期10月月考化学试题山东省青岛市2023-2024学年第十七中学高一上学期化学期中试题
名校
6 . A、B、C、D四种可溶性盐,其阳离子分别是 中的某种,阴离子分别是
中的某种,阴离子分别是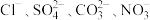 中的某一种。现做以下实验:
中的某一种。现做以下实验:
①将四种盐各取少量,分别溶于盛有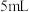 蒸馏水的4支试管中,只有B盐溶液呈蓝色。
蒸馏水的4支试管中,只有B盐溶液呈蓝色。
②分别向4支试管中加入 稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述实验事实,推断这四种盐的化学式分别为:
A:_______ ;B:_______ ;C:_______ ;D:_______ 。
(2)对出下列反应的离子方程式:
①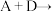 :
:_______ 。
②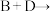 :
:_______ 。
③ 气体:
气体:_______ 。
 中的某种,阴离子分别是
中的某种,阴离子分别是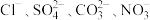 中的某一种。现做以下实验:
中的某一种。现做以下实验:①将四种盐各取少量,分别溶于盛有
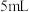 蒸馏水的4支试管中,只有B盐溶液呈蓝色。
蒸馏水的4支试管中,只有B盐溶液呈蓝色。②分别向4支试管中加入
 稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。(1)根据上述实验事实,推断这四种盐的化学式分别为:
A:
(2)对出下列反应的离子方程式:
①
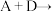 :
:②
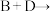 :
:③
 气体:
气体:
您最近一年使用:0次
2023-09-08更新
|
239次组卷
|
28卷引用:宁夏回族自治区吴忠市吴忠中学2019-2020学年高一上学期期中考试化学试题
宁夏回族自治区吴忠市吴忠中学2019-2020学年高一上学期期中考试化学试题鲁科版(2019)高一必修第一册第2章 元素与物质世界 第2节 电解质的电离 离子反应 专题3 离子推断及其鉴别辽宁省沈阳市第二十中学2019-2020学年高一上学期第一次月考化学试题辽宁省葫芦岛市第八高级中学2020-2021学年高一上学期实验班第一次月考化学试题吉林省白山市长白朝鲜族自治县实验中学2020-2021学年高一上学期第一次月考化学试题(已下线)【浙江新东方】27山西省太原市十二中学2020-2021学年高一上学期10月月考化学试题重庆市渝西中学2020-2021学年高一上学期第一次月考化学试题重庆实验中学2020-2021学年高一上学期第一阶段测试化学试题浙江省瑞安中学2020-2021学年高一上学期10月月考化学试题江西省赣州市信丰中学2020-2021学年高一上学期第一次月考化学(A卷) 试题河北省石家庄市第二十三中学2020-2021学年高一上学期10月阶段考试化学试题北京市海淀区第五十七中学2022-2023学年高一上学期10月月考化学试题北京市第八十中学2023-2024学年高一上学期期中考试化学试题四川省江油中学2021-2022学年高一上学期10月月考化学试题湖北省沙市中学2022-2023学年高一上学期第一次月考化学试题安徽师范大学附属中学2022-2023学年高一上学期10月选科诊断测试化学试题吉林省长春市第五中学2022-2023 学年高一上学期第一学程考试化学试题黑龙江省齐齐哈尔市八校联合体2022-2023学年高一上学期期中考试化学试题黑龙江省哈尔滨市第七十三中学校2022-2023学年高一上学期第一次月考化学试题江西省丰城中学2022-2023学年高一上学期期中考试化学试题四川省成都高新实验中学2022-2023高一上学期期中考试化学试题河南省鄢陵县第二高级中学2021-2022学年高一上学期阶段测试化学试题河北省石家庄北华中学2022-2023学年高一上学期期中考试化学试题湖北省武汉市第一中学2022-2023学年高一上学期10月月考化学试题云南省昭通市市直中学2023-2024学年高一上学期联考第一次月考化学试题湖北省武汉市洪山高级中学2023-2024学年高一上学期10月月考化学试题河北省石家庄市第二十三中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
7 . 下列解释事实的方程式不正确的是
| A.醋酸溶液显酸性:CH3COOH⇌H++CH3COO- |
| B.用氨水除去烟气中的SO2:SO2+2NH3•H2O=(NH4)2SO3+H2O |
| C.向盐碱地中施放硫酸钙,降低其碱性:Na2CO3+CaSO4=CaCO3+Na2SO4 |
| D.用三氯化铁溶液腐蚀线路板:Fe3++Cu=Fe2++Cu2+ |
您最近一年使用:0次
名校
8 . 正极材料为LiCoO2的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应除了得到LiFePO4外,还有另外一种酸式盐产物,请写出共沉淀的化学方程式为_______ 。
②高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善诚信后的LiFePO4的导电性能外,还能_______ 。
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O 被氧化成SO
被氧化成SO ,LiCoO2在溶解过程中反应的化学方程式为
,LiCoO2在溶解过程中反应的化学方程式为_______ 。
②已知Co的氧化物与Fe的氧化物类似。Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为_______ (填化学式),在350~400℃范围内,剩余固体的成分为_______ (填化学式)。

(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应除了得到LiFePO4外,还有另外一种酸式盐产物,请写出共沉淀的化学方程式为
②高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善诚信后的LiFePO4的导电性能外,还能
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O
 被氧化成SO
被氧化成SO ,LiCoO2在溶解过程中反应的化学方程式为
,LiCoO2在溶解过程中反应的化学方程式为②已知Co的氧化物与Fe的氧化物类似。Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为

您最近一年使用:0次
2023-04-26更新
|
178次组卷
|
2卷引用:北京市中国人民大学附属中学2020届高三化学质检试题
名校
9 . 制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol•L-1硫酸铝酸性溶液,经检验,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5(温室下,0.1 mol•L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_______ 。
(2)往溶液中加入H2O2的作用是_______ (用离子方程式表示)。
(3)加入的X试剂(填选项编号)是_______ 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是_______ 。
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为
(2)往溶液中加入H2O2的作用是
(3)加入的X试剂(填选项编号)是
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是
您最近一年使用:0次
名校
解题方法
10 . 下列反应的离子方程式与解释均正确的是
| A.将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
C.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++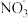 =Fe3++2H2O+NO↑ =Fe3++2H2O+NO↑ |
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2 +6H++5H2O2=2Mn2++5O2↑+8H2O +6H++5H2O2=2Mn2++5O2↑+8H2O |
您最近一年使用:0次
2023-04-26更新
|
303次组卷
|
2卷引用:北京市中国人民大学附属中学2020届高三化学质检试题



