名校
解题方法
1 . 有A、B、C三种粉末,其焰色反应均为紫色,它们具有下列性质:
①均易溶于水,且A与B反应生成C;
②加热B的粉末时,生成无色无刺激性气味的气体D,D能使澄清的石灰水变浑浊,浑浊物为E;
③加热A、C时均不反应;
④向少量C溶液中通入D可以得到B;
⑤A溶液和D反应,A过量时生成C,A不足时生成B.
请回答下列问题:
(1)写出下列字母代表物质的化学式:A:_____ ;B:_____ 。
(2)用离子方程式表示下列反应:
A+B:_____ ;
D→E:_____ ;
A+D→B:_____ 。
①均易溶于水,且A与B反应生成C;
②加热B的粉末时,生成无色无刺激性气味的气体D,D能使澄清的石灰水变浑浊,浑浊物为E;
③加热A、C时均不反应;
④向少量C溶液中通入D可以得到B;
⑤A溶液和D反应,A过量时生成C,A不足时生成B.
请回答下列问题:
(1)写出下列字母代表物质的化学式:A:
(2)用离子方程式表示下列反应:
A+B:
D→E:
A+D→B:
您最近一年使用:0次
解题方法
2 . 化学与生产、生活有着密切的联系.根据所学知识回答下列问题
(1)铝元素在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制.铝及其化合物在下列场合使用时必须严格加以控制的是_______ (填字母)
A.用明矾净水 B.制电线电缆 C.制包糖果用的铝箔
(2)_______ (填化学式)可用于呼吸面具或潜艇中的氧气来源
(3)盛装 溶液的试剂瓶不能用玻璃塞的原因是
溶液的试剂瓶不能用玻璃塞的原因是_______ (用化学方程式表示)
(4)当人体缺铁时,往往需要吃补铁保健品,人体能够吸收的是 ,但
,但 很容易被氧化.检验某固体补铁剂中铁元素是否被氧化的方法是
很容易被氧化.检验某固体补铁剂中铁元素是否被氧化的方法是_______ (写出操作过程、现象及结论)
(5)胃舒平[主要成分为 ]是一种治疗胃酸过多的药物,写出胃舒平与胃酸反应的离子方程式
]是一种治疗胃酸过多的药物,写出胃舒平与胃酸反应的离子方程式_______
(6) 是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂检验
是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂检验 是否泄漏的反应方程式为
是否泄漏的反应方程式为 ,若反应中消耗
,若反应中消耗 ,则被氧化的
,则被氧化的 的体积为
的体积为_______ L(标准状况下)
(1)铝元素在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制.铝及其化合物在下列场合使用时必须严格加以控制的是
A.用明矾净水 B.制电线电缆 C.制包糖果用的铝箔
(2)
(3)盛装
 溶液的试剂瓶不能用玻璃塞的原因是
溶液的试剂瓶不能用玻璃塞的原因是(4)当人体缺铁时,往往需要吃补铁保健品,人体能够吸收的是
 ,但
,但 很容易被氧化.检验某固体补铁剂中铁元素是否被氧化的方法是
很容易被氧化.检验某固体补铁剂中铁元素是否被氧化的方法是(5)胃舒平[主要成分为
 ]是一种治疗胃酸过多的药物,写出胃舒平与胃酸反应的离子方程式
]是一种治疗胃酸过多的药物,写出胃舒平与胃酸反应的离子方程式(6)
 是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂检验
是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂检验 是否泄漏的反应方程式为
是否泄漏的反应方程式为 ,若反应中消耗
,若反应中消耗 ,则被氧化的
,则被氧化的 的体积为
的体积为
您最近一年使用:0次
名校
解题方法
3 . 将标准状况下的22.4L SO2通入4mol NaOH溶液中,下列用来解释事实的方程式中不合理的是(已知室温下饱和Na2SO3溶液的pH约为8.3)
A.标准状况下的22.4L SO2通入含4mol NaOH的溶液:2OH-+SO2=SO +H2O +H2O |
B.上述反应后所得溶液的pH约为12:SO +H2O +H2O HSO HSO +OH- +OH- |
C.向上述反应后所得溶液中,通入氯气,pH下降:SO +Cl2+2OH-=SO +Cl2+2OH-=SO +2Cl-+H2O +2Cl-+H2O |
D.向上述反应后所得溶液中,滴加少量H2O2和BaCl2溶液的混合液,产生白色沉淀:SO +Ba2++H2O2=BaSO4↓+H2O +Ba2++H2O2=BaSO4↓+H2O |
您最近一年使用:0次
2023-04-21更新
|
249次组卷
|
2卷引用:北京市中国人民大学附属中学2017-2018学年高三上学期12月月考化学试题
名校
4 . 酸与碱的中和反应在生活生产中有重要的应用。下图从不同角度反映稀硫酸和氢氧化钠溶液的反应。

请回答下列问题:
(1)图甲,烧杯中盛有氢氧化钠溶液,滴入2~3滴酚酞溶液,现象是_______ ,变色的原因是溶液的pH_______ 7(填写大于、等于或小于)。
(2)向稀硫酸中滴加氢氧化钠溶液,得到溶液pH与加入氢氧化钠溶液质量的关系如图乙。
①当加入ag氢氧化钠溶液时,此时溶液中的溶质是_______ (填写化学式)。
②当加入氢氧化钠溶液的质量正好反应到M点时,溶液中的主要离子及其比值是_______ (填写符号和比值)。
③当加入氢氧化钠溶液的质量为bg时,所得溶液中的pH_______ 7(填写大于、等于或小于)。
(3)在溶液中硫酸氢钠(NaHSO4)完全解离出Na+、H+、SO ,其溶液呈酸性。
,其溶液呈酸性。
①向硫酸氢钠溶液中滴加氢氧化钠溶液,完全反应的化学方程式是_______ 。
②向硫酸氢钠溶液中滴加氢氧化钡溶液反应至溶液呈中性,写出反应的化学方程式_______ 。

请回答下列问题:
(1)图甲,烧杯中盛有氢氧化钠溶液,滴入2~3滴酚酞溶液,现象是
(2)向稀硫酸中滴加氢氧化钠溶液,得到溶液pH与加入氢氧化钠溶液质量的关系如图乙。
①当加入ag氢氧化钠溶液时,此时溶液中的溶质是
②当加入氢氧化钠溶液的质量正好反应到M点时,溶液中的主要离子及其比值是
③当加入氢氧化钠溶液的质量为bg时,所得溶液中的pH
(3)在溶液中硫酸氢钠(NaHSO4)完全解离出Na+、H+、SO
 ,其溶液呈酸性。
,其溶液呈酸性。①向硫酸氢钠溶液中滴加氢氧化钠溶液,完全反应的化学方程式是
②向硫酸氢钠溶液中滴加氢氧化钡溶液反应至溶液呈中性,写出反应的化学方程式
您最近一年使用:0次
名校
5 . 我国科学家提出了由物质A和物质B转化为高附加值产品乙酸(CH3COOH)的催化反应历程,该历程示意图如下(模型中的短线仅代表原子间的连接方式)。
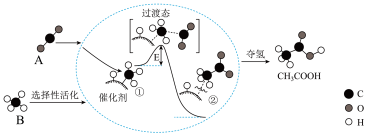
请回答下列问题:
(1)物质B的化学式是_______ ;实验室中制备A的化学方程式是_______ 。
(2)反应过程中,催化剂吸附的物质是_______ 。(写名称)
(3)写出物质A、B反应生成乙酸的化学方程式_______ 。
(4)物质A能与氢氧化钠溶液反应生成纯碱,反应的化学方程式是_______ 。
(5)物质B和乙酸都能完全燃烧生成二氧化碳和水,等质量的物质B和乙酸完全燃烧时消耗氧气的质量比为_______ 。

请回答下列问题:
(1)物质B的化学式是
(2)反应过程中,催化剂吸附的物质是
(3)写出物质A、B反应生成乙酸的化学方程式
(4)物质A能与氢氧化钠溶液反应生成纯碱,反应的化学方程式是
(5)物质B和乙酸都能完全燃烧生成二氧化碳和水,等质量的物质B和乙酸完全燃烧时消耗氧气的质量比为
您最近一年使用:0次
名校
6 . 物质因相互融合精彩纷呈,又因独具特色独领风骚。现有下列七种物质:①Cl2②CO2气体③冰醋酸④NaHCO3固体⑤NH4NO3固体⑥红褐色的氢氧化铁胶体⑦氢氧化钡溶液。
(1)上述物质中属于强电解质的有:____ (填序号,以下同)。属于弱电解质的是:____ 。属于非电解质的是:____ 。在该状态下能导电的是:____ 。
(2)将新制氯水滴到pH试纸上,实验现象如图所示,该实验说明H+的扩散速度比HClO分子___ (填“慢”或“快”)。

(3)在土壤胶体中用NH4NO3施肥,研究发现,NO 容易随雨水流失,而NH
容易随雨水流失,而NH 保肥效果好,由此得出土壤胶体的结论是
保肥效果好,由此得出土壤胶体的结论是____ 。
(4)在NaHCO3溶液中加入NaHSO4溶液,反应的离子方程式:____ 。
(5)将NaHCO3溶液加入到氢氧化钡溶液中,至沉淀量最大,写出离子方程式:___ 。
(1)上述物质中属于强电解质的有:
(2)将新制氯水滴到pH试纸上,实验现象如图所示,该实验说明H+的扩散速度比HClO分子

(3)在土壤胶体中用NH4NO3施肥,研究发现,NO
 容易随雨水流失,而NH
容易随雨水流失,而NH 保肥效果好,由此得出土壤胶体的结论是
保肥效果好,由此得出土壤胶体的结论是(4)在NaHCO3溶液中加入NaHSO4溶液,反应的离子方程式:
(5)将NaHCO3溶液加入到氢氧化钡溶液中,至沉淀量最大,写出离子方程式:
您最近一年使用:0次
2022-10-28更新
|
159次组卷
|
2卷引用:山东省青岛第二中学2019-2020学年高一上学期期中考试化学试题
解题方法
7 . 实验室制取氯气的装置如图所示:
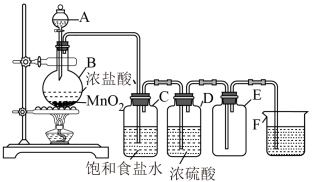
(1)用离子方程式表示制取氯气的反应原理,并用双线桥标出该反应的电子转移方向和数目:_______ 。
(2)写出下列字母代表的仪器名称:A_______ ,B_______ 。
(3)装置C的作用是_______ ,装置D的作用是_______ 。
(4)检验E瓶集满氯气的方法是:_______ 。
(5)烧杯F中盛放的液体是____ ,其作用是____ 。写出该反应离子方程式_____ 。

(1)用离子方程式表示制取氯气的反应原理,并用双线桥标出该反应的电子转移方向和数目:
(2)写出下列字母代表的仪器名称:A
(3)装置C的作用是
(4)检验E瓶集满氯气的方法是:
(5)烧杯F中盛放的液体是
您最近一年使用:0次
名校
解题方法
8 . W、X、Y、Z、R、V、Q是七种短周期元素,原子序数依次增大。X原子的最外层电子数是次外层的2倍,Z为地壳中含量最多的元素,V的周期数和主族序数相等,W和R同主族,且都能与Z形成A2Z、A2Z2(A可以表示W或R)型的两种化合物,Q的单质为黄绿色有毒气体。请回答下列问题:
(1)W为____ (填元素名称),Q在元素周期表中的位置为_____ 。
(2)X和Y的气态氢化物中稳定性较强的是____ (填化学式)。
(3)写出XZ2的电子式____ 。
(4)请写出V的最高价氧化物对应的水化物与R的最高价氧化物对应的水化物反应的离子方程式_____ 。
(1)W为
(2)X和Y的气态氢化物中稳定性较强的是
(3)写出XZ2的电子式
(4)请写出V的最高价氧化物对应的水化物与R的最高价氧化物对应的水化物反应的离子方程式
您最近一年使用:0次
2022-08-30更新
|
103次组卷
|
2卷引用:浙江省湖州市吴兴高级中学2020-2021学年高一上学期12月月考化学试题
9 . 已知甲、乙、丙物质分别由H、C、Na、O、Cl、Fe元素中的一种或几种组成。
(1)若甲物质俗称为小苏打,则甲的化学式为_______ 。
(2)若乙物质在空气中迅速变成灰绿色,最后变成红褐色,,则该反应的化学方程式为_______ 。
(3)若丙物质在常温常压下为黄绿色气体,则实验室制取丙的化学方程式为:_______ 。
(4)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂( )。
)。 的一种制备方法如下。
的一种制备方法如下。

① 中,铁元素的化合价为
中,铁元素的化合价为_______ 价。
②将反应Ⅰ的离子方程式配平:_______ 。
_______ _______
_______ _______
_______ _______
_______ _______
_______
(1)若甲物质俗称为小苏打,则甲的化学式为
(2)若乙物质在空气中迅速变成灰绿色,最后变成红褐色,,则该反应的化学方程式为
(3)若丙物质在常温常压下为黄绿色气体,则实验室制取丙的化学方程式为:
(4)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(
 )。
)。 的一种制备方法如下。
的一种制备方法如下。
①
 中,铁元素的化合价为
中,铁元素的化合价为②将反应Ⅰ的离子方程式配平:
_______
 _______
_______ _______
_______ _______
_______ _______
_______
您最近一年使用:0次
名校
10 . 2020年10月,洛阳师范学院先进功能材料团队,在过渡金属硫族化合物(TMD)材料领域研究取得新进展, 是一种典型的TMD材料,
是一种典型的TMD材料, 与石墨相似具有层状结构,其结构如图1所示;其工艺制备流程如图2所示:
与石墨相似具有层状结构,其结构如图1所示;其工艺制备流程如图2所示:


已知:① 结构类似于
结构类似于 ,与酸反应时先生成
,与酸反应时先生成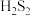 ,
,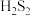 类似于
类似于 ,易分解。
,易分解。
② 不溶于盐酸和氢氟酸。
不溶于盐酸和氢氟酸。
(1) 可用于制纳米颗粒润滑油,是由于
可用于制纳米颗粒润滑油,是由于_______ 。
(2)辉钼矿(主要成分为 ,还含有
,还含有 及不溶于酸碱且难以氧化的杂质),“酸浸”时,
及不溶于酸碱且难以氧化的杂质),“酸浸”时, 发生的总反应的化学方程式为
发生的总反应的化学方程式为_______ 。
(3) 在
在_______ 步骤中被除去,滤渣的主要成分是_______ 。
(4)“氧化焙烧”步骤得到 的化学方程式为
的化学方程式为_______ 。
(5)“沉淀”操作中,先加入 ,将
,将 转化为
转化为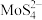 ,再加入盐酸,生成
,再加入盐酸,生成 沉淀和
沉淀和 气体,则“氨浸”的离子方程式为
气体,则“氨浸”的离子方程式为_______ 。
(6)二维的 具有更大的层间距可以满足锂离子的扩散,层状结构可以在循环过程中很好的保持,因此,该流程得到的
具有更大的层间距可以满足锂离子的扩散,层状结构可以在循环过程中很好的保持,因此,该流程得到的 可用于制备
可用于制备 电池,该电池以可传导
电池,该电池以可传导 的
的 作电解质溶液,该电池的工作原理为
作电解质溶液,该电池的工作原理为

 ,该电池放电的装置图如图:
,该电池放电的装置图如图:

①充电时, 电极与电源
电极与电源_______ 极相连。
②该电池放电时,正极反应式为_______ 。
 是一种典型的TMD材料,
是一种典型的TMD材料, 与石墨相似具有层状结构,其结构如图1所示;其工艺制备流程如图2所示:
与石墨相似具有层状结构,其结构如图1所示;其工艺制备流程如图2所示:

已知:①
 结构类似于
结构类似于 ,与酸反应时先生成
,与酸反应时先生成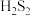 ,
,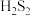 类似于
类似于 ,易分解。
,易分解。②
 不溶于盐酸和氢氟酸。
不溶于盐酸和氢氟酸。(1)
 可用于制纳米颗粒润滑油,是由于
可用于制纳米颗粒润滑油,是由于(2)辉钼矿(主要成分为
 ,还含有
,还含有 及不溶于酸碱且难以氧化的杂质),“酸浸”时,
及不溶于酸碱且难以氧化的杂质),“酸浸”时, 发生的总反应的化学方程式为
发生的总反应的化学方程式为(3)
 在
在(4)“氧化焙烧”步骤得到
 的化学方程式为
的化学方程式为(5)“沉淀”操作中,先加入
 ,将
,将 转化为
转化为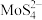 ,再加入盐酸,生成
,再加入盐酸,生成 沉淀和
沉淀和 气体,则“氨浸”的离子方程式为
气体,则“氨浸”的离子方程式为(6)二维的
 具有更大的层间距可以满足锂离子的扩散,层状结构可以在循环过程中很好的保持,因此,该流程得到的
具有更大的层间距可以满足锂离子的扩散,层状结构可以在循环过程中很好的保持,因此,该流程得到的 可用于制备
可用于制备 电池,该电池以可传导
电池,该电池以可传导 的
的 作电解质溶液,该电池的工作原理为
作电解质溶液,该电池的工作原理为

 ,该电池放电的装置图如图:
,该电池放电的装置图如图:
①充电时,
 电极与电源
电极与电源②该电池放电时,正极反应式为
您最近一年使用:0次



