20-21高一·全国·课时练习
解题方法
1 . 某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:

(1)补全上述①②③④各步反应的离子方程式
①Mg+2H+═Mg2++H2↑,________________________
②__________________ ,____________________ ;Mg2++2OH-═Mg(OH)2↓
③_____________________ ,CO2+2H2O+ ═Al(OH)3↓+
═Al(OH)3↓+
④________________________ ;
(2)该样品中铝的质量分数是________________________
(3)第②步中加入NaOH溶液不足时,会使测定结果_____________ 第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果________________________ 第④步对沉淀灼烧不充分时,会使测定结果_____________ 。
A.偏高 B.偏低 C.不影响。

(1)补全上述①②③④各步反应的离子方程式
①Mg+2H+═Mg2++H2↑,
②
③
 ═Al(OH)3↓+
═Al(OH)3↓+
④
(2)该样品中铝的质量分数是
(3)第②步中加入NaOH溶液不足时,会使测定结果
A.偏高 B.偏低 C.不影响。
您最近一年使用:0次
名校
2 . 向50g质量分数为10.6%的Na2CO3溶液中,逐滴加入CaCl2稀溶液。测得溶液中离子的数量变化如图。请据此分析以下问题:
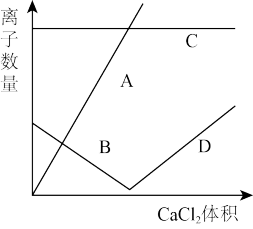
(1)请指出以下曲线表示的离子化学式:
A___________________
C___________________
D___________________
(2)反应的化学反应方程式为_______________________________________ 。
(3)当A、C曲线相交时,生成的沉淀质量为____________ g。

(1)请指出以下曲线表示的离子化学式:
A
C
D
(2)反应的化学反应方程式为
(3)当A、C曲线相交时,生成的沉淀质量为
您最近一年使用:0次
2020-11-19更新
|
226次组卷
|
4卷引用:安徽省舒城中学2020-2021学年高一上学期第一次统考化学试题
安徽省舒城中学2020-2021学年高一上学期第一次统考化学试题江西省南昌市进贤一中2020-2021学年高一上学期第二次月考化学试题(已下线)2.2.2 离子方程式的书写-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)(已下线)1.2.2 离子反应和离子方程式(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)?
名校
3 . 乙二酸(HOOC—COOH)俗名草酸,是一种有还原性的有机弱酸,在化学上有广泛应用。
(1)小刚在做“研究温度对化学反应速率的影响”实验时,他往 A、B 两支试管中均加入 4 mL 0.01 mol·L-1的酸性 KMnO4溶液和 2 mL 0.1mol·L-1H2C2O4(乙二酸)溶液,振荡,A 试管置于热水中,B 试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间 tA________ tB(填“>”“=”或“<”)。写出该反应的离子方程式:___________________________ 。
(2)实验室有一瓶混有泥沙的乙二酸样品,小刚利用上述反应的原理来测定其含量,具体操作为:
①配制 250 mL 溶液:准确称量 5.0 g 乙二酸样品,配成 250 mL 溶液。
②滴定:准确量取 25.00 mL 所配溶液于锥形瓶中,加少量酸酸化,将 0.100 0mol·L-1KMnO4标准溶液装入______ (填“酸式”或“碱式”)滴定管,进行滴定操作。 判断滴定达到终点的现象是_____________________ 。
③计算:重复上述操作 2 次,记录实验数据如下表。则消耗 KMnO4标准溶液的平均体积为________ mL,此样品的纯度为____________ 。
④误差分析:下列操作会导致测定结果偏高的是___________ 。
A.未用KMnO4标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
(1)小刚在做“研究温度对化学反应速率的影响”实验时,他往 A、B 两支试管中均加入 4 mL 0.01 mol·L-1的酸性 KMnO4溶液和 2 mL 0.1mol·L-1H2C2O4(乙二酸)溶液,振荡,A 试管置于热水中,B 试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间 tA
(2)实验室有一瓶混有泥沙的乙二酸样品,小刚利用上述反应的原理来测定其含量,具体操作为:
①配制 250 mL 溶液:准确称量 5.0 g 乙二酸样品,配成 250 mL 溶液。
②滴定:准确量取 25.00 mL 所配溶液于锥形瓶中,加少量酸酸化,将 0.100 0mol·L-1KMnO4标准溶液装入
③计算:重复上述操作 2 次,记录实验数据如下表。则消耗 KMnO4标准溶液的平均体积为
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 20.01 |
| 2 | 1.00 | 20.99 |
| 3 | 0.00 | 21.10 |
A.未用KMnO4标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
2020-10-15更新
|
403次组卷
|
6卷引用:安徽省阜阳市太和第一中学2020-2021学年高二上学期10月月考化学试题
4 .  、
、 、
、 均可用于自来水的杀菌、消毒。下列说法错误的是
均可用于自来水的杀菌、消毒。下列说法错误的是
 、
、 、
、 均可用于自来水的杀菌、消毒。下列说法错误的是
均可用于自来水的杀菌、消毒。下列说法错误的是A. 与水反应的离子方程式为 与水反应的离子方程式为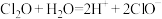 |
B.用 还原 还原 制备 制备 时,生成 时,生成 的个数与转移电子的个数之比为1∶1 的个数与转移电子的个数之比为1∶1 |
C. 的有效氯含量为2.63 的有效氯含量为2.63 |
D. 的有效氯含量为1.63 的有效氯含量为1.63 |
您最近一年使用:0次
9-10高三·江苏·阶段练习
5 . 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
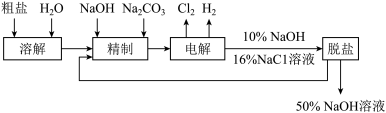
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应式为__________ 。 与电源负极相连的电极附近,溶液pH ________ (选填:不变,升高或下降)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为___________ ,
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是______ 。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_________ 。
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________ 、冷却、_________ (填写操作名称)除去NaCl。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷 的食盐水时,Cl2与NaOH充分接触,产物仅是 NaClO和H2,相应的化学方程式为_____ 。

依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应式为
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解
您最近一年使用:0次
2020-03-05更新
|
394次组卷
|
8卷引用:同步君 选修4 第4章 第3节 电解原理的应用
(已下线)同步君 选修4 第4章 第3节 电解原理的应用高中化学人教版 选修四 第四章 电化学基础 第三节 电解池 电解池第二课时(电解原理的应用)(已下线)江苏省2011届高三化学一轮过关测试(7)2015-2016学年吉林省松原高中、白城一中高二上期末联考化学试卷(已下线)2018年12月3日 《每日一题》人教选修4-电解饱和食盐水山东省枣庄市滕州市第一中学2019-2020学年高二下学期学习竞赛化学试题北京市通州区2019-2020学年高二下学期期末考试化学试题宁夏石嘴山市第三中学2020-2021学年高二上学期第一次月考化学试题
6 . 溴是海水中的重要元素,海水中溴元素的含量一般为0.067g/L,晒盐浓缩后的苦卤中含有浓度较高的溴离子,向苦卤中通入氯气,可以得到单质溴。下列有关说法正确的是( )
| A.向苦卤中通入氯气发生反应的离子方程式为Br-+Cl2===Cl-+Br2 |
| B.向苦卤中通入氯气时,溴元素化合价升高,被还原 |
| C.将单质溴从溴水中分离出来,可以利用裂化汽油进行萃取 |
| D.将单质溴从溴水中分离出来,可以利用苯、四氯化碳等多种有机溶剂进行萃取 |
您最近一年使用:0次
2019-05-20更新
|
347次组卷
|
4卷引用:高一化学暑假作业:作业十八 阶段检测(四)
高一化学暑假作业:作业十八 阶段检测(四)(人教版2019)必修第二册 第八章 化学与可持续发展 章末综合检测卷课后-8.1.1 金属矿物 海水资源的开发利用-人教2019必修第二册(已下线)8.1.2 海水资源的开发利用(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)
14-15高三上·甘肃天水·期末
名校
7 . 全球海水中溴的藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:①_______________________________ (写出离子方程式);
②Br2+3CO32-=BrO3-+ 5Br-+3CO2↑;③BrO3-+ 5Br-+6H+=3Br2+3H2O。其中反应②中氧化剂是__________ ;还原剂是________ 。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫的离子反应方程式:_________________________________________________________ 。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是____________ 。下列可以用于海水中溴的萃取试剂的是__________ 。
①乙醇 ②四氯化碳 ③硝酸 ④裂化汽油
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:①
②Br2+3CO32-=BrO3-+ 5Br-+3CO2↑;③BrO3-+ 5Br-+6H+=3Br2+3H2O。其中反应②中氧化剂是
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫的离子反应方程式:
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是
①乙醇 ②四氯化碳 ③硝酸 ④裂化汽油
您最近一年使用:0次



