1 . 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可制多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程:
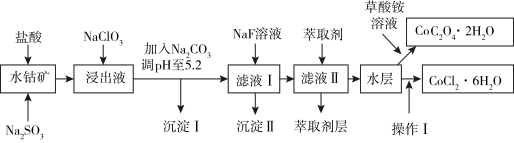
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;
②沉淀I中只含有两种沉淀;
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中Co2O3发生反应的离子反应方程式为______________ 。
(2)NaClO3在浸出液中发生的离子反应方程式为__________________ 。
(3)加入Na2CO3调pH至5.2,目的是_______________ ;萃取剂层含锰元素,则沉淀II的主要成分为_____________ 。
(4)操作I包括:将水层加入浓盐酸调整pH为2~3,___________ 、____________ 、过滤、洗涤、减压烘干等过程。
(5)粗产品中CoCl2·6H2O含量可通过以下方法测定:称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥后,通过测定沉淀质量来计算CoCl2·6H2O的质量分数。若操作I中因减压烘干使CoCl2·6H2O的结晶水减少,则以此方法测得的CoCl2·6H2O质量分数与实际值相比________ (填“偏高”“偏低”或“不变”)。
(6)将5.49g草酸亚钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表所示:
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为_______ 。(已知:CoC2O4·2H2O的摩尔质量为183 g/mol)

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;
②沉淀I中只含有两种沉淀;
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3在浸出液中发生的离子反应方程式为
(3)加入Na2CO3调pH至5.2,目的是
(4)操作I包括:将水层加入浓盐酸调整pH为2~3,
(5)粗产品中CoCl2·6H2O含量可通过以下方法测定:称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥后,通过测定沉淀质量来计算CoCl2·6H2O的质量分数。若操作I中因减压烘干使CoCl2·6H2O的结晶水减少,则以此方法测得的CoCl2·6H2O质量分数与实际值相比
(6)将5.49g草酸亚钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表所示:
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
您最近一年使用:0次
名校
解题方法
2 . 高纯硝酸锶 可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:

已知: 滤渣1的成分为
滤渣1的成分为 、
、 ;
; 铬酸
铬酸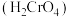 为弱酸。
为弱酸。
 酸浸不能采用高温的原因是
酸浸不能采用高温的原因是____________ ,滤液1的主要溶质是________ 。
 相对于水洗,用浓硝酸洗涤的优点是
相对于水洗,用浓硝酸洗涤的优点是___________ 。
 滤液2中过量的
滤液2中过量的 被
被 还原为
还原为 ,同时放出无污染的气体,写出发生反应的离子方程式:
,同时放出无污染的气体,写出发生反应的离子方程式:________ 。
 已知
已知 类似氢氧化铝,还原后溶液的pH不能大于8的原因是
类似氢氧化铝,还原后溶液的pH不能大于8的原因是 结合离子方程式说明理由
结合离子方程式说明理由
__________ 。
 为了测定滤渣2中
为了测定滤渣2中 的含量,进行以下实验:
的含量,进行以下实验:
mg滤渣2 溶液
溶液
滴定终点时消耗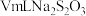 溶液
溶液 已知:
已知: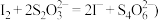 。
。
 滤渣2中
滤渣2中 摩尔质量为
摩尔质量为 的质量分数为
的质量分数为___________  用代数式表示
用代数式表示 。
。
 若加入的HI溶液过量太多,测定结果会
若加入的HI溶液过量太多,测定结果会_________  “偏高”“偏低”或“无影响”
“偏高”“偏低”或“无影响” 。
。
 可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
已知:
 滤渣1的成分为
滤渣1的成分为 、
、 ;
; 铬酸
铬酸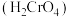 为弱酸。
为弱酸。 酸浸不能采用高温的原因是
酸浸不能采用高温的原因是 相对于水洗,用浓硝酸洗涤的优点是
相对于水洗,用浓硝酸洗涤的优点是 滤液2中过量的
滤液2中过量的 被
被 还原为
还原为 ,同时放出无污染的气体,写出发生反应的离子方程式:
,同时放出无污染的气体,写出发生反应的离子方程式: 已知
已知 类似氢氧化铝,还原后溶液的pH不能大于8的原因是
类似氢氧化铝,还原后溶液的pH不能大于8的原因是 结合离子方程式说明理由
结合离子方程式说明理由
 为了测定滤渣2中
为了测定滤渣2中 的含量,进行以下实验:
的含量,进行以下实验:mg滤渣2
 溶液
溶液
滴定终点时消耗
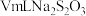 溶液
溶液 已知:
已知: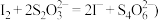 。
。 滤渣2中
滤渣2中 摩尔质量为
摩尔质量为 的质量分数为
的质量分数为 用代数式表示
用代数式表示 。
。 若加入的HI溶液过量太多,测定结果会
若加入的HI溶液过量太多,测定结果会 “偏高”“偏低”或“无影响”
“偏高”“偏低”或“无影响” 。
。
您最近一年使用:0次
2020-02-04更新
|
350次组卷
|
2卷引用:2020届高考化学二轮复习大题精准训练 ——侧重提纯类无机工艺流程题
解题方法
3 . 根据所学知识,回答下列问题:
(1)高铁酸钠(Na2FeO4)可作为高效、多功能水处理剂,其摩尔质量是__________ 。高铁酸钠可与水反应生成Fe(OH)3胶体、氢氧化钠和氧气,写出相应的离子方程式:_____________ 。
(2)戴维通过电解法首先制得了金属钠,随后几十年内,工业上采用铁粉和氢氧化钠高温熔融的方法制得钠蒸气,同时获得Fe3O4和氢气。写出该反应的化学方程式_____________ ,该反应中属于电解质但不属于氧化物的物质是________________ (填化学式),若制得22.4L(折算为标准状况下)钠蒸气,转移电子的数目为________________ 。
(3)漂白粉常用于饮水、污水、排泄物及被污染的环境消毒,其主要成分是氯化钙和次氯酸钙[Ca(ClO)2],有效成分为次氯酸钙。为测得某漂白粉的有效成分含量,称取A g漂白粉样品溶解,往所得溶液中通入CO2至不再产生沉淀为止,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,若反应生成次氯酸(HClO)的物质的量为Kmol,则该漂白粉中有效成分的质量分数为___________ %(用含A、K的式子表示)。
(1)高铁酸钠(Na2FeO4)可作为高效、多功能水处理剂,其摩尔质量是
(2)戴维通过电解法首先制得了金属钠,随后几十年内,工业上采用铁粉和氢氧化钠高温熔融的方法制得钠蒸气,同时获得Fe3O4和氢气。写出该反应的化学方程式
(3)漂白粉常用于饮水、污水、排泄物及被污染的环境消毒,其主要成分是氯化钙和次氯酸钙[Ca(ClO)2],有效成分为次氯酸钙。为测得某漂白粉的有效成分含量,称取A g漂白粉样品溶解,往所得溶液中通入CO2至不再产生沉淀为止,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,若反应生成次氯酸(HClO)的物质的量为Kmol,则该漂白粉中有效成分的质量分数为
您最近一年使用:0次
4 . 碳酸亚铁可用于制备补血剂。某研究小组制备了FeCO3,并对FeCO3的性质和应用进行了探究。
已知:①FeCO3是白色固体,难溶于水
②Fe2++6SCN- Fe(SCN)64-(无色)
Fe(SCN)64-(无色)
Ⅰ.FeCO3的制取(夹持装置略)
实验i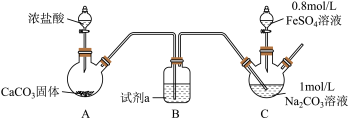
装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a是__ 。
(2)向Na2CO3溶液通入CO2的目的是__ 。
(3)C装置中制取FeCO3的离子方程式为__ 。
(4)有同学认为C中出现白色沉淀之后应继续通CO2,你认为是否合理并说明理由__ 。
Ⅱ.FeCO3的性质探究
实验ii
实验iii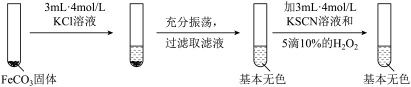
(5)对比实验ⅱ和ⅲ,得出的实验结论是__ 。
(6)依据实验ⅱ的现象,写出加入10%H2O2溶液的离子方程式__ 。
Ⅲ.FeCO3的应用
(7)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,此反应的离子方程式为__ 。该实验小组用KMnO4测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因是__ (不考虑操作不当引起的误差)。
已知:①FeCO3是白色固体,难溶于水
②Fe2++6SCN-
 Fe(SCN)64-(无色)
Fe(SCN)64-(无色)Ⅰ.FeCO3的制取(夹持装置略)
实验i

装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a是
(2)向Na2CO3溶液通入CO2的目的是
(3)C装置中制取FeCO3的离子方程式为
(4)有同学认为C中出现白色沉淀之后应继续通CO2,你认为是否合理并说明理由
Ⅱ.FeCO3的性质探究
实验ii

实验iii

(5)对比实验ⅱ和ⅲ,得出的实验结论是
(6)依据实验ⅱ的现象,写出加入10%H2O2溶液的离子方程式
Ⅲ.FeCO3的应用
(7)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,此反应的离子方程式为
您最近一年使用:0次
解题方法
5 . 某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
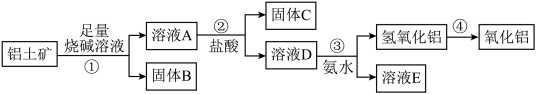
(1)固体B的主要用途有(写出1条即可)_________________________ 。
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:_______________ ;________________ 。
(3)第③步中,生成氢氧化铝的离子方程式是_________________ 。 若往A溶液中通入足量CO2,请写出可能发生反应的离子方程式______________ 。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是_____________________ 。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数。(写出计算过程,计算结果保留一位小数)

(1)固体B的主要用途有(写出1条即可)
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:
(3)第③步中,生成氢氧化铝的离子方程式是
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数。(写出计算过程,计算结果保留一位小数)
您最近一年使用:0次
6 . 某研究性学习小组欲由硫铁矿烧渣(主要成分为Fe、Fe2O3、SiO2、Al2O3)制备绿矾(FeSO4·7H2O)并测定烧渣中铁元素的含量,流程图如下:

(1)操作a的名称是_____________ 。
(2)加入足量试剂X后,发生反应的离子方程式为_____________ 、_____________ 。
(3)向溶液2中滴加KSCN溶液,无明显现象。向固体中加入足量稀硫酸后,发生氧化还原反应的离子方程式是_______ 、_________ 。
(4)硫铁矿烧渣中铁元素的质量分数为________ 。

(1)操作a的名称是
(2)加入足量试剂X后,发生反应的离子方程式为
(3)向溶液2中滴加KSCN溶液,无明显现象。向固体中加入足量稀硫酸后,发生氧化还原反应的离子方程式是
(4)硫铁矿烧渣中铁元素的质量分数为
您最近一年使用:0次
名校
7 . 现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出下列物质的名称:X___________ 。
(2)鉴别B在溶液中产生的阴离子的实验操作方法是___________ 。
(3)按要求完成以下水溶液中的反应方程式:
i.A溶液与B溶液反应的离子方程式:___________ 。
ii.B溶液与E沉淀反应的化学方程式:___________ 。
iii.写出B与C反应至溶液呈中性的离子方程式:___________ 。
(4)D与E的混合物ag,加入足量盐酸,充分反应后生成标准状况时的气体bL,则D在混合物中的质量分数为___________ 。
| 阳离子 | Na+、H+、Ba+ |
| 阴离子 | OH-、 、 、 |
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出下列物质的名称:X
(2)鉴别B在溶液中产生的阴离子的实验操作方法是
(3)按要求完成以下水溶液中的反应方程式:
i.A溶液与B溶液反应的离子方程式:
ii.B溶液与E沉淀反应的化学方程式:
iii.写出B与C反应至溶液呈中性的离子方程式:
(4)D与E的混合物ag,加入足量盐酸,充分反应后生成标准状况时的气体bL,则D在混合物中的质量分数为
您最近一年使用:0次
解题方法
8 . (NH4)2Fe(SO4)2·6H2O俗称摩尔盐(M=392g·mol-1)是分析化学中重要的标准物质,某研究小组拟采用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)为原料制取摩尔盐,设计了如下流程:

(1)写出试剂X的化学式__________ 。
(2)写出“溶液1”中某种离子与NaOH反应生成“溶液2”中离子的离子方程式________ 。
(3)操作A为蒸发浓缩至_________ 、冷却结晶、过滤、洗涤、干燥。其中过滤操作可用如图装置进行,请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→_________ →d→c→关抽气泵。

a.转移固液混合物
b.关活塞A
c.开活塞A
d.确认抽干
e.加洗涤剂洗涤
(4)实验制得的摩尔盐的纯度可用Ce(SO4)2标准溶液滴定进行测定。滴定反应为Fe2++Ce4+=Fe3++Ce3+。测定时,先称取4.000g样品,配成100mL溶液,取出其中20.00mL放入锥形瓶中,对溶液进行必要处理后,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表:
①产品中摩尔盐的纯度为__________ (用质量分数表示,保留4位有效数字)。
②若滴定过程中没有润洗滴定管,则会造成样品纯度______ (填“偏高”、“偏低”或“无影响”)

(1)写出试剂X的化学式
(2)写出“溶液1”中某种离子与NaOH反应生成“溶液2”中离子的离子方程式
(3)操作A为蒸发浓缩至

a.转移固液混合物
b.关活塞A
c.开活塞A
d.确认抽干
e.加洗涤剂洗涤
(4)实验制得的摩尔盐的纯度可用Ce(SO4)2标准溶液滴定进行测定。滴定反应为Fe2++Ce4+=Fe3++Ce3+。测定时,先称取4.000g样品,配成100mL溶液,取出其中20.00mL放入锥形瓶中,对溶液进行必要处理后,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表:
| 滴定次数 | 0.1000mol·L-1Ce(SO4)2标准溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | |
| 1 | 0.10 | 20.12 |
| 2 | 0.12 | 20.10 |
| 3 | 0.05 | 21.65 |
②若滴定过程中没有润洗滴定管,则会造成样品纯度
您最近一年使用:0次
名校
解题方法
9 . 某氯化铁(FeCl3)样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行,根据流程回答以下问题:

(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_______ 、_______ 。
(2)写出加入氯水发生的离子反应方程式________________________________ 。
(3)写出加入过量氨水发生的离子反应方程式_______________________________ 。
(4)写出灼烧发生反应的化学方程式_______________________________ 。
(5)检验沉淀是否已经洗涤干净的操作是______________________________ 。
(6)下列操作可能使所配溶液浓度偏小的是__________ (填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(7)若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是_____________ 。

(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
(2)写出加入氯水发生的离子反应方程式
(3)写出加入过量氨水发生的离子反应方程式
(4)写出灼烧发生反应的化学方程式
(5)检验沉淀是否已经洗涤干净的操作是
(6)下列操作可能使所配溶液浓度偏小的是
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(7)若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是
您最近一年使用:0次
2019-12-30更新
|
136次组卷
|
2卷引用:西藏自治区拉萨市那曲第二高级中学2019-2020学年高一上学期期末考试化学试题
解题方法
10 . 过氧化钠保存不当容易变质。某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取2.0g样品,并设计用下图装置来测定过氧化钠的质量分数。图中的E和F构成量气装置,用来测定O2的体积。

(1)写出装置A中两种主要玻璃仪器的名称__________ 、_______ 。
(2)写出装置A中发生的离子方程式____________________________ 。
(3)装置B的作用是______________________________ 。
(4)写出装置C中发生反应的主要化学方程式:______________________________ 。
(5)装置D中 NaOH的作用是________________________________________ 。
(6)他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为224mL,则样品中过氧化钠的质量分数为__________

(1)写出装置A中两种主要玻璃仪器的名称
(2)写出装置A中发生的离子方程式
(3)装置B的作用是
(4)写出装置C中发生反应的主要化学方程式:
(5)装置D中 NaOH的作用是
(6)他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为224mL,则样品中过氧化钠的质量分数为
您最近一年使用:0次



