1 . CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)=CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:___________ 。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入30mL蒸馏水和2 mL盐酸(3mol∙L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5mLKI溶液(100g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后________ ,用硫代硫酸钠标准溶液继续滴定,________ ,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2=Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是___________ 。
(3)加入KI溶液后发生反应的离子方程式为____________ 。
(4)请补充完整实验步骤4中的内容:____________ ;____________ 。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)=CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入30mL蒸馏水和2 mL盐酸(3mol∙L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5mLKI溶液(100g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2=Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是
(3)加入KI溶液后发生反应的离子方程式为
(4)请补充完整实验步骤4中的内容:
您最近一年使用:0次
2014·陕西西安·二模
名校
2 . CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
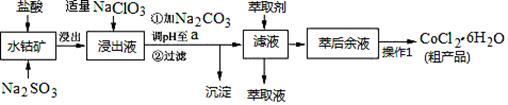
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式_________________ 。
(2)写出NaClO3发生反应的主要离子方程式________________ ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________ 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为___________________ 。
(4)“操作1”中包含3个基本实验操作,它们依次是_____________ 、____________ 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________ 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是______________ ;其使用的最佳pH范围是_________ 。
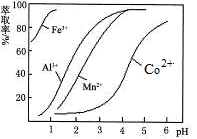
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是______________________ 。(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式
(2)写出NaClO3发生反应的主要离子方程式
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为
(4)“操作1”中包含3个基本实验操作,它们依次是
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
您最近一年使用:0次
2016-12-09更新
|
576次组卷
|
6卷引用:2017届湖北省襄阳五中高三上8月开学考化学试卷
名校
解题方法
3 . Ⅰ氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用 NH3将 NOx还原生成N2.某同学在实验室中制备 NH3.回答下列问题:
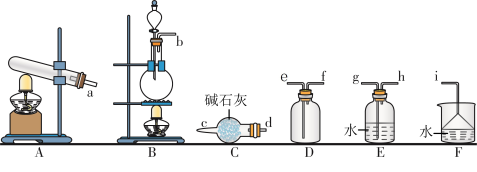
(1)氨气的发生装置可以选择上图中的___________ ,反应的化学方程式为___________ 。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______ →________ →______ →________ →_______ (按气流方向,用小写字母表示 )。
Ⅱ亚硝酰氯(NOCl)是一种黄色气体,沸点为-5.5℃。其液体呈红褐色。遇水发生反应: 2NOCl +H2O = 2HCl + NO↑+NO2↑。某化学兴趣小组设计如图装置用 Cl2和 NO 制备 NOCl。回答下列相关问题:
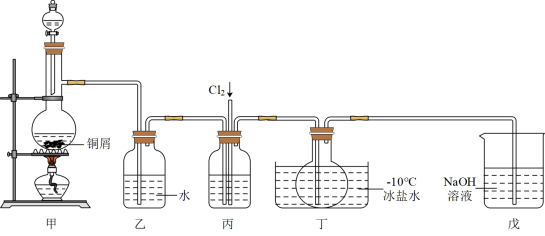
(3)甲装置发生反应的离子方程式为___________ , 装置丙中的液体为___________ 。
(4)实验时,先通入 Cl2,待丁中烧瓶内充满黄绿色气体时,再通入 NO,这样做的目的是___________ 。
(5)装置丁中冰盐水的作用是___________ 。
(6)经分析该套装置设计上有一处明显缺陷,改进方法是___________ (用文字描述)。
(7)吸收尾气时,NOCl 发生反应的化学方程式为___________ 。 (已知:NO+NO2+2NaOH = 2NaNO2+H2O)
(8)反应完成后,取烧瓶中所得产物 mg 溶于水,配制成 250mL 溶液,取出 25.00mL,再加入 VmL cmol/L AgNO3溶液恰好完全反应,则产物中 NOCl 纯度(质量分数)的计算式为___________ 。

(1)氨气的发生装置可以选择上图中的
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→
Ⅱ亚硝酰氯(NOCl)是一种黄色气体,沸点为-5.5℃。其液体呈红褐色。遇水发生反应: 2NOCl +H2O = 2HCl + NO↑+NO2↑。某化学兴趣小组设计如图装置用 Cl2和 NO 制备 NOCl。回答下列相关问题:

(3)甲装置发生反应的离子方程式为
(4)实验时,先通入 Cl2,待丁中烧瓶内充满黄绿色气体时,再通入 NO,这样做的目的是
(5)装置丁中冰盐水的作用是
(6)经分析该套装置设计上有一处明显缺陷,改进方法是
(7)吸收尾气时,NOCl 发生反应的化学方程式为
(8)反应完成后,取烧瓶中所得产物 mg 溶于水,配制成 250mL 溶液,取出 25.00mL,再加入 VmL cmol/L AgNO3溶液恰好完全反应,则产物中 NOCl 纯度(质量分数)的计算式为
您最近一年使用:0次
名校
解题方法
4 . 某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是_____ ,操作②的名称是_____ 。
(2)试剂a是____ (填化学式,下同),固体B是____ 。
(3)加入试剂a所发生反应的化学方程式为____ 。加入试剂b所发生反应的离子方程式为________ 。
(4)该方案能否达到实验目的:_______ (填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)______ 。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是_____ 的质量。

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是
(2)试剂a是
(3)加入试剂a所发生反应的化学方程式为
(4)该方案能否达到实验目的:
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是
您最近一年使用:0次
名校
解题方法
5 . 某氯化铁(FeCl3)样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行,根据流程回答以下问题:

(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_______ 、_______ 。
(2)写出加入氯水发生的离子反应方程式________________________________ 。
(3)写出加入过量氨水发生的离子反应方程式_______________________________ 。
(4)写出灼烧发生反应的化学方程式_______________________________ 。
(5)检验沉淀是否已经洗涤干净的操作是______________________________ 。
(6)下列操作可能使所配溶液浓度偏小的是__________ (填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(7)若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是_____________ 。

(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
(2)写出加入氯水发生的离子反应方程式
(3)写出加入过量氨水发生的离子反应方程式
(4)写出灼烧发生反应的化学方程式
(5)检验沉淀是否已经洗涤干净的操作是
(6)下列操作可能使所配溶液浓度偏小的是
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(7)若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是
您最近一年使用:0次
2019-12-30更新
|
136次组卷
|
2卷引用:西藏自治区拉萨市那曲第二高级中学2019-2020学年高一上学期期末考试化学试题
名校
解题方法
6 . 工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:
Cr2O72﹣+ Fe2++ H+- Cr3++ Fe3++ H2O
现有0.12g工业甲醇,在H2SO4溶液中与25mL0.2mol•L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1mol•L-1FeSO4与其反应,结果用去FeSO4溶液9.6mL。
(1)配平第②步中离子方程式___ 。
(2)计算工业甲醇的质量分数___ 。
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:
Cr2O72﹣+ Fe2++ H+- Cr3++ Fe3++ H2O
现有0.12g工业甲醇,在H2SO4溶液中与25mL0.2mol•L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1mol•L-1FeSO4与其反应,结果用去FeSO4溶液9.6mL。
(1)配平第②步中离子方程式
(2)计算工业甲醇的质量分数
您最近一年使用:0次
名校
7 . 二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
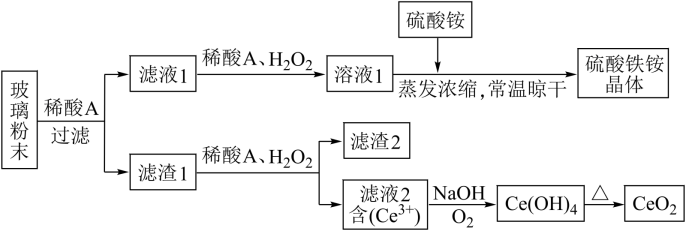
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)滤液1中加入H2O2溶液的目的是____________________________________________________ 。
(2)设计实验证明滤液1中含有Fe2+__________________________________________________________ 。
(3)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________________________________________________________________ 。
(4)由滤液2生成Ce(OH)4的离子方程式______________________________________________ 。
(5)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000 mol·L-1的FeSO4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为______________ (结果保留两位有效数字),Mr(Ce)=140。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)滤液1中加入H2O2溶液的目的是
(2)设计实验证明滤液1中含有Fe2+
(3)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式
(4)由滤液2生成Ce(OH)4的离子方程式
(5)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000 mol·L-1的FeSO4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为
您最近一年使用:0次
2018-11-24更新
|
313次组卷
|
2卷引用:【全国百强校】山东省济南市历城第二中学2019届高三上学期11月调研检测化学试题
名校
解题方法
8 . 利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2•xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________ 。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2•xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________ 。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为____________________________ 。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________ 。
(5)步骤④的离子方程式是_________________________________________ 。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及___________________ 。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______ (用a表示)。

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2•xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2•xH2O滤渣,用平衡移动的原理解释得到滤渣的原因
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因
(5)步骤④的离子方程式是
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为
您最近一年使用:0次
2018-03-26更新
|
496次组卷
|
3卷引用:【全国百强校】山东省济南市外国语学校2019届高三上学期第一次月考化学试题
9 . 按照要求填空。
(1)下列各物质所含原子数按照由大到小的顺序排列为(填序号)__________________ 。
①0.5molCO2 ②标准状况下,22.4L氦气 ③4℃时,18mL水 ④0.2molH2SO4
(2)在质量分数为28%的KOH水溶液中,OH-与H2O的个数之比为__________ 。
(3)仅用H2SO4、HNO3、CH3COOH与NaOH、Ba(OH)2、Cu(OH)2在水溶液中进行反应,符合离子方程式H++OH—=H2O的反应有__________ 个。
(4)工业上用氯气和硝酸铁在烧碱溶液中可以制备净水剂高铁酸钠,试补充完整化学反应方程式并配平Fe(NO3)3+Cl2+NaOH——________________________________________ 。
(5)将mg铁粉与含有H2SO4的CuSO4溶液完全反应,铁粉全部溶解,并得到mg铜,则参加反应的H2SO4与CuSO4的物质的量之比为_____________ 。
(6)一定条件下,下列物质可以通过化合反应制得的有(写序号)______________________ 。
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(7)现有镁铝合金10.2g,将其置于500mL4mol/L的盐酸中充分反应后无金属剩余,若向反应后的溶液中加入1000mL烧碱溶液,使得沉淀达到最大值,则加入的烧碱的物质的量浓度为____ mol/L。
(8)某常见的氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得生成的氮气和二氧化碳的物质的量之比为1:2,则该氮的氧化物的化学式为_____________ 。
(9)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水,当生成amol硝酸锌时,被还原的硝酸的物质的量为______________________ mol。
(10)将一定量的锌与100mL18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成16.8升标况气体,将反应后的溶液稀释到1L,测得溶液中c(H+)=1mol/L,则气体中SO2为________________ mol。
(1)下列各物质所含原子数按照由大到小的顺序排列为(填序号)
①0.5molCO2 ②标准状况下,22.4L氦气 ③4℃时,18mL水 ④0.2molH2SO4
(2)在质量分数为28%的KOH水溶液中,OH-与H2O的个数之比为
(3)仅用H2SO4、HNO3、CH3COOH与NaOH、Ba(OH)2、Cu(OH)2在水溶液中进行反应,符合离子方程式H++OH—=H2O的反应有
(4)工业上用氯气和硝酸铁在烧碱溶液中可以制备净水剂高铁酸钠,试补充完整化学反应方程式并配平Fe(NO3)3+Cl2+NaOH——
(5)将mg铁粉与含有H2SO4的CuSO4溶液完全反应,铁粉全部溶解,并得到mg铜,则参加反应的H2SO4与CuSO4的物质的量之比为
(6)一定条件下,下列物质可以通过化合反应制得的有(写序号)
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(7)现有镁铝合金10.2g,将其置于500mL4mol/L的盐酸中充分反应后无金属剩余,若向反应后的溶液中加入1000mL烧碱溶液,使得沉淀达到最大值,则加入的烧碱的物质的量浓度为
(8)某常见的氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得生成的氮气和二氧化碳的物质的量之比为1:2,则该氮的氧化物的化学式为
(9)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水,当生成amol硝酸锌时,被还原的硝酸的物质的量为
(10)将一定量的锌与100mL18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成16.8升标况气体,将反应后的溶液稀释到1L,测得溶液中c(H+)=1mol/L,则气体中SO2为
您最近一年使用:0次
10 . 聚合化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝Al2(OH)nCl6-n。本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:

根据流程图回答下列问题:
(1)“煅烧”的目的是_____________ 。
(2)配制质量分数15%的盐酸需要200ml30%的浓盐酸(密度约为1.15g·cm-3)和__________ g蒸馏水,配制用到的仪器有____________ 。
(3)“溶解”过程中发生反应的离子方程式为_____________ 。
(4)加少量铝粉的主要作用是_____________ 。
(5)“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是_______________ 。
(6)若溶解过程改为加入一定浓度的氢氧化钠溶液,发生反应的离子方程式为_______________ 。

根据流程图回答下列问题:
(1)“煅烧”的目的是
(2)配制质量分数15%的盐酸需要200ml30%的浓盐酸(密度约为1.15g·cm-3)和
(3)“溶解”过程中发生反应的离子方程式为
(4)加少量铝粉的主要作用是
(5)“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是
(6)若溶解过程改为加入一定浓度的氢氧化钠溶液,发生反应的离子方程式为
您最近一年使用:0次



