真题
解题方法
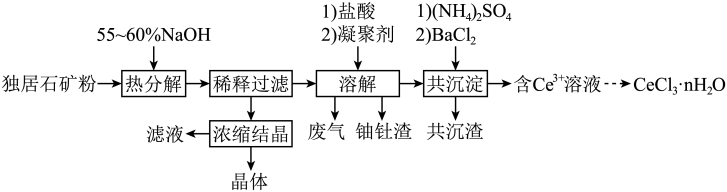
1 . 稀土是国家的战略资源之一。以下是一种以独居石【主要成分为CePO4.含有Th3(PO4)4、U3O8和少量镭杂质】为原料制备CeCl3•nH2O的工艺流程图。
ⅱ.镭为第ⅡA族元素
回答下列问题:
(1)关于独居石的热分解,以下说法正确的是_______ (填标号)。
a.降低压强,分解速率增大 b.降低温度,分解速率降低
c.反应时间越长,分解速率越大 d.提高搅拌速度,分解速率降低
(2)Na2U2O7中铀元素的化合价为_______ ,热分解阶段U3O8生成Na2U2O7的化学反应方程式为 _______ 。
(3)浓缩结晶后,得到的晶体产物化学式为_______ ,滤液可用于 _______ 阶段循环利用,避免产生大量的高碱度废水。
(4)溶解阶段,将溶液pH先调到1.5~2.0,反应后再回调至4.5。
①盐酸溶解Ce(OH)4的离子方程式为_______ 。
②当溶液pH=4.5时,c(Th4+)=_______ mol/L,此时完全转化为氢氧化钍沉淀。
(5)以BaSO4为载体形成共沉淀,目的是去除杂质_______ 。
ⅱ.镭为第ⅡA族元素
回答下列问题:
(1)关于独居石的热分解,以下说法正确的是
a.降低压强,分解速率增大 b.降低温度,分解速率降低
c.反应时间越长,分解速率越大 d.提高搅拌速度,分解速率降低
(2)Na2U2O7中铀元素的化合价为
(3)浓缩结晶后,得到的晶体产物化学式为
(4)溶解阶段,将溶液pH先调到1.5~2.0,反应后再回调至4.5。
①盐酸溶解Ce(OH)4的离子方程式为
②当溶液pH=4.5时,c(Th4+)=
(5)以BaSO4为载体形成共沉淀,目的是去除杂质
您最近一年使用:0次
2 . 工业上煅烧含硫矿物产生的 可以按如下流程脱除或利用。
可以按如下流程脱除或利用。
(1)富氧煅烧燃煤产生的低浓度的 可以在炉内添加
可以在炉内添加 通过途径Ⅰ脱除,写出反应方程式
通过途径Ⅰ脱除,写出反应方程式___________ 。
(2)煅烧含硫量高的矿物得到高浓度的 ,通过途径Ⅱ最终转化为化合物A。
,通过途径Ⅱ最终转化为化合物A。
①下列说法正确的是___________ 。
A.燃煤中的有机硫主要呈正价 B.化合物A具有酸性
C.化合物A是一种无机酸酯 D.工业上途径Ⅱ产生的 也可用浓
也可用浓 吸收
吸收
②一定压强下,化合物A的沸点低于硫酸的原因是___________ 。
(3)设计实验验证化合物A中含有S元素_____ ;写出实验过程中涉及的反应方程式____ 。
 可以按如下流程脱除或利用。
可以按如下流程脱除或利用。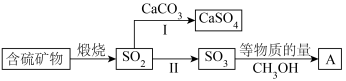
已知: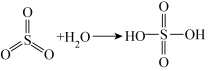
(1)富氧煅烧燃煤产生的低浓度的
 可以在炉内添加
可以在炉内添加 通过途径Ⅰ脱除,写出反应方程式
通过途径Ⅰ脱除,写出反应方程式(2)煅烧含硫量高的矿物得到高浓度的
 ,通过途径Ⅱ最终转化为化合物A。
,通过途径Ⅱ最终转化为化合物A。①下列说法正确的是
A.燃煤中的有机硫主要呈正价 B.化合物A具有酸性
C.化合物A是一种无机酸酯 D.工业上途径Ⅱ产生的
 也可用浓
也可用浓 吸收
吸收②一定压强下,化合物A的沸点低于硫酸的原因是
(3)设计实验验证化合物A中含有S元素
您最近一年使用:0次
2023-06-21更新
|
6997次组卷
|
7卷引用:2023年高考浙江卷化学真题(6月)
2023年高考浙江卷化学真题(6月)(已下线)第12讲 硫及其化合物(已下线)考点15 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建湖南省浏阳市2024届高三上学期12月月考化学试题(已下线)第05讲 工业流程解题策略(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
真题
名校
3 . 聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。下列说法不正确 的是
| A.KClO3作氧化剂,每生成1 mol [Fe(OH)SO4]n消耗6/n mol KClO3 |
| B.生成聚合硫酸铁后,水溶液的pH增大 |
| C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水 |
| D.在相同条件下,Fe3+比[Fe(OH)]2+的水解能力更强 |
您最近一年使用:0次
2019-04-12更新
|
6183次组卷
|
37卷引用:2019年4月浙江省普通高校招生选考科目考试化学试题
2019年4月浙江省普通高校招生选考科目考试化学试题福建省华安一中2018-2019学年高二下学期期末考试化学试题湖南省长沙市第一中学2020届高三第一次月考化学试题江西省宜春市奉新县第一中学2020届高三上学期第二次月考化学试题黑龙江省牡丹江市第一高级中学2020届高三10月月考化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题2020届高考化学小题狂练(全国通用版)专练5 氧化还原反应辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题江西省吉安市五校2019-2020学年高二上学期第二次联考化学试题2020届高三化学化学二轮复习——高考常考题:氧化还原反应的实际应用【精编选择25题】专题1.3 氧化还原反应(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题六 元素化合物的性质、应用及转化(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)广东省佛山市第一中学2020-2021学年高二上学期期中考试化学(选考)试题安徽省池州市第一中学2020-2021学年高二12月月考化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练上海交通大学附属中学2021届高三下学期3月月考化学试题(已下线)课时17 铁及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)3.3.1 盐类的水解-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题05.元素及其化合物-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)湖南省长沙市雅礼中学2022-2023学年高三上学期第五次月考化学试题第三章 金属及其化合物 第13讲 铁及其重要化合物湖南省株洲市第四中学2023届高三第六次月考化学试题(已下线)题型27 铁及其化合物的性质、用途及相关计算重庆市万州第二高级中学2022-2023学年高三下学期5月月考化学试题新疆喀什地区伽师县2022-2023学年高三上学期11月期中考试化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)北京市第八十中学2024届高三上学期10月月考化学试题化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷(已下线)专题11盐类的水解测试练习
4 . 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为_______ 。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中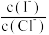 为:
为:_______ ,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) =H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_______ kJ。
(4)Bodensteins研究了下列反应:2HI(g)⇌H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
①根据上述实验结果,该反应的平衡常数K的计算式为:_______ 。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为_______ (以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=_______ min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_______ (填字母)

(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中
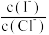 为:
为:(3)已知反应2HI(g) =H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为
(4)Bodensteins研究了下列反应:2HI(g)⇌H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为

您最近一年使用:0次
2019-01-30更新
|
7326次组卷
|
9卷引用:2015年全国普通高等学校招生统一考试化学(新课标I卷)
5 . [化学-选修2:化学与技术]
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是_______ ,循环使用的|原料是______ ,配制工作液时采用有机溶剂而不采用水的原因是______ 。
(2)氢化釜A中反应的化学方程式为_______ ,进入氧化塔C的反应混合液中的主要溶质为_______ 。
(3)萃取塔D中的萃取剂是____ ,选择其作萃取剂的原因是______ 。
(4)工作液再生装置F中要除净残留的H2O2,原因是______ 。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______ 。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______ mol/L。
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:

生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是
(2)氢化釜A中反应的化学方程式为
(3)萃取塔D中的萃取剂是
(4)工作液再生装置F中要除净残留的H2O2,原因是
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为
您最近一年使用:0次
2019-01-30更新
|
3011次组卷
|
5卷引用:2016年全国普通高等学校招生统一考试化学(新课标2卷精编版)



