名校
1 . 向mg由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成NO的体积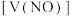 (已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
(已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
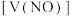 (已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
(已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是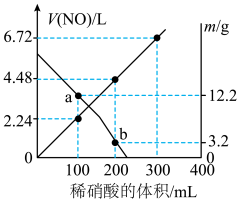
| A.a点时,100mL稀硝酸中溶解了Fe粉5.6g |
B.稀硝酸的浓度为 |
| C.加入稀硝酸的体积从300mL至400mL,期间收集产生的NO物质的量约为0.0083mol |
D.b点对应的溶液中可能含有的金属阳离子为 、 、 和 和 |
您最近一年使用:0次
解题方法
2 . 在一定量铁的氧化物 (铁只有
(铁只有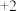 、
、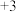 价)中,加入
价)中,加入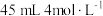 硫酸溶液,恰好使固体完全溶解,所得溶液中
硫酸溶液,恰好使固体完全溶解,所得溶液中 恰好被标准状况下
恰好被标准状况下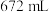 氯气氧化,则该固体中x和y的个数之比为
氯气氧化,则该固体中x和y的个数之比为
 (铁只有
(铁只有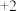 、
、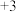 价)中,加入
价)中,加入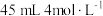 硫酸溶液,恰好使固体完全溶解,所得溶液中
硫酸溶液,恰好使固体完全溶解,所得溶液中 恰好被标准状况下
恰好被标准状况下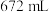 氯气氧化,则该固体中x和y的个数之比为
氯气氧化,则该固体中x和y的个数之比为A.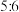 | B.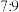 | C.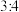 | D. |
您最近一年使用:0次
名校
解题方法
3 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为_________ (填序号)。
甲. 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入_________ ;②加入_________ 。
(3)向等浓度的 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为_________ 。
(4)已知下列四种氧化剂(均可氧化 )对应的还原产物情况如下:
)对应的还原产物情况如下:
请判断,等物质的量的四种氧化剂分别与足量 作用,得到
作用,得到 最多的是
最多的是___________ 。
(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为 ),可用如图转化方式除去。
),可用如图转化方式除去。
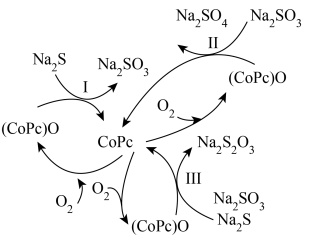
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为___________ 。
②在废水处理整个过程中,催化剂为___________ ,氧化剂为___________ 。
③反应Ⅲ中 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式_________________ 。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 |  |  (酸化) (酸化) |  (酸化) (酸化) |  |  |  |
| 浓度 | 0.10M(M为物质的量浓度的单位) | |||||
电位值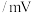 | 171 | 1130 | 603 | 662 | 116 | -361 |
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为
甲.
 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于
 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入(3)向等浓度的
 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为(4)已知下列四种氧化剂(均可氧化
 )对应的还原产物情况如下:
)对应的还原产物情况如下:| 氧化剂 |  |  |  |  |
| 还原产物 |  |  |  |  |
 作用,得到
作用,得到 最多的是
最多的是(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为
 ),可用如图转化方式除去。
),可用如图转化方式除去。
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为
②在废水处理整个过程中,催化剂为
③反应Ⅲ中
 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式
您最近一年使用:0次
2023-12-04更新
|
380次组卷
|
2卷引用:山东省青岛市莱西市2023-2024学年高一上学期11月期中考试化学试题
4 . 向 和
和 的混合溶液中不断通入
的混合溶液中不断通入 ,溶液中n(含碘的某微粒)和n(含铁的某微粒)随
,溶液中n(含碘的某微粒)和n(含铁的某微粒)随 的变化曲线如图所示。(已知:①
的变化曲线如图所示。(已知:① 可将
可将 氧化成
氧化成 ;②
;②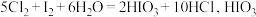 为强酸)下列说法中错误的是
为强酸)下列说法中错误的是

 和
和 的混合溶液中不断通入
的混合溶液中不断通入 ,溶液中n(含碘的某微粒)和n(含铁的某微粒)随
,溶液中n(含碘的某微粒)和n(含铁的某微粒)随 的变化曲线如图所示。(已知:①
的变化曲线如图所示。(已知:① 可将
可将 氧化成
氧化成 ;②
;②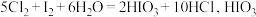 为强酸)下列说法中错误的是
为强酸)下列说法中错误的是
A.还原性: |
B.b点溶液中 |
C.a点时已通入标准状况下氯气的总体积为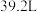 |
D.c点溶液中阴离子的个数为 |
您最近一年使用:0次
2023-12-01更新
|
875次组卷
|
4卷引用:广东省深圳市七校2023-2024学年高一上学期期中联考化学试题
名校
解题方法
5 . 二氟草酸硼酸锂(LiBF2C2O4)热稳定性好,在较宽的温度范围内具有良好的离子电导率,对水分不敏感,被认为是最有希望取代六氟磷酸锂的电解质锂盐。由锂精矿(主要成分有LiAlSi2O6还含有少量Fe2+等离子)制备LiBF2C2O4的工艺如下。
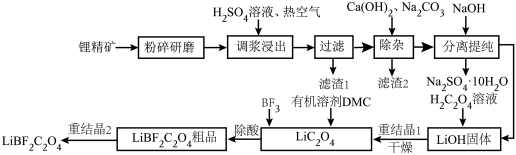
回答下列问题:
(1)调浆浸出时通入热空气的作用是___________ (用离子方程式表示)。
(2)锂精矿中所有的Al元素和Si元素以某种铝硅酸盐从滤渣1中分离,该铝硅酸盐的化学式为___________ ,滤渣2的主要成分是CaCO3和___________ (填化学式)。
(3)分离提纯的步骤,将滤液蒸发浓缩,加入NaOH后,冷却到-5~-15℃分离出Na2SO4·10H2O。再将分离后的母液___________ 、___________ (填简要操作),得到LiOH固体。
(4)在较短的反应时间内,BF3和Li2C2O4反应时的比例对产物组成的影响如下表所示。
①一般认为BF3和Li2C2O4反应分两步进行:
第一步:Li2C2O4+BF3=LiBF2C2O4+LiFEa1
第二步:___________ Ea2
请补齐第二步反应,并判断两步反应的活化能Ea1___________ (填“>”或“<”)Ea2。
②为避免药品浪费,反应的最佳比例n(BF3):n(Li2C2O4)=___________ 。
(5)BF3和环境中微量的水反应会生成酸性物质,影响产品的纯度和性质,用Li2CO3比用LiOH除酸更好的原因是___________ 。
(6)LiBF2C2O4的阴离子含五元环状结构,且B最外层为8e-构型,请你补全LiBF2C2O4的结构式:_____ 。
Li+[ _____ ]。

回答下列问题:
(1)调浆浸出时通入热空气的作用是
(2)锂精矿中所有的Al元素和Si元素以某种铝硅酸盐从滤渣1中分离,该铝硅酸盐的化学式为
(3)分离提纯的步骤,将滤液蒸发浓缩,加入NaOH后,冷却到-5~-15℃分离出Na2SO4·10H2O。再将分离后的母液
(4)在较短的反应时间内,BF3和Li2C2O4反应时的比例对产物组成的影响如下表所示。
| n(BF3):n(Li2C2O4) | 产物组成 |
| 0.5 1.0 1.5 2.0 2.5 | LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4 LiBF2C2O4、LiBF4 |
第一步:Li2C2O4+BF3=LiBF2C2O4+LiFEa1
第二步:
请补齐第二步反应,并判断两步反应的活化能Ea1
②为避免药品浪费,反应的最佳比例n(BF3):n(Li2C2O4)=
(5)BF3和环境中微量的水反应会生成酸性物质,影响产品的纯度和性质,用Li2CO3比用LiOH除酸更好的原因是
(6)LiBF2C2O4的阴离子含五元环状结构,且B最外层为8e-构型,请你补全LiBF2C2O4的结构式:
Li+[ _____ ]。
您最近一年使用:0次
2023-05-17更新
|
592次组卷
|
3卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
6 . 将Cl2通入含a mol NaOH的溶液中,反应会放热,温度升高后发生反应: 3Cl2+6NaOH = 5NaCl+NaClO3+3H2O。当NaOH完全反应时,下列说法正确的是
| A.反应中作氧化剂的Cl2有0.25a mol |
B.若反应后溶液中 =2,则 =2,则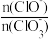 =5 =5 |
C.NaClO与NaClO3的物质的量之和可能为 a mol a mol |
D.反应中转移电子的物质的量可能为 a mol a mol |
您最近一年使用:0次
2023-05-16更新
|
930次组卷
|
3卷引用:陕西省西安铁一中滨河高级中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
7 . 如图所示,实验室中利用洁净的铜片(0.3 mol)和浓硫酸进行反应,实验中无气体生成,Y型管左侧得到Cu2S和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。下列说法错误的是
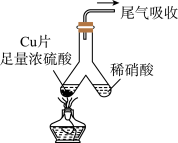

| A.白色固体为CuSO4 |
| B.NO为还原产物,b为氧化产物 |
| C.NO与b的物质的量之和可能为0.2 mol |
| D.参加反应的浓硫酸中,表现氧化性的占25% |
您最近一年使用:0次
2023-05-16更新
|
1192次组卷
|
3卷引用:辽宁省实验中学2023-2024学年高三上学期期中考试化学试题
名校
8 . 某小组同学制备碘酸盐( )并探究其性质。
)并探究其性质。
资料:① 可与
可与 溶液反应生成
溶液反应生成 和
和 。
。
②碘酸钙 [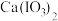 ]为难溶于水、能溶于硝酸的白色固体。
]为难溶于水、能溶于硝酸的白色固体。
③ 的氧化性,
的氧化性, 的还原性与溶液的酸碱性无关:
的还原性与溶液的酸碱性无关: 与氧化性随溶液酸性增强而增强(X为
与氧化性随溶液酸性增强而增强(X为 、
、 或I)。
或I)。
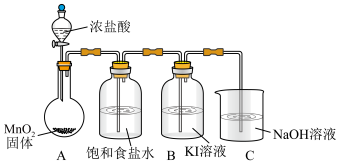
实验装置如图(加热与夹持装置略)
I.打开A中分液漏斗活塞,加热固底烧瓶;一段时间后,B中溶液由无色变为棕黄色。
II.将B中棕黄色溶液倒入烧杯中,再加入 溶液,烧杯中溶液由棕黄色变为无色。
溶液,烧杯中溶液由棕黄色变为无色。
(1)A装置发生的化学方程式为___________ 。
(2)C装置发生的离子方程式为___________ 。
(3)取少量步骤Ⅱ后所得无色溶液,加入过量盐酸和 ,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下
,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。
。
①乙同学认为上述结论不合理,可能原因如下:
原因一:空气中 在酸性条件下将溶液中的
在酸性条件下将溶液中的 氧化,离子方程式为
氧化,离子方程式为___________ 。
原因二:___________ (填化学式)在酸性条件下将溶液中的 氧化。
氧化。
②为了进一步证明在酸性条件下 可氧化
可氧化 为
为 ,完成如下实验:
,完成如下实验:
ⅰ.另取与(3)等量的步骤Ⅱ后所得无色溶液,加入稍过量 固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
ⅱ.向无色溶液X,加入与(3)等量的盐酸和 ,振荡后静置,溶液分层,上、下层均几乎无色。
,振荡后静置,溶液分层,上、下层均几乎无色。
ⅲ.取少量洗涤后的沉淀Y加入稀 ,固体溶解,继续加入少量KI溶液,溶液呈黄色。
,固体溶解,继续加入少量KI溶液,溶液呈黄色。
ⅳ.……
a.由实验ⅰ、ⅱ得出结论:___________ 。
b.由实验ⅲ和ⅳ得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。补全实验ⅳ的操作和现象
。补全实验ⅳ的操作和现象___________ 。
(4)根据实验ⅲ得出:氧化性
___________  (填“
(填“ ”或“
”或“ ”),而实验ⅰ表明
”),而实验ⅰ表明 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
(5)查阅资料发现,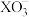 与相应的
与相应的 (
( ,
, )均有类似上述反应。浓度相同时,氧化性
)均有类似上述反应。浓度相同时,氧化性 ,但浓度均为
,但浓度均为 的
的 和
和 开始发生反应时的pH为1,而浓度均为
开始发生反应时的pH为1,而浓度均为 的
的 和
和 开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因___________ 。
 )并探究其性质。
)并探究其性质。资料:①
 可与
可与 溶液反应生成
溶液反应生成 和
和 。
。②碘酸钙 [
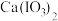 ]为难溶于水、能溶于硝酸的白色固体。
]为难溶于水、能溶于硝酸的白色固体。③
 的氧化性,
的氧化性, 的还原性与溶液的酸碱性无关:
的还原性与溶液的酸碱性无关: 与氧化性随溶液酸性增强而增强(X为
与氧化性随溶液酸性增强而增强(X为 、
、 或I)。
或I)。实验装置如图(加热与夹持装置略)
I.打开A中分液漏斗活塞,加热固底烧瓶;一段时间后,B中溶液由无色变为棕黄色。
II.将B中棕黄色溶液倒入烧杯中,再加入
 溶液,烧杯中溶液由棕黄色变为无色。
溶液,烧杯中溶液由棕黄色变为无色。(1)A装置发生的化学方程式为
(2)C装置发生的离子方程式为
(3)取少量步骤Ⅱ后所得无色溶液,加入过量盐酸和
 ,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下
,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。
。①乙同学认为上述结论不合理,可能原因如下:
原因一:空气中
 在酸性条件下将溶液中的
在酸性条件下将溶液中的 氧化,离子方程式为
氧化,离子方程式为原因二:
 氧化。
氧化。②为了进一步证明在酸性条件下
 可氧化
可氧化 为
为 ,完成如下实验:
,完成如下实验:ⅰ.另取与(3)等量的步骤Ⅱ后所得无色溶液,加入稍过量
 固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。ⅱ.向无色溶液X,加入与(3)等量的盐酸和
 ,振荡后静置,溶液分层,上、下层均几乎无色。
,振荡后静置,溶液分层,上、下层均几乎无色。ⅲ.取少量洗涤后的沉淀Y加入稀
 ,固体溶解,继续加入少量KI溶液,溶液呈黄色。
,固体溶解,继续加入少量KI溶液,溶液呈黄色。ⅳ.……
a.由实验ⅰ、ⅱ得出结论:
b.由实验ⅲ和ⅳ得出结论:在酸性条件下
 可以氧化
可以氧化 为
为 。补全实验ⅳ的操作和现象
。补全实验ⅳ的操作和现象(4)根据实验ⅲ得出:氧化性

 (填“
(填“ ”或“
”或“ ”),而实验ⅰ表明
”),而实验ⅰ表明 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是(5)查阅资料发现,
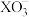 与相应的
与相应的 (
( ,
, )均有类似上述反应。浓度相同时,氧化性
)均有类似上述反应。浓度相同时,氧化性 ,但浓度均为
,但浓度均为 的
的 和
和 开始发生反应时的pH为1,而浓度均为
开始发生反应时的pH为1,而浓度均为 的
的 和
和 开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
您最近一年使用:0次
2023-05-01更新
|
815次组卷
|
3卷引用:北京市北京师范大学附属实验中学2022-2023学年高一下学期期中考试化学试题
解题方法
9 . 某小组探究铜与浓硝酸的反应。
【实验】
(1)铜与浓硝酸反应的化学方程式是_______ ,氢氧化钠溶液的作用是_______ 。
小组同学继续探究溶液呈鲜草绿色的原因。
甲同学提出猜想:因为气体溶解后,溶液颜色和气体颜色叠加形成鲜草绿色,设计实1-1及1-2进行验证。
实验1-1:取 反应后混合液于一支试管内,按一定的气体流速将
反应后混合液于一支试管内,按一定的气体流速将 和
和 混合气体通入,有大量红棕色气体逸出,约
混合气体通入,有大量红棕色气体逸出,约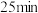 后溶液转为蓝色。
后溶液转为蓝色。
实验1-2:取 反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约
反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约 后溶液转为蓝色
后溶液转为蓝色
(2)乙同学根据以上2个实验的现象证明甲同学的猜想不成立,依据的现象是_______ 。
【查阅资料】
i.铜与浓硝酸反应,开始生成的 溶于水生成
溶于水生成 ,
, 与Cu2+反应生成绿色的化合物;
与Cu2+反应生成绿色的化合物;
ii.一定条件下,Cu2+既可以表现氧化性,又可以表现还原性;
iii.尿素 具有温和的抗氧化性;
具有温和的抗氧化性;
iv.金属和浓硝酸反应过程中有 生成,可大大加快金属与浓硝酸反应的速率。
生成,可大大加快金属与浓硝酸反应的速率。
其原理为:
第一步: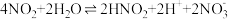
第二步: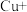 …
…
第三步:
【设计实验】
分别向四支试管内依次加入下列试剂后,同时插入铜丝并记录实验现象。
(3)补全iv中原理的第二步反应:_______ 。
(4)实验2-3中没有绿色出现的原因是_______ 。
(5)因为发生化学反应:_______ 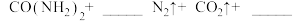 ,因此实验2-4中反应速率较慢。
,因此实验2-4中反应速率较慢。
(6)解释实验1-1和1-2的现象差异原因_______ 。
【实验】
| 实验装置(夹特仪器略) | 实验现象 |
 | 铜片溶解,最初反应较慢,随后加快,有大量红棕色气体放出,反应后试管中溶液呈现鲜草绿色 |
小组同学继续探究溶液呈鲜草绿色的原因。
甲同学提出猜想:因为气体溶解后,溶液颜色和气体颜色叠加形成鲜草绿色,设计实1-1及1-2进行验证。
实验1-1:取
 反应后混合液于一支试管内,按一定的气体流速将
反应后混合液于一支试管内,按一定的气体流速将 和
和 混合气体通入,有大量红棕色气体逸出,约
混合气体通入,有大量红棕色气体逸出,约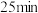 后溶液转为蓝色。
后溶液转为蓝色。实验1-2:取
 反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约
反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约 后溶液转为蓝色
后溶液转为蓝色(2)乙同学根据以上2个实验的现象证明甲同学的猜想不成立,依据的现象是
【查阅资料】
i.铜与浓硝酸反应,开始生成的
 溶于水生成
溶于水生成 ,
, 与Cu2+反应生成绿色的化合物;
与Cu2+反应生成绿色的化合物;ii.一定条件下,Cu2+既可以表现氧化性,又可以表现还原性;
iii.尿素
 具有温和的抗氧化性;
具有温和的抗氧化性;iv.金属和浓硝酸反应过程中有
 生成,可大大加快金属与浓硝酸反应的速率。
生成,可大大加快金属与浓硝酸反应的速率。其原理为:
第一步:
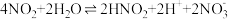
第二步:
 …
…第三步:

【设计实验】
分别向四支试管内依次加入下列试剂后,同时插入铜丝并记录实验现象。
| 编号 | 浓硝酸 | 蒸馏水/滴 | 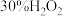 /滴 /滴 |  尿素溶液/滴 尿素溶液/滴 | 现象 |
| 2-1 | 1 | 0 | 0 | 0 | 快速反应,异常剧烈,溶液为鲜草绿色 |
| 2-2 | 1 | 3 | 0 | 0 | 快速反应,异常剧烈,溶液为鲜草绿色 |
| 2-3 | 1 | 0 | 3 | 0 | 反应较慢,溶液为蓝色,没有绿色出现 |
| 2-4 | 1 | 0 | 0 | 3 | 反应较慢,溶液为蓝色,没有绿色出现 |
(4)实验2-3中没有绿色出现的原因是
(5)因为发生化学反应:
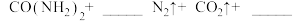 ,因此实验2-4中反应速率较慢。
,因此实验2-4中反应速率较慢。(6)解释实验1-1和1-2的现象差异原因
您最近一年使用:0次
解题方法
10 . 将一定量铁粉和铜粉混合均匀后分为四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成 的体积和剩余金属的质量如表所示(设
的体积和剩余金属的质量如表所示(设 的还原产物只有
的还原产物只有 ):
):
下列说法错误的是
 的体积和剩余金属的质量如表所示(设
的体积和剩余金属的质量如表所示(设 的还原产物只有
的还原产物只有 ):
):| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
稀硝酸的体积/ | 50 | 100 | 150 | 175 |
| 剩余金属的质量/g | 9.0 | 4.8 | 0 | 0 |
 的体积(标准状况)/ 的体积(标准状况)/ | 1120 | 2240 | 3360 | V |
A.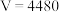 |
B.每等份混合物的质量为 |
C.稀硝酸的物质的量的浓度为 |
D.实验Ⅰ中发生反应的化学方程式为 |
您最近一年使用:0次
2023-04-27更新
|
742次组卷
|
2卷引用:河北省邢台市2022-2023学年高一下学期期中考试化学试题



