1 . 三氯化铁是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。一定量的已生锈的铁屑,恰好溶解于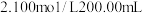 的盐酸中;充分反应后过滤,经检测所得的滤液中
的盐酸中;充分反应后过滤,经检测所得的滤液中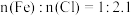 。往滤液中再通入足量
。往滤液中再通入足量 制得
制得 溶液(假设废铁屑中的杂质不与盐酸反应,氧化后制得的
溶液(假设废铁屑中的杂质不与盐酸反应,氧化后制得的 溶液仍为
溶液仍为 )。
)。
(1)滤液中
____  ,
, 和
和 的物质的量之比为
的物质的量之比为______ 。
(2)要将滤液中 恰好转化为
恰好转化为 ,理论上需通入
,理论上需通入____ L标准状况的氯气。
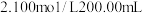 的盐酸中;充分反应后过滤,经检测所得的滤液中
的盐酸中;充分反应后过滤,经检测所得的滤液中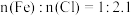 。往滤液中再通入足量
。往滤液中再通入足量 制得
制得 溶液(假设废铁屑中的杂质不与盐酸反应,氧化后制得的
溶液(假设废铁屑中的杂质不与盐酸反应,氧化后制得的 溶液仍为
溶液仍为 )。
)。(1)滤液中

 ,
, 和
和 的物质的量之比为
的物质的量之比为(2)要将滤液中
 恰好转化为
恰好转化为 ,理论上需通入
,理论上需通入
您最近一年使用:0次
名校
解题方法
2 . 人工固氮合成氨,并通过氨氧化法制取硝酸的流程如图所示。
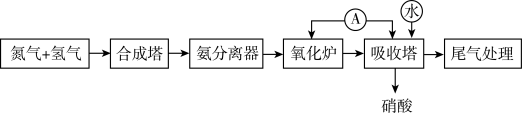
(1)“合成塔”内发生的化学反应中作氧化剂的是_______ (填化学式),金属镁在该氧化剂中燃烧的化学方程式为_______ ,其产物遇水生成的有刺激性气味气体的电子式为_______ ;“氧化炉”中氨气发生反应的化学方程式为_______ 。
(2)常温下,工业上选择铁或铝作盛装浓硝酸的罐体材料的主要原因是_______ 。
(3)为了避免生成硝酸的过程中氮的氧化物污染环境,可用氨气处理尾气,将其转化为大气中含有的无害气体,以处理NO2为例,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(4)取3.2 g铜与30 mL8 mol/L硝酸充分反应,硝酸的还原产物为NO2和NO,反应后溶液中含有a mol H+,则生成的NO2的物质的量为_______ (用含a的代数式表示,下同)mol,NO的物质的量为_______ mol。

(1)“合成塔”内发生的化学反应中作氧化剂的是
(2)常温下,工业上选择铁或铝作盛装浓硝酸的罐体材料的主要原因是
(3)为了避免生成硝酸的过程中氮的氧化物污染环境,可用氨气处理尾气,将其转化为大气中含有的无害气体,以处理NO2为例,该反应中氧化剂与还原剂的物质的量之比为
(4)取3.2 g铜与30 mL8 mol/L硝酸充分反应,硝酸的还原产物为NO2和NO,反应后溶液中含有a mol H+,则生成的NO2的物质的量为
您最近一年使用:0次
2022-05-02更新
|
611次组卷
|
3卷引用:云南省名校联盟2021-2022学年高一下学期期中考试化学试题
名校
3 . 取a g铁粉投入600mL某浓度的稀 溶液中,充分反应后铁粉完全溶解,硝酸恰好完全反应,同时生成标准状况下NO气体6.72L(硝酸的还原产物只有一种)。反应后的溶液中加入足量NaOH溶液,将沉淀过滤、洗涤、充分灼烧得32g红棕色固体。试计算:
溶液中,充分反应后铁粉完全溶解,硝酸恰好完全反应,同时生成标准状况下NO气体6.72L(硝酸的还原产物只有一种)。反应后的溶液中加入足量NaOH溶液,将沉淀过滤、洗涤、充分灼烧得32g红棕色固体。试计算:
(1)加入铁粉的质量
___________ g
(2)原稀 溶液的物质的量浓度是
溶液的物质的量浓度是___________ mol/L
 溶液中,充分反应后铁粉完全溶解,硝酸恰好完全反应,同时生成标准状况下NO气体6.72L(硝酸的还原产物只有一种)。反应后的溶液中加入足量NaOH溶液,将沉淀过滤、洗涤、充分灼烧得32g红棕色固体。试计算:
溶液中,充分反应后铁粉完全溶解,硝酸恰好完全反应,同时生成标准状况下NO气体6.72L(硝酸的还原产物只有一种)。反应后的溶液中加入足量NaOH溶液,将沉淀过滤、洗涤、充分灼烧得32g红棕色固体。试计算:(1)加入铁粉的质量

(2)原稀
 溶液的物质的量浓度是
溶液的物质的量浓度是
您最近一年使用:0次
2022-04-20更新
|
724次组卷
|
2卷引用:浙江省衢温“5+1”联盟2021-2022学年高一下学期期中考试化学试题
4 . 把密度为1.6g/ cm3的液态S2Cl2 10mL溶于石油醚(一种溶剂), 得到100mL溶液,把它慢慢加入50 mL3.2mol/L的SO2水溶液中,振荡使之充分反应,当加入的S2Cl2溶液为67.5mL时,恰好反应完全。生成物用含0.32mol KOH的KOH溶液中和后,恰好完全转化为KCl和一种二元含氧酸的钾盐晶体。请计算
(1)参与反应的n(S2Cl2): n(SO2)=1:_______
(2)确定二元含氧酸的化学式_______ 。
(1)参与反应的n(S2Cl2): n(SO2)=1:
(2)确定二元含氧酸的化学式
您最近一年使用:0次
5 . 请回答下列问题:
(1)标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,则所得盐酸物质的量浓度为_______
(2)将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为_______
(3)在200 mL氯化镁和氯化铝的混合溶液中,c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为_______
(4)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入112 mL Cl2(标准状况下),恰好将Fe2+完全氧化。x值为_______
(5)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是_______
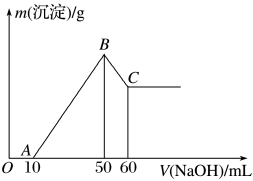
(6)某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示。则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为_______
(1)标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,则所得盐酸物质的量浓度为
(2)将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为
(3)在200 mL氯化镁和氯化铝的混合溶液中,c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为
(4)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入112 mL Cl2(标准状况下),恰好将Fe2+完全氧化。x值为
(5)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是
(6)某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示。则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为
您最近一年使用:0次
2022-04-04更新
|
1344次组卷
|
4卷引用:江苏省天一中学2021-2022学年高一上学期期末考试化学(强化班)试题
江苏省天一中学2021-2022学年高一上学期期末考试化学(强化班)试题(已下线)专题02 阿伏加德罗常数及其化学计算 (测)-2023年高考化学二轮复习讲练测(新高考专用)四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题(已下线)衔接点19 物质的量在化学方程式计算中的应用-2024年初升高化学无忧衔接(通用版)
名校
解题方法
6 . 配平以下方程式并用单线桥法标出下列反应电子转移的方向和数目。(若系数为“1”,请标出)
(1)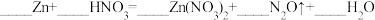
_______ 。
(2)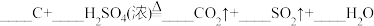
_______ 。
(3)
_______ 。
(4)
_______ 。
(5)
_______ 。
(6)
_______ 。
(1)
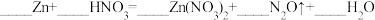
(2)
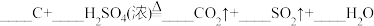
(3)

(4)

(5)

(6)

您最近一年使用:0次
2022高三·全国·专题练习
7 . 产品纯度的测定:准确称取1.000g产品,加入适量蒸馏水配成 溶液;取
溶液;取 待测液于锥形瓶中,加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应;滴加几滴淀粉溶液,用
待测液于锥形瓶中,加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应;滴加几滴淀粉溶液,用
 标准液滴定,至滴定终点。重复3次,测得标准液体积平均值为
标准液滴定,至滴定终点。重复3次,测得标准液体积平均值为 。(滴定反应的离子方程为:
。(滴定反应的离子方程为: )假设杂质不参加反应,则产品中
)假设杂质不参加反应,则产品中 的质量分数是
的质量分数是_______ %。
 溶液;取
溶液;取 待测液于锥形瓶中,加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应;滴加几滴淀粉溶液,用
待测液于锥形瓶中,加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应;滴加几滴淀粉溶液,用
 标准液滴定,至滴定终点。重复3次,测得标准液体积平均值为
标准液滴定,至滴定终点。重复3次,测得标准液体积平均值为 。(滴定反应的离子方程为:
。(滴定反应的离子方程为: )假设杂质不参加反应,则产品中
)假设杂质不参加反应,则产品中 的质量分数是
的质量分数是
您最近一年使用:0次
8 . 将21.6g生锈的铁粉(铁锈主要成分为Fe2O3·xH2O)放入200mL3.5mol/L的盐酸中,完全溶解后产生气体3.36L(标准状况),向反应后的溶液中滴入几滴KSCN溶液,溶液无明显现象,再向溶液中加入NaHCO3至溶液pH=7,又产生气体2.24L(标准状况)。已知:氧化性Fe3+>H+,回答下列问题:
(1)写出铁粉溶解过程中氧化还原反应的离子方程式:___________ 。
(2)反应产生的前后两种气体质量之比为___________ 。
(3)计算生锈铁粉中铁元素的质量分数(无计算过程不给分)___________ 。
(1)写出铁粉溶解过程中氧化还原反应的离子方程式:
(2)反应产生的前后两种气体质量之比为
(3)计算生锈铁粉中铁元素的质量分数(无计算过程不给分)
您最近一年使用:0次
2022-01-20更新
|
420次组卷
|
2卷引用:四川省绵阳市2021-2022学年高一上学期期末考试化学试题
解题方法
9 . 将130gZn投入100mL18mol•L-1浓硫酸中充分反应,最终剩余Zn32.5g,同时生成标准状况下的气体体积为aL。已知:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。
(1)a=______ L。
(2)生成气体的物质的量分别为_____ 。
(3)将反应后的溶液稀释至1L,所得溶液中SO 浓度为
浓度为_____ 。
(1)a=
(2)生成气体的物质的量分别为
(3)将反应后的溶液稀释至1L,所得溶液中SO
 浓度为
浓度为
您最近一年使用:0次
解题方法
10 . 纳米级Cu2O可以作为太阳光分解水的催化剂,有这重要的应用前景。在加热的条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2,写出该反应的化学方程式_______ 。当收集的N2体积为3.36L(标准状况),计算制得纳米Cu2O的质量_______ 和转移电子数_______ 。
您最近一年使用:0次



