2023高三·全国·专题练习
1 . 硒和碲的单质是重要的高新技术材料。一种以含贵重金属的“酸泥”(含Se、Te、Ag、Pb、Cu等单质)为原料制备硒和碲的工艺流程如图所示。

要制取395g粗硒(质量分数为80%),理论上至少应通入标准状况下的SO2的体积为_______ L。

要制取395g粗硒(质量分数为80%),理论上至少应通入标准状况下的SO2的体积为
您最近一年使用:0次
2023高三·全国·专题练习
2 . 二氧化铈(CeO2)是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用CeO2在稀硫酸和H2O2的作用下可生成Ce3+,H2O2在该反应中作_______ (填“氧化”“还原”)剂,每有1molH2O2参加反应,转移电子的物质的量为_______ 。
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
3 . 储氢材料Mg(AlH4)2在110℃~200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,每生成27gAl转移电子的物质的量为_______ 。
您最近一年使用:0次
2023高三·全国·专题练习
4 . 在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,否则会发生反应:KMnO4+C+H2O→MnO2+X+K2CO3(未配平),其中X的化学式为_______ 。当有1molX生成时,反应转移电子_______ mol。
您最近一年使用:0次
2022高一·上海·专题练习
解题方法
5 . 某工厂生产硫酸,使用一种含杂质为25%的黄铁矿样品。已知黄铁矿与氧气反应的化学方程式为4FeS2+11O2 2Fe2O3+8SO2 若取1吨该矿石,可制得98%的浓硫酸
2Fe2O3+8SO2 若取1吨该矿石,可制得98%的浓硫酸_______ 吨(设生产过程中硫损失2%)。(提示:用关系式法或原子守恒法进行计算)
 2Fe2O3+8SO2 若取1吨该矿石,可制得98%的浓硫酸
2Fe2O3+8SO2 若取1吨该矿石,可制得98%的浓硫酸
您最近一年使用:0次
名校
6 . 回答下列问题:
(1)写出 的电离方程式
的电离方程式_________ 。
(2)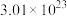 个
个 含
含_________ mol氧原子,氧原子的质量为_________ 。
(3)在同温同压条件下, 和
和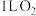 的物质的量之比为
的物质的量之比为_________ ,分子个数之比是_________ 。
(4)有 溶液,从该溶液中取出10mL,则
溶液,从该溶液中取出10mL,则
_________ ,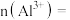
_________ 。
(5)用 氧化溶质质量分数为36.5%的盐酸。反应方程式如下:
氧化溶质质量分数为36.5%的盐酸。反应方程式如下: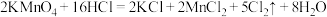 ;问题:
;问题: 至少能消耗HCl的物质的量为
至少能消耗HCl的物质的量为_________ mol?被氧化的HCl为_________ mol?
(6)在无土栽培中,配制1L内含 、
、 、
、 的某营养液。若用KCl、
的某营养液。若用KCl、 、
、 配制,则需这三种固体物质的量分别为
配制,则需这三种固体物质的量分别为_________ mol、_________ mol、_________ mol。
(1)写出
 的电离方程式
的电离方程式(2)
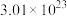 个
个 含
含(3)在同温同压条件下,
 和
和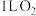 的物质的量之比为
的物质的量之比为(4)有
 溶液,从该溶液中取出10mL,则
溶液,从该溶液中取出10mL,则
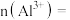
(5)用
 氧化溶质质量分数为36.5%的盐酸。反应方程式如下:
氧化溶质质量分数为36.5%的盐酸。反应方程式如下: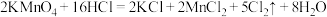 ;问题:
;问题: 至少能消耗HCl的物质的量为
至少能消耗HCl的物质的量为(6)在无土栽培中,配制1L内含
 、
、 、
、 的某营养液。若用KCl、
的某营养液。若用KCl、 、
、 配制,则需这三种固体物质的量分别为
配制,则需这三种固体物质的量分别为
您最近一年使用:0次
名校
7 . 按照要求回答下列问题。
(1)胆矾的化学式为 (该晶体的摩尔质量为
(该晶体的摩尔质量为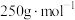 ),则25g该晶体中含氧原子的物质的量为
),则25g该晶体中含氧原子的物质的量为___________ mol。
(2)气态化合物A的化学式可以表示为 ,已知同温同压下
,已知同温同压下 A受热完全分解生成
A受热完全分解生成
 和
和
 ,则A的化学式为
,则A的化学式为___________ 。
(3)

 溶液中的
溶液中的 的物质的量浓度为
的物质的量浓度为___________  。
。
(4)向
 和
和 的混合溶液中加入含
的混合溶液中加入含
 的盐酸恰好反应(反应后溶质只有
的盐酸恰好反应(反应后溶质只有 ),则原混合溶液中
),则原混合溶液中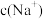 为
为___________  。
。
(5)已知铜和浓硫酸可以在加热条件下发生反应的化学方程式如下
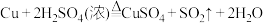
一定量铜片与
 浓
浓 充分反应,若反应过程中转移了
充分反应,若反应过程中转移了 电子,生成的
电子,生成的 的物质的量为
的物质的量为___________ mol,将反应后所得到的溶液稀释后与足量 溶液反应,所得沉淀的质量为
溶液反应,所得沉淀的质量为___________ g。( 的摩尔质量为
的摩尔质量为 ,
, 的摩尔质量为
的摩尔质量为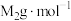 ,用含
,用含 和
和 的式子表达)
的式子表达)
(1)胆矾的化学式为
 (该晶体的摩尔质量为
(该晶体的摩尔质量为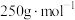 ),则25g该晶体中含氧原子的物质的量为
),则25g该晶体中含氧原子的物质的量为(2)气态化合物A的化学式可以表示为
 ,已知同温同压下
,已知同温同压下 A受热完全分解生成
A受热完全分解生成
 和
和
 ,则A的化学式为
,则A的化学式为(3)


 溶液中的
溶液中的 的物质的量浓度为
的物质的量浓度为 。
。(4)向

 和
和 的混合溶液中加入含
的混合溶液中加入含
 的盐酸恰好反应(反应后溶质只有
的盐酸恰好反应(反应后溶质只有 ),则原混合溶液中
),则原混合溶液中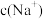 为
为 。
。(5)已知铜和浓硫酸可以在加热条件下发生反应的化学方程式如下
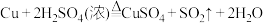
一定量铜片与

 浓
浓 充分反应,若反应过程中转移了
充分反应,若反应过程中转移了 电子,生成的
电子,生成的 的物质的量为
的物质的量为 溶液反应,所得沉淀的质量为
溶液反应,所得沉淀的质量为 的摩尔质量为
的摩尔质量为 ,
, 的摩尔质量为
的摩尔质量为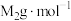 ,用含
,用含 和
和 的式子表达)
的式子表达)
您最近一年使用:0次
解题方法
8 . 硅酸盐材料具有硬度高、难溶于水、耐高温等特点。硅酸盐中常含有Al、K等元素,如钾长石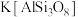 和钠长石
和钠长石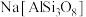 等。回答下列问题:
等。回答下列问题:
(1)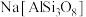 用氧化物形式表示为
用氧化物形式表示为_______ 。
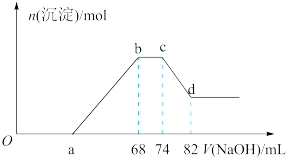
(2)我国科学家发现在200℃熔盐体系中,采用金属Al还原钾长石等制备纳米硅材料的方法,将该材料应用于锂离子电池负极材料,展示出优异的电化学性能。配平下列方程式:_______ 。
______Al+______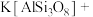 ______
______ →______Si+_____AlOCl+_____
→______Si+_____AlOCl+_____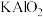 。
。
(3)将钾长石或钠长石用足量稀盐酸处理后,所得固体为_______ (填化学式)。
(4)将一定质量的铝粉和铁粉的混合物加入到一定量很稀的硝酸溶液中,充分反应,反应过程中无气体放出。向反应结束后的溶液中,逐滴加入5mol∙L-1的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量(n)关系如图所示:
①根据关系图,写出Fe与稀硝酸反应的离子方程式:_______ 。
②样品中铝粉和铁粉的物质的量之比为_______ 。
③a点对应NaOH溶液的体积为_______ 。
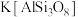 和钠长石
和钠长石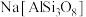 等。回答下列问题:
等。回答下列问题:(1)
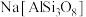 用氧化物形式表示为
用氧化物形式表示为(2)我国科学家发现在200℃熔盐体系中,采用金属Al还原钾长石等制备纳米硅材料的方法,将该材料应用于锂离子电池负极材料,展示出优异的电化学性能。配平下列方程式:
______Al+______
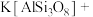 ______
______ →______Si+_____AlOCl+_____
→______Si+_____AlOCl+_____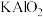 。
。(3)将钾长石或钠长石用足量稀盐酸处理后,所得固体为
(4)将一定质量的铝粉和铁粉的混合物加入到一定量很稀的硝酸溶液中,充分反应,反应过程中无气体放出。向反应结束后的溶液中,逐滴加入5mol∙L-1的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量(n)关系如图所示:

①根据关系图,写出Fe与稀硝酸反应的离子方程式:
②样品中铝粉和铁粉的物质的量之比为
③a点对应NaOH溶液的体积为
您最近一年使用:0次
解题方法
9 . 氧化亚铜 可用于生产船底防污漆,防止海洋生物对船舶设备的污损。现将
可用于生产船底防污漆,防止海洋生物对船舶设备的污损。现将 和Cu的固体混合物20 g放入烧杯中,加入质量分数为24.5%的稀硫酸50 g,恰好完全反应。已知:
和Cu的固体混合物20 g放入烧杯中,加入质量分数为24.5%的稀硫酸50 g,恰好完全反应。已知: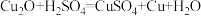 。请计算:
。请计算:
(1)原混合物中 的质量(写出计算过程)
的质量(写出计算过程) _______ 。
(2)在图中画出向20 g 和Cu的固体混合物中逐滴加入24.5%的稀硫酸至过量,固体中铜元素的质量变化曲线图,并标明必要的数据
和Cu的固体混合物中逐滴加入24.5%的稀硫酸至过量,固体中铜元素的质量变化曲线图,并标明必要的数据_______ 。

(3)氧化亚铜可用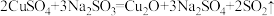 原理制备。
原理制备。
①反应过程中产生 可循环利用,因此应该选用
可循环利用,因此应该选用_______ 溶液来吸收它。
②反应过程中溶液pH将_______ (填“变大”“变小”或“不变”),因此制备过程,要控制溶液的酸碱度,因为如果反应时溶液pH过小,会导致产品下降,原因是_______ 。
 可用于生产船底防污漆,防止海洋生物对船舶设备的污损。现将
可用于生产船底防污漆,防止海洋生物对船舶设备的污损。现将 和Cu的固体混合物20 g放入烧杯中,加入质量分数为24.5%的稀硫酸50 g,恰好完全反应。已知:
和Cu的固体混合物20 g放入烧杯中,加入质量分数为24.5%的稀硫酸50 g,恰好完全反应。已知: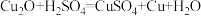 。请计算:
。请计算:(1)原混合物中
 的质量(写出计算过程)
的质量(写出计算过程) (2)在图中画出向20 g
 和Cu的固体混合物中逐滴加入24.5%的稀硫酸至过量,固体中铜元素的质量变化曲线图,并标明必要的数据
和Cu的固体混合物中逐滴加入24.5%的稀硫酸至过量,固体中铜元素的质量变化曲线图,并标明必要的数据
(3)氧化亚铜可用
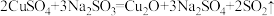 原理制备。
原理制备。①反应过程中产生
 可循环利用,因此应该选用
可循环利用,因此应该选用②反应过程中溶液pH将
您最近一年使用:0次
名校
解题方法
10 . 完成下列问题。
(1)已知完全断裂物质的量均为1mol的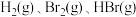 中的化学键时吸收能量分别为
中的化学键时吸收能量分别为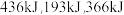 。则在该条件下,
。则在该条件下,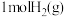 与
与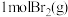 完全反应会
完全反应会_______ (填“吸收”或“放出”)_______  能量。
能量。
(2)将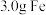 和
和 的混合粉末完全溶于
的混合粉末完全溶于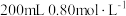 盐酸中,生成标准状况下
盐酸中,生成标准状况下 (假设气体被完全收集);反应后的溶液中滴入2滴
(假设气体被完全收集);反应后的溶液中滴入2滴 溶液后不显血红色。请通过分析计算回答:
溶液后不显血红色。请通过分析计算回答:
①则混合粉末中Fe的物质的量是_______ mol;
②若在反应后的混合液中加入锌,则理论上最多可溶解锌的质量是_______ g。
(1)已知完全断裂物质的量均为1mol的
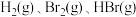 中的化学键时吸收能量分别为
中的化学键时吸收能量分别为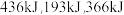 。则在该条件下,
。则在该条件下,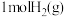 与
与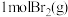 完全反应会
完全反应会 能量。
能量。(2)将
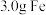 和
和 的混合粉末完全溶于
的混合粉末完全溶于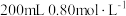 盐酸中,生成标准状况下
盐酸中,生成标准状况下 (假设气体被完全收集);反应后的溶液中滴入2滴
(假设气体被完全收集);反应后的溶液中滴入2滴 溶液后不显血红色。请通过分析计算回答:
溶液后不显血红色。请通过分析计算回答:①则混合粉末中Fe的物质的量是
②若在反应后的混合液中加入锌,则理论上最多可溶解锌的质量是
您最近一年使用:0次



