解题方法
1 . 氙和氟气反应,生成含有XeF2和XeF4的固体混合物,现用两份等质量的此种固体混合物,分别做下面的化学分析:
①用水处理此固体,获得60. 2mL气体(在17°C和1.00×105Pa条件下),其中有24. 1mL是氧气,其余的是氙气,水溶液中的XeO3可以氧化30. 0mL。浓度为0. 100 mol/L的Fe2+。
②用KI溶液处理此固体,获得单质碘,此碘需要35.0mL浓度为0.200mol/L的Na2S2O3与之完全反应。
试求:此固体混合物中XeF2和XeF4的物质的量分数___________ 。(提示:XeF2与H2O仅发生氧化还原反应;XeF4与H2O反应时,有一半的XeF4与水发生氧化还原反应,另一半的XeF4则发生歧化反应。)
①用水处理此固体,获得60. 2mL气体(在17°C和1.00×105Pa条件下),其中有24. 1mL是氧气,其余的是氙气,水溶液中的XeO3可以氧化30. 0mL。浓度为0. 100 mol/L的Fe2+。
②用KI溶液处理此固体,获得单质碘,此碘需要35.0mL浓度为0.200mol/L的Na2S2O3与之完全反应。
试求:此固体混合物中XeF2和XeF4的物质的量分数
您最近一年使用:0次
2 . Ⅰ.如图所示,一密闭容器被无摩擦可滑动的两隔板a和b分成甲、乙两室。标准状况下,在乙室中充入0.6 mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9 g。

(1)甲室中NH3、H2的物质的量之比为___________ ,质量之比为___________ 。
(2)甲室中气体的物质的量为___________ mol。
(3)甲室中气体的质量为___________ g。
(4)将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),当HCl与NH3完全反应后,活塞b将位于刻度“___________ ”处(填数字)。
Ⅱ.(1)向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是___________ 。
A. p=m+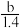 B.p=m+
B.p=m+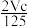 C.n=m+
C.n=m+ D. n=m+
D. n=m+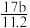
(2)一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为___________ 。提示:①H2C2O4是二元弱酸 ②10KHC2O4·H2C2O4+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O

(1)甲室中NH3、H2的物质的量之比为
(2)甲室中气体的物质的量为
(3)甲室中气体的质量为
(4)将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),当HCl与NH3完全反应后,活塞b将位于刻度“
Ⅱ.(1)向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A. p=m+
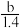 B.p=m+
B.p=m+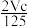 C.n=m+
C.n=m+ D. n=m+
D. n=m+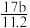
(2)一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
您最近一年使用:0次
解题方法
3 . 化学正在走向精准。当代化学的三大支柱是:理论、实验和计算。
Ⅰ.某溶液为硫酸和硝酸混合后的稀溶液,取200.00mL,该溶液加入过量锌粉充分反应。反应后溶液中只含有一种溶质,其浓度为 (溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。
(溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。______
Ⅱ.某硫铜矿的主要成分为 ,可用于冶炼金属铜,为测定矿石中
,可用于冶炼金属铜,为测定矿石中 的质量分数,进行如下实验(杂质不参加反应):
的质量分数,进行如下实验(杂质不参加反应):
步骤1:在1.00g试样中加入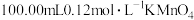 的酸性溶液,加热,硫元素全部转化为
的酸性溶液,加热,硫元素全部转化为 ,铜元素全部转化为
,铜元素全部转化为 ,滤去不溶性杂质。
,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用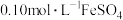 溶液与剩余
溶液与剩余 恰好反应,消耗10.00mL。列式计算
恰好反应,消耗10.00mL。列式计算 的质量分数
的质量分数______ 。
Ⅰ.某溶液为硫酸和硝酸混合后的稀溶液,取200.00mL,该溶液加入过量锌粉充分反应。反应后溶液中只含有一种溶质,其浓度为
 (溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。
(溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。Ⅱ.某硫铜矿的主要成分为
 ,可用于冶炼金属铜,为测定矿石中
,可用于冶炼金属铜,为测定矿石中 的质量分数,进行如下实验(杂质不参加反应):
的质量分数,进行如下实验(杂质不参加反应):步骤1:在1.00g试样中加入
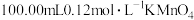 的酸性溶液,加热,硫元素全部转化为
的酸性溶液,加热,硫元素全部转化为 ,铜元素全部转化为
,铜元素全部转化为 ,滤去不溶性杂质。
,滤去不溶性杂质。步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用
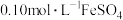 溶液与剩余
溶液与剩余 恰好反应,消耗10.00mL。列式计算
恰好反应,消耗10.00mL。列式计算 的质量分数
的质量分数
您最近一年使用:0次
4 . 甲酸和乙酸都是重要的化工原料。移取20.00mL甲酸和乙酸的混合溶液,以0.1000mol·L-1NaOH标准溶液滴定至终点,消耗25.00mL。另取20.00mL上述混合溶液,加入50.00mL0.02500mol·L-1KMnO4强碱性溶液,反应完全后,调节至酸性,加入40.00mL0.02000mol·L-1Fe2+标准溶液,用上述KMnO4标准溶液滴定至终点,消耗24.00mL。
(1)计算混合溶液中甲酸和乙酸的总量_______ 。
(2)写出氧化还原滴定反应的化学方程式_______ 。
(3)计算混合酸溶液中甲酸和乙酸的浓度_______ 。
(1)计算混合溶液中甲酸和乙酸的总量
(2)写出氧化还原滴定反应的化学方程式
(3)计算混合酸溶液中甲酸和乙酸的浓度
您最近一年使用:0次
5 . 尿磷是指尿中的全部无机磷酸盐,尿中尿磷的正常值成人为22 ~ 48 mmol/24h,儿童为16~ 48mmol/24h。某些疾病可引起尿磷升高,而另一些疾病会使尿磷降低。在测定磷酸盐的分光光度法中,大多是利用在酸性介质中磷酸盐与钼酸盐形成磷钼杂多酸的反应,反应产物是黄色的,又称磷钼黄。为提高灵敏度,一般采用钼蓝法:在温和条件下将磷钼黄还原为磷钼蓝(MoO2·4MoO3)2·H3PO4·4H2O,然后进行测定。一种测定尿磷 (原子量30.97) 的方法如下:尿液用钼(VI)处理,生成磷钼复合物,然后用4-氨基-3羟基-1-蔡磺酸还原,形成磷钼蓝,其最大吸收波长为690 nm。某患者24小时排尿总量1270 mL,今移取该尿液1.00 mL用钼试剂和4-氨基-3-羟基-1-蔡磺酸处理并稀释至50.0 mL,同法处理磷酸盐标准溶液系列,以试剂空白溶液作参比,在690 nm波长处测定吸光值,结果如下:
(1)该组测定数据符合一元线性回归方程y=bx+a,计算该患者每天排出的磷有多少克__________ 。
(2)计算该尿液中磷酸盐的浓度(mmol·L-1)__________ 。
(3)写出在酸性介质中磷酸盐与钼酸铵生成磷钼黄的离子反应方程式__________ 。
(4)写出用4-氨基-3-羟基-1-萘磺酸将磷钼黄还原为磷钼蓝的反应式(有机物用结构式表示)__________ 。
| 测试溶液 | 吸光值 |
| 1.00 ppm P | 0.205 |
| 2.00 ppm P | 0.410 |
| 3.00 ppm P | 0.615 |
| 4.00 ppm P | 0.820 |
| 尿样 | 0.625 |
(1)该组测定数据符合一元线性回归方程y=bx+a,计算该患者每天排出的磷有多少克
(2)计算该尿液中磷酸盐的浓度(mmol·L-1)
(3)写出在酸性介质中磷酸盐与钼酸铵生成磷钼黄的离子反应方程式
(4)写出用4-氨基-3-羟基-1-萘磺酸将磷钼黄还原为磷钼蓝的反应式(有机物用结构式表示)
您最近一年使用:0次
6 . 钒是人体不可缺少的元素,Heyliger 等首次报道了偏钒酸钠显著降低糖尿病大鼠血糖的作用后,钒化学的研究得到了很大发展。钒及其化合物也广泛应用于特种钢、催化剂、颜料、染料、电子材料及防腐剂等等领域。
(1)钒酸盐与磷酸盐结构相似。请画出VO 、H2VO
、H2VO 、VO2(H2O)
、VO2(H2O)  和V2O
和V2O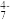 的空间构型
的空间构型__________ 。
(2)生理条件下的钒以多种氧化态存在,各种氧化态可以相互转化。通常细胞外的钒是V(V), 。而细胞内的钒是V(IV)。研究表明,钒酸二氢根离子可与亚铁血红素(Mtrc-Fe2+)反应,写出该反应的离子方程式__________ 。
(3)①已知配合物[VON(CH2COO)3]在水溶液中的几何构型是唯一 的,画出它的空间构型图__________ 。
②理论推测上述配合物分子在晶体中是有手性的,指出产生手性的原因__________ 。
(4)钒酸钇晶体是近年来新开发出的优良双折射光学晶体,在光电产业中得到广泛应用。可以在弱碱性溶液中用偏钒酸铵和硝酸钇合成。写出以Y2O3与V2O5为主要原料合成钒酸钇的化学方程式__________ 。
(5)若以市售分析纯偏钒酸铵为原料制备高纯钒酸钇单晶,需将杂质铁离子含量降至一定数量级。设每升偏钒酸铵溶液中含三价铁离子为5.0 ×10-5 mol,用0.01 mol dm-3的鏊合剂除铁。
①说明不采取使铁离子水解析出沉淀的方法除铁的理由__________ 。
②通过计算说明如何选择螯合剂使偏钒酸铵含铁量降至10-30moldm-3以下__________ 。
(1)钒酸盐与磷酸盐结构相似。请画出VO
 、H2VO
、H2VO 、VO2(H2O)
、VO2(H2O)  和V2O
和V2O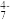 的空间构型
的空间构型(2)生理条件下的钒以多种氧化态存在,各种氧化态可以相互转化。通常细胞外的钒是V(V), 。而细胞内的钒是V(IV)。研究表明,钒酸二氢根离子可与亚铁血红素(Mtrc-Fe2+)反应,写出该反应的离子方程式
(3)①已知配合物[VON(CH2COO)3]在水溶液中的几何构型是唯一 的,画出它的空间构型图
②理论推测上述配合物分子在晶体中是有手性的,指出产生手性的原因
(4)钒酸钇晶体是近年来新开发出的优良双折射光学晶体,在光电产业中得到广泛应用。可以在弱碱性溶液中用偏钒酸铵和硝酸钇合成。写出以Y2O3与V2O5为主要原料合成钒酸钇的化学方程式
(5)若以市售分析纯偏钒酸铵为原料制备高纯钒酸钇单晶,需将杂质铁离子含量降至一定数量级。设每升偏钒酸铵溶液中含三价铁离子为5.0 ×10-5 mol,用0.01 mol dm-3的鏊合剂除铁。
①说明不采取使铁离子水解析出沉淀的方法除铁的理由
②通过计算说明如何选择螯合剂使偏钒酸铵含铁量降至10-30moldm-3以下
| 配离子 |  |
| [Fe(edta)]2- [Fe(edta)]- [Fe(phen)3]2+ [Fe(phen)3]3+ | 2.1×1014 1.7×1024 2.0×1021 1.3×1014 |
| 沉淀 | Ksp |
| Fe(OH)2 Fe(OH)3 | 8.0×10-16 4.0×10-38 |
您最近一年使用:0次
解题方法
7 . 已知Na2S与S可以形成多硫化物Na2Sx。现将7.80gNa2S配置成100mL溶液,取 10mL 该溶液 ,加入一定质量的硫粉充分反应,检测反应后的溶液中仅含有S 、S
、S 、S2-且比例为1:2:2(不考虑其他副反应)。
、S2-且比例为1:2:2(不考虑其他副反应)。
请回答:
(1)反应前Na2S溶液的浓度为___ mol/L。
(2)硫粉的质量为___ g(写出计算过程)。
 、S
、S 、S2-且比例为1:2:2(不考虑其他副反应)。
、S2-且比例为1:2:2(不考虑其他副反应)。请回答:
(1)反应前Na2S溶液的浓度为
(2)硫粉的质量为
您最近一年使用:0次
2021-06-30更新
|
177次组卷
|
2卷引用:浙江省宁波市九校2020-2021学年高二下学期期末联考化学试题
8 . (1)相同体积的三种溶液 、
、 、
、 ,所含
,所含 的物质的量浓度相同,各溶质的物质的量浓度之比为
的物质的量浓度相同,各溶质的物质的量浓度之比为___________ 。
(2)已知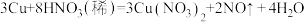 ;该反应中,若被还原的
;该反应中,若被还原的 为1mol,转移电子的物质的量为
为1mol,转移电子的物质的量为___________ mol。
(3)将15.8gNaOH与 的混合物全部溶于一定量的水中,生成气体体积为1.12L(标况下)。若反应后溶液中的粒子个数关系为:
的混合物全部溶于一定量的水中,生成气体体积为1.12L(标况下)。若反应后溶液中的粒子个数关系为: ,则原混合物中NaOH与
,则原混合物中NaOH与 的物质的量之比为
的物质的量之比为___________ ;形成这样的溶液,所需水的体积为___________ mL(水的密度以1.00 计)。
计)。
 、
、 、
、 ,所含
,所含 的物质的量浓度相同,各溶质的物质的量浓度之比为
的物质的量浓度相同,各溶质的物质的量浓度之比为(2)已知
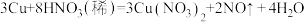 ;该反应中,若被还原的
;该反应中,若被还原的 为1mol,转移电子的物质的量为
为1mol,转移电子的物质的量为(3)将15.8gNaOH与
 的混合物全部溶于一定量的水中,生成气体体积为1.12L(标况下)。若反应后溶液中的粒子个数关系为:
的混合物全部溶于一定量的水中,生成气体体积为1.12L(标况下)。若反应后溶液中的粒子个数关系为: ,则原混合物中NaOH与
,则原混合物中NaOH与 的物质的量之比为
的物质的量之比为 计)。
计)。
您最近一年使用:0次
名校
解题方法
9 . 高锰酸钾受热易分解,在不同温度下,发生如下反应:
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
3K2MnO4 2K3MnO4+MnO2+O2↑
2K3MnO4+MnO2+O2↑
已知:M(KMnO4)=158g/mol,M(MnO2)=87g/mol
请回答:
(1)取12.64gKMnO4固体,加热到300℃至完全分解,得到标准状况下O2的体积为___________ mL。
(2)取12.64gKMnO4固体,加热至700℃,一段时间后剩余固体的质量为11.04g,则剩余固体中的MnO2质量为___________ g。
(3)取(2)剩余固体与足量的浓盐酸在加热条件下充分反应,生成Cl2,产物中锰元素以Mn2+存在;则Cl2物质的量为___________ mol。
2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑3K2MnO4
 2K3MnO4+MnO2+O2↑
2K3MnO4+MnO2+O2↑已知:M(KMnO4)=158g/mol,M(MnO2)=87g/mol
请回答:
(1)取12.64gKMnO4固体,加热到300℃至完全分解,得到标准状况下O2的体积为
(2)取12.64gKMnO4固体,加热至700℃,一段时间后剩余固体的质量为11.04g,则剩余固体中的MnO2质量为
(3)取(2)剩余固体与足量的浓盐酸在加热条件下充分反应,生成Cl2,产物中锰元素以Mn2+存在;则Cl2物质的量为
您最近一年使用:0次
2021-06-17更新
|
757次组卷
|
2卷引用:浙江省温州市2020-2021学年高一下学期期末教学质量统一监测(学考模拟)化学试题
10 . 空气中含有少量臭氧(O3)可以起到消毒、杀菌的作用。但臭氧过量会对人体有害。我国的环境空气质量标准对空气中臭氧的最高浓度(单位体积的空气中所含臭氧的质量)限值如下表所示:
臭氧与KI溶液反应,生成1种可使带火星木条复燃的气体,反应后的溶液能使酚酞试液变红,也能使蘸有淀粉溶液的滤纸条变蓝。为测定某地臭氧的含量,将50m3的空气通过足量的KI溶液,使臭氧完全反应:在所得溶液中再加入适量的Na2S2O3溶液(含Na2S2O3的质量为47.4mg)。恰好完全反应(2Na2S2O3+I2=Na2S4O6+2NaI)。
①O3与KI反应的化学方程式:_______ 。
②通过计算确定该地区空气中臭氧浓度的级别_______ 。
| 浓度限值(mg/m3) | ||
| 一级标准0.12 | 二级标准0.16 | 三级标准0.20 |
臭氧与KI溶液反应,生成1种可使带火星木条复燃的气体,反应后的溶液能使酚酞试液变红,也能使蘸有淀粉溶液的滤纸条变蓝。为测定某地臭氧的含量,将50m3的空气通过足量的KI溶液,使臭氧完全反应:在所得溶液中再加入适量的Na2S2O3溶液(含Na2S2O3的质量为47.4mg)。恰好完全反应(2Na2S2O3+I2=Na2S4O6+2NaI)。
①O3与KI反应的化学方程式:
②通过计算确定该地区空气中臭氧浓度的级别
您最近一年使用:0次



